MicroRNA在中耳胆脂瘤发病机制研究进展
巴合提江·托克吉各特 阿依恒·曲库尔汗新疆医科大学第一附属医院耳鼻喉科(新疆830054)
MicroRNA在中耳胆脂瘤发病机制研究进展
巴合提江·托克吉各特阿依恒·曲库尔汗
新疆医科大学第一附属医院耳鼻喉科(新疆830054)
【摘要】微小RNA(MicroRNA)是生物体内小分子RNA,参与细胞内转录调节、能量代谢、生长发育、增殖等多生物学功能,是人体内细胞基因调控中的重要调节分子。近年来大量胆脂瘤发生、发展中的分子生物学研究取得了新进展,其中miRNA在胆脂瘤的研究中开辟了新的研究领域。近来大量报道认为miR-21可能与胆脂瘤的发病机制有关,并且在胆脂瘤生长调节和扩散中具有潜在作用。本文针对miR-21在细胞信号通路间及相互作用对于中耳胆脂瘤发生、发展中的作用机制进行了综述。
【关键词】中耳胆脂瘤微小RNAs发病机制
Project supported by the natural science foundation of the Xinjiang Uygur Autonomous Region(201321 1A098).
The authors claim that there is no conflict of interest.
1 中耳胆脂瘤(cholesteatoma of middle ear)
中耳胆脂瘤是一种上皮的良性病变,通常病程较长且易破坏中耳骨性结构,有时也累及至内耳。角质化的鳞状上皮细胞在中耳及乳突内增生引起相应病变[1]。常见的症状包括耳痛、有恶臭的耳漏、听力损失等,而潜在的中枢神经系统并发症是致命性的(例如脑脓肿、脑膜炎)。胆脂瘤的形成多因为内部分子生物学失调和外部刺激相互作用,这其中存在一种学说认为上皮细胞增殖、角质细胞形成、分化、成熟、细胞凋亡和自净机制之间的不平衡以及由此引起的恶性循环,导致破骨细胞、细胞外骨基质细胞的增殖、退化,破骨细胞的激活造成骨质破坏,导致疾病的进一步发展[2]。尽管已经进行了大量中耳胆脂瘤相关的生物学研究,但是仍有许多问题尚未解决。该病的分子生物学研究方法是揭示胆脂瘤发生、发展过程的重要手段。
2 MicroRNAs分子
MicroRNA(miRNA)广泛存在于多种生物的基因组中,在基因表达转录后水平上发挥着强大的生物作用。细胞信号通路转导外界刺激进而引发一系列生理和病理效应,决定着细胞的功能和生物学行为。MicroRNAs是非编码小RNA分子(包含22 - 24核苷酸),miRNAs通过与其目标mRNA分子3'端非编码区域互补匹配造成该mRNA分子的翻译受到抑制,从而控制靶基因表达,使其在细胞增殖、分化、抗凋亡等多种生物学进程中起到重要作用[3]。虽然MicroRNAs早在1989年发现,但直到2000年左右才被确认为对其互补的MRNA表达水平具有的生物调节和保存功能[4]。人类基因组内已鉴定1000余个miRNA,而这些miRNA调控约30%的蛋白质编码基因[25,26],同时对靶mRNA降解或翻译抑制等过程起作用。尽管自身不能表达成相关蛋白,但与相应的mRNA结合参与蛋白质翻译调控[5]。
3 与miRNAs分子相互作用的信号通路
3.1miR-21分子
在各类miRNA中,miR-21位于17号染色体,是最早被认为与胆脂瘤发病机制有关的miRNA。MiR-21已被证实在多种人类肿瘤和癌症细胞系中异常表达,这些肿瘤或癌包括胶质母细胞瘤、头颈部癌、卵巢癌、B细胞淋巴瘤、肝细胞癌、宫颈癌和肺癌等[6]。目前,张力蛋白同族体(PTEN)、程序化细胞死亡4(PDCD4)、BTG2等是miR-21的目标基因已被确定,在肿瘤发病中有着重要的作用[7]。miRNA通过抑制目标基因的表达来显示其生物学作用,因此,miR-21对目标基因的作用是在肿瘤生长中表现为抑制效应。2009年,Friedland[8]等人第一次报道了miRNAs在成人胆脂瘤生长调节和扩散中具有潜在作用,发现与正常的外耳道皮肤相比胆脂瘤中的miR-21水平增加,但磷酸酶及PTEN和PDCD4的水平降低。
3.1.1MiR-21分子与PTEN和PDCD4
PTEN和PDCD4的作用被认为是通过细胞凋亡、增殖、入侵和迁移等途径有效抑制肿瘤。Friedland[8]等人推测miR-21的负转录调控,可能导致PTEN和PDCD4的抑制,从而引起角化细胞增殖、迁移、增长。随后的一些研究发现,PTEN基因在胆脂瘤组织和正常皮肤组织上表达具有差异性,这种差异在胆脂瘤的发生、发展中进一步被证明可能有不可缺少的作用。Liu D,Ma X[9]等人利用免疫组化方法对40例胆脂瘤标本和15例正常皮肤组织进行了PTEN基因水平及基因位点的检测,并用蛋白质印迹方法对20例胆脂瘤组织和10例正常皮肤组织进行了其蛋白表达水平的检测。结果发现,胆脂瘤组织中PTEN水平远低于正常皮肤组织(P<0.01),而蛋白质印迹方法比较胆脂瘤和正常皮肤组织中该基因表达水平,也显示胆脂瘤中PTEN表达远低于正常皮肤组织,验证了PTEN基因的异常表达,可能与胆脂瘤的抗凋亡和增殖密切相关。同样Yune TY[10]等人通过免疫组化及蛋白印迹法对胆脂瘤上皮和正常皮肤组织PTEN表达水平进行了比较,发现胆脂瘤中PTEN的表达明显低于正常皮肤(P<0.05),而且胆脂瘤上皮细胞核中观察到PTEN的弱免疫反应性,但在正常皮肤细胞核中检测到了PTEN的强免疫反应性。Chen[11]等人在另一个miRNAs胆脂瘤的发病机制研究中发现,与正常的皮肤相比,在胆脂瘤组织中miR-21水平越高,PTEN和PDCD4蛋白水平越低,尤其在儿童患者中更明显,且角化细胞增殖水平儿童患者更高。进一步比较了胆脂瘤和正常组织细胞的miRNA-let-7基因水平及其靶蛋白AT-hook 2(HMGA2)的表达水平(HMGA2是一种公认的致癌基因),通过与正常外耳道皮肤组织比较后发现胆脂瘤上皮中miRNA-let-7a的过表达引起HMGA2的下调,由此认为miRNA-let-7a可能抑制HMGA2的表达,从而影响胆脂瘤细胞增殖和角化细胞凋亡。细胞因子诱导的miR-21表达通过信号通路影响细胞的存活,miR-21刺激效应细胞增殖作用和miRNA-let-7a对效应细胞抗增殖效果的动态平衡可能对胆脂瘤侵犯性与胆脂瘤非肿瘤性生物学行为有关。
3.1.2miR-21分子与信号传导之和转录激活自-3 (STAT3)
STAT3最初认为是急性反应基因表达的调控因子。众多实验证据显示STAT3参与多种肿瘤形成和发展。NF-κB转录因子家族通过κB片段结合到靶基因序列来调控基因表达。研究表明STAT3及NF-κB信号通路在miR-21表达中起一定的作用。细菌脂多糖(LPS)识别Toll样受体并将LPS的刺激信号向细胞内传递,并上调miR-21表达。Toll样受体在上调miR-21表达中的作用间接表明了这种受体与miRNA相互作用,同时是胆脂瘤组织中miRNA发挥功能的一个必要的途径[12]。Hirai[13]等人通过免疫组化法对胆脂瘤组织和正常皮肤组织Toll样受体2,4表达进行分析,发现与对照组相比胆脂瘤组织中Toll样受体2和4显著上调,这些结果表明,Toll样受体可能在人慢性中耳炎和胆脂瘤中起主要作用。Toll样受体与miRNA的相互作用也是一种胆脂瘤致病过程中的重要环节。另外,STAT3在干扰素(IFN)诱导的miR-21表达中也起重要的作用,STAT3在miR-21启动子结合位点的染色质免疫沉淀反应(芯片)分析显示IFN诱导STAT3结合到最远端的结合位点,这与IL-6诱导STAT3结合的结合位点相同。综上所述,IFN诱导的miR-21表达依赖于STAT3,表明STAT3是在miR-21表达中是不可缺少的因子[16],而且一些免疫组织化学研究报告显示IFN等受体异常表达在胆脂瘤的生长中具有促进作用[17]。IFN激活其受体并引发STAT3及NFκB介导的miR-21表达增加并引起在靶细胞中的增殖、扩散等效应。
3.1.3MiR-21分子与IL-6炎症因子
IL-6炎症因子与miR -21在胆脂瘤上皮的表达过程中起到相互影响的生物学作用。IL-6炎症因子、细菌脂多糖(LPS)识别Toll样受体并将LPS的刺激信号向细胞内传递,这两种途径刺激STAT3及NF-κB信号通路,最终影响miR- 21的表达。Liu[14]等人利用免疫组织化学法对25例胆脂瘤病人胆脂瘤标本和15例正常外耳道皮肤标本进行IL-6,STAT3表达水平检测,发现与对照组比较胆脂瘤上皮细胞中显著表达(P<0.05)。由此推断,这种高表达水平在胆脂瘤组织快速增长中起到一定作用。Kuczkowski[15]等人对胆脂瘤组织IL-6蛋白的免疫印迹分析(Western blot analysis)显示与正常皮肤组织比较,胆脂瘤组织中IL-6蛋白高表达,尤其在伴有骨质破坏的标本中更显著。
3.1.4MiR-21分子与NF-κB
NF-κB作为miRNA表达中的重要因子,在一些研究中已经发现其在病变组织与正常组织间的差异性表达。核周区域聚集的NF-κB蛋白提示抑制凋亡的机制失活,角化细胞死亡,角蛋白堆积[27]。例如,对中耳手术中获得的10例胆脂瘤和6例正常外部道的皮肤组织,通过电泳活性变化分析(EMSA)及逆转录聚合酶链反应(RT - PCR)方法分析了两种组织中NF--κB DNA结合活性和IL - 6mRNA表达水平及两者的关系。研究结果显示,胆脂瘤组织中的NF-κB DNA结合活性(15.9 +/- 8.2)%)高于正常皮肤组织(1.36 +/- 0.94)%,t = 3.502,P<0.05),并且IL-6mRNA的表达水平也远高于正常皮肤组织(t = 2.166,P<0.05),而且两者之间存在有显著的正相关(r = 0.752,P<0.05)[18]。
3.1.5miR-21分子与其他因子
miR-21的表达还受细胞内另外一些重要物质的影响,如IGFBP3和F-box蛋白家族等。miR-21KD系多形性成胶质母细胞瘤(GBM)和对照组RNA标本肿瘤相关性基因的表达分析显示一些miR-21KD系胶质母细胞瘤细胞中IGFBP3表达上调,表明它可能是miR-21靶基因[19]。FBXO11属于F-BOX蛋白家族,是一种肿瘤抑制基因。miR-21作用于不同肿瘤细胞,伴随FBOX11表达水平的升高,而下降[20]。IGFBP3和F-BOX被确定为新的MiR-21的靶基因,而且发现在肿瘤活检标本的相关实验室检测显示,F-BOX和IGFBP3表达与miR-21的表达呈负相关。表明miR-21通过抑制肿瘤抑制基因的表达而促进了肿瘤的发生发展[21]。IGFBP3和FBX011与对应的IGF-IR及BCL6等受miR-21影响,而miR-21作为胆脂瘤发生、发展分子生物学机制中的重要环节之一,通过上述各种调控,从而影响到一系列生命活动的发生(下图)。
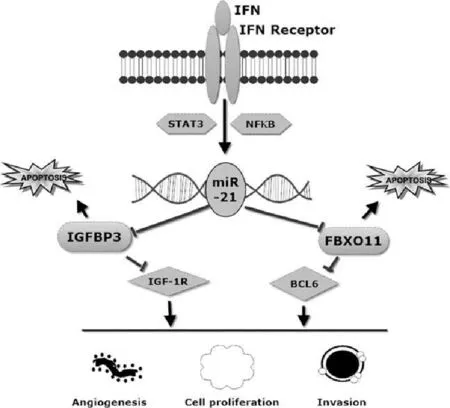
3.2miR-802
除了miR-21与胆脂瘤发生有关外,目前研究发现,miR-802分子也与胆脂瘤的发生有关。在染色质免疫沉淀反应显示:与临近正常皮肤组织相比,胆脂瘤组织中NF-κB是显著激活的。在分子水平上,NFκB的激活引起miR-802表达水平的增加,而miR-802直接影响PTEN 30-UTR。miR - 802过表达促进角化细胞增殖和细胞周期的变化,并直接抑制PTEN的表达。因此这种信号通路在胆脂瘤发病过程中也起到一定的作用[22],但目前研究比较少。
4 展望
最新的胆脂瘤分子生物学研究扩展了对胆脂瘤发病机制的认识。基因表达的研究已经显示出许多生长调控因子和信号分子以及相应蛋白质的表达在胆脂瘤组织细胞生长,增殖,抗凋亡和骨质破坏等方面的相互作用。miRNA通过结合靶mRNA的互补序列,调控经典蛋白表达,参与细胞基本的生物过程,如细胞增殖、分化、凋亡、应激反应等。其中miR-21在胆脂瘤组织细胞中的作用是通过一些重要因子的参与来表达,miR-21不仅在胆脂瘤组织中起作用。而且在其他肿瘤致病过程中也有着不可忽视的生物学作用,比如Armstrong DA[23]等,对膀胱癌组织标本进行miRNA检测,显示miR-21存在过度表达。而Zhang C[24]等人研究发现miR-21在乳腺癌组织中也存在过度表达情况,并且和癌基因一样抑制STAT3,对乳腺癌的进一步增殖可能起到了作用。miRNA调控在细胞生物信息中有着不可替代的重要作用,同时开辟了一个崭新的领域研究胆脂瘤的发病机制。尽管miRNA的发现在疾病发生、发展中的作用有大量的研究基础支持,但对于其在细胞生理和病理生理过程中作用的认识仅仅是一个新的起点,今后仍需要进行大量深入的研究。miRNA将会成为胆脂瘤发病机制中分子生物学研究的重点,同时对疾病的认识、疾病的诊疗、预防等方面均有重要的作用。
参考文献
1Louw L,Acquired cholesteatoma pathogenesis:stepwise explanations,J Laryngol Otol.2010,124(6):587-593.
2Juhn SK,Jung MK,Hoffman MD,Drew BR,Preciado DA,Sausen NJ,Jung TT,Kim BH,Park SY,Lin J,Ondrey FG,Mains DR,Huang T,The role of inflammatory mediators in the pathogenesis of otitis media and sequelae,Clin Exp Otorhino-laryngol.2008,1(3):117-138.
3Rudnicki A,Avraham KB.microRNAs:the art of silencing in the ear.EMBO Mol Med .2012,4(9):849-859.
4Lagos-Quintana M,Rauhut R,Lendeckel W,Tuschl T.Identification of novel genes coding for small expressed RNAs.Science.2001,294:(5543)853-858.
5Ivey KN,Srivastava D.microRNAs as Developmental Regulators.Cold Spring Harb Perspect Biol.2015,7(7):144-145.
6Hatley ME,Patrick DM,Garcia MR,Richardson JA,Bassel-Duby R,van Rooij E,Olson EN.Modulation of K-Ras-dependent lung tumorigenesis by MicroRNA-21.Cancer Cell.2010,18(3):282-293.
7Buscaglia LE,Li Y.Apoptosis and the target genes of microRNA-21.Chin J Cancer .2011,30(6):371-380.
8Friedland DR,Eernisse R,Erbe C,Gupta N,Cioffi JA.Cholesteatomagrowth and proliferation:posttranscriptional regulation by microRNA-21.Otol Neurotol .2009,30(7):998-1005.
9Liu D,Ma X.[Expression and significance of PTEN,P-ERK and P-AKT in the middle ear cholesteatoma].Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi.2014,28(4):238-245
10 Yune TY,Byun JY.Expression of PTEN and phosphorylated Akt in human cholesteatoma epithelium.Acta Otolaryngol.2009,129(5):501-506
11 Chen X,Qin Z.Post-transcriptional regulation by microrna-21 and let-7amicroRNA in paediatric cholesteatoma.J Int Med Res.2011,39(6):2110-2118.
12 Sheedy FJ,Palsson-McDermott E,Hennessy EJ,Martin C,O'Leary JJ,Ruan Q,Johnson DS,Chen Y,O'Neill LA.Negative regulation of TLR4 via targeting of the proinflammatory tumor suppressor PDCD4 by the microRNA miR-21.Nat Immunol.2010,11(2):141-147.
13 Hirai H,Kariya S,Okano M,Fukushima K,Kataoka Y,Maeda Y,Nishizaki K.Expression of toll-like receptors in chronic otitis media and cholesteatoma.Int J Pediatr Otorhinolaryngol.2013,77(5):674-676
14 Liu W,Xie S,Chen X,Rao X,Ren H,Hu B,Yin T,Xiang Y,Ren J.Activation of the IL-6/JAK/STAT3 signaling pathway in human middle ear cholesteatoma epithelium.Int J Clin Exp Pathol.2014,7(2):709-715.
15 Kuczkowski J,Sakowicz-Burkiewicz M,Iµycka-µwieszewska E,Mikaszewski B,Pawełczyk T.Expression of tumor necrosis factor-α,interleukin-1α,interleukin-6and interleukin-10 in chronic otitis media with bone osteolysis.ORL J Otorhinolaryngol Relat .2011,73 (2):93-99
16 Yang CH,Yue J,Pfeffer SR,Handorf CR,Pfeffer LM.MicroRNA miR-21 regulates the metastatic behavior of B16 melanoma cells.J Biol Chem.2011,286(45):39172-39178
17 Olszewska E,Wagner M,Bernal-Sprekelsen M,Ebmeyer J,Dazert S,Hildmann H,Sudhoff H,Etiopathogenesis of cholesteatoma,Eur Arch Otorhinolaryngol.2004,261(1):6-24.
18 Xu Y,Tao ZZ,Hua QQ,Wang XC,Xiao BK,Chen SM.[Activation of nuclear factor-kappaB and aberrant gene expression of interleukin 6 in middle ear cholesteatoma].Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi.2009,44(3):192-196.
19 Yang CH,Yue J,Pfeffer SR,Fan M,Paulus E,Hosni-Ahmed A,Sims M,Qayyum S,Davidoff AM,Handorf CR,Pfeffer LM.MicroRNA-21 promotes glioblastoma tumorigenesis by down-regulating insulin-like growth factor-binding protein-3(IGFBP3).J Biol Chem.2014,289(36):25079-25087.
20 Yang CH,Pfeffer SR,Sims M,Yue J,Wang Y,Linga VG,Paulus E,Davidoff AM,Pfeffer LM.The oncogenic microRNA-21 inhibits the tumor suppressive activity of FBXO11 to promote tumorigenesis.J Biol Chem.2015,290(10):6037-6046.
21 Pfeffer SR,Yang CH,Pfeffer LM.The Role of miR-21 in Cancer.Drug Dev Res.2015,76(6):270-277.
22 Li N,Qin ZB.Inflammation-induced miR-802 promotes cell proliferation in cholesteatoma.Biotechnol Lett.2014,36(9):1753-1759.
23 Armstrong DA,Green BB,Seigne JD,Schned AR,Marsit CJ.MicroRNA molecular profiling from matched tumor and bio-fluids in bladder cancer.Mol Cancer.2015,14(1):194-195.
24 Zhang C,Liu K,Li T,Fang J,Ding Y,Sun L,Tu T,Jiang X,Du S,Hu J,Zhu W,Chen H,Sun X.miR-21:A gene of dual regulation in breast cancer.Int J Oncol,2016.48(1):161-172
25 Griffiths-Jones S.miRBase:microRNA sequences and annotation .Curr Protoc Bioinformatics.2010,12(12):9-10.
26 Griffiths-Jones S,Grocock R J,van Dongen S,Bateman A,Enright A J.miRBase:microRNA sequences,targets and gene nomenclature.Nucleic Acids Res.2006,34(1):140-144.
27廖军,林昶.中耳胆脂瘤的可能发病机制[J].中华耳科学志,2015,13 (2):362-365.Liao Jun Lin Chang.The possibility of middle ear cholesteatoma pathogenesis[J].Chinese Journal of Otology 2015,13(2):362-365.
Research progress of MicroRNAin the pathogenesis of cholesteatoma
Baheti jiang.tuokejigeteAyheng qukuerhan
Department of otolaryngology,The First Affiliated Hospital of Xinjiang Medical University,xin jiang 830054
Corresponding author:Ayheng qukuerhanEmail:ayhen979@sina.com
【Abstract】MicroRNA which has variety of biological functions in cells is a small RNA molecule in the organism,participates in transcriptional regulation,energy metabolism,growth,reproduction and so on.MicroRNAs are important molecules in cell gene regulation in body,and exercise a variety of biological function.In recent years,a large number of molecular biology researches in pathogenesis of cholesteatoma of middle ear,have made a new progress of which miRNAs study and opened a new field.MiR-21 may be related with the occurrence and development of cholesteatoma of middle ear,and has played a potential role in cholesteatoma of middle ear in growing and diffusing.This paper reviewed the researching progress of the miR-21 and cellular signaling pathways and their interaction in occurrence mechanism and development of cholesteatoma of middle ear .
【Keyword】Cholesteatoma of middle ear;MicroRNAs;Pathogenesis
【中图分类号】R764
【文献标识码】A
【文章编号】1672-2922(2016)02-304-4
DOI:10.3969/j.issn.1672-2922.2016.02.036
基金项目:新疆维吾尔自治区自然科学基金项目(2013211A098)
作者简介:巴合提江·托克吉格特,研究生,耳鼻咽喉头颈部肿瘤外科治疗
通讯作者:阿依恒·曲库尔汗,Email:ayhen979@sina.com
收稿日期:(2015-10-09审核人:翟所强)

