氮的低价化合物电极电位高于高价化合物成因分析
张金彩
摘 要:任何现象的存在都有其存在的合理性,并且主要由其自身原因造成。氮的低价化合物电极电位高于其高价化合物电极电位,其形成内因是分子结构本身,形成外因则是酸性与氢键。
关键词:氮化合物;电极电位;分子结构;氢键
一、引言
通过对氮的化合物电极电位进行比对,HNO2的φ°=1.27(V)而NO3-的φ°=0.94(V),发现氮的低价化合物电极电位高于其高价化合物电极电位,这是什么原因呢?
二、氮的化合物分子结构决定了其低价电极电位高于其高价
1.氮的不同价态化合物分子结构
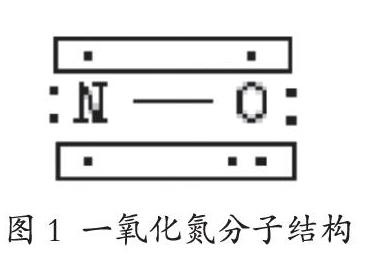
(1)一氧化氮
一氧化氮的化学式为NO,其中氮原子是sp杂化,氮氧三键分别为一个σ键、一个正常π键和一个三电子π23键(见图1)。
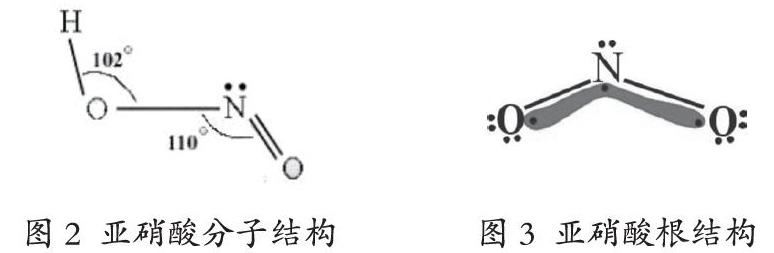
(2)亚硝酸
亚硝酸的化学式为HNO2,其中H-O-N的键角为102°,O-N-O的键角为110°。HNO2分子中的氮原子是sp2杂化,分子呈V型结构,含两个N-Oσ键和一个N-Oπ键。H-O-N中的成键氧原子是sp3杂化,H-O-N的键角为102°小于109.5°的正常值,这种键角的变小缘于氧原子上的两对孤电子对的挤压(见图2和图3)。
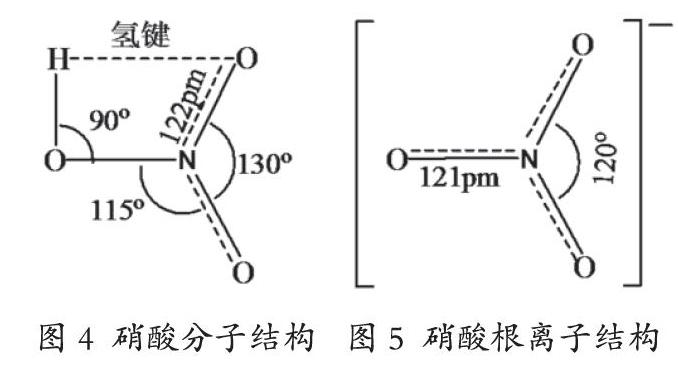
(3)硝酸
硝酸的化学式为HNO3,其为平面共价分子,中心氮原子是sp2杂化,未参与杂化的一个p轨道与两个端氧形成四中心六电子π46键(见图4)。硝酸根离子呈正三角形结构,氮原子在中心,三个氧原子位于正三角形的三个顶点,氮原子和氧原子都是sp2杂化(见图5),图中虚线代表大π键。
2.氮的化合物分子结构决定了其低价电极电位高于其高价的原因分析
(1)一氧化氮
NO分子中的π23键,相当于有一个电子自由基N·的存在,正是由于NO带有自由基,使其化学性质非常活泼,并在酸性介质中具有较高的电极电位。对于NO来说,这个三电子π23键的价键结构是不稳定且不对称π键形式。对于氮原子和氧原子,这样的结构也具有不稳定性,容易打开,对外获得(或失去)电子,使氮原子形成稳定的8电子结构。氧原子撇开氮原子的一个电子,就能达到8电子的稳定结构,所以在这里氧原子属于被动地向氮原子提供电子,一旦氧原子的电子被氮原子吸引,氧原子与氮原子之间就会形成对电子的相互争夺,在这样不断进行的相互争夺与相互妥协中就表现出了氮原子的氧化性。再加上氮原子对形成单质N2的愿望强烈,从而形成N2O(有形成氮分子的初步趋势)。NO表现出较强的氧化性,电极电位相对较高。当然这样的氮原子结构,在空气中也容易失去电子,被氧化形成NO2。
(2)亚硝酸
HNO2不稳定,仅存在于稀的水溶液中,浓缩其稀溶液时,HNO2会同时发生岐化和分解,生成岐化产物HNO3和NO,以及分解产物N2O3,同时N2O3又迅速分解为NO和NO2。HNO2的分解反应表明HNO3比HNO2稳定。HNO2的不稳定与其结构密切有关。首先是氮原子的最外层电子数为5,距达到8电子的稳定结构只差3个电子,具有明显的非金属特性,氮原子一旦失去电子,得回来的倾向是明显的。HNO2分子呈V型结构,由于氮原子上孤电子对的存在,对O-N-O化学键起到挤压作用,使得O-N-O的键角为110°小于120°的正常值,这样氮原子处在V字的顶端,没有被其他原子均匀地包围,其正电性处在一个突出的尖端点位上。正是由于氮原子与其周围其他原子在结构上站位的不对称,造成氮原子对外放电来得容易。氮原子的外侧没有其他原子均匀与其相连接,以屏蔽氮原子的正电性,相反与其相连的氧原子是拉电子基团,更造成氮原子的正电性表现明显,放电容易,使得HNO2不稳定。另外由于氮原子的凸显位置,容易相互碰撞和接触外界,发生氧化还原反应,使HNO2表现出较强氧化性φ°=1.27(V)的特征。
(3)硝酸
HNO3比HNO2稳定,表现在可以有纯态HNO3的存在,并能测得其相应的物理数据,如密度1.5027g.cm-3、沸点356K等。尽管HNO3也容易分解,但是需要在见光或受热时才能进行。HNO3的强氧化性与其分子结构有关。HNO3分子中心氮原子是sp2杂化,与氢原子相连的氧原子是sp3杂化,另外两个氧原子与氮原子除形成σ键外,还形成了三中心四电子π34键。而硝酸根形成的是平面结构,中心为氮原子,周围是相对带负电荷的三个氧原子,这三个氧原子对氮原子的正电性具有屏蔽的作用。HNO3溶于水形成NO3-,NO3-中+5价态氮原子的强吸电子能力,牢牢地把三个氧原子的电子吸引到自己的周围,形成多中心多电子的π46键,三个氧原子都来承担氮原子的正电性,形成稳定的基团,同时也把氮原子的正电氧化能力屏蔽了相当部分,从而形成了HNO3到HNO2的标准电极电位φ°=0.94(V),比HNO2到H2O的φ°=1.27(V)要小的结果。
三、酸性决定了其低价的电极电位高于其高价
1.一氧化氮
NO常态下是气体,难溶于水。由于氮和氧二者的电负性相差不大,它们对电子的吸引能力相近,氧原子上的负电性不明显,与水分子不容易形成氢键,分子间的作用力小,所以难溶于水。因此NO的氧化性在水中仍保持原有的活性,而在酸性条件下,在H+的帮助下,其氧化能力得到加强,电极电位的数值较高。
2.亚硝酸
HNO2是弱酸,在水中以分子的形式存在。这说明HNO2的自身氧化能力在水中并没有被改变。当H+进入溶液时,会进一步加强氧原子对氮原子的拉电子效应,使得氮原子的正电性进一步加强,这是正电加强效应的结果,也是造成HNO2到N2O的标准电极电位φ°=1.27(V)较高的原因。
3.硝酸
HNO3是强酸,在水中以离子的形式存在。NO3-是一个带负电的基团,其对显正电性的氮原子有明显的安抚作用,从而削弱了氮原子的正电性,降低了它的氧化能力。由于NO3-结构的高度对称性以及负电荷是在整个基团内通过大π键所共有,使得H+只能以离子形式存在于其周围,而不能进入其内发挥作用,即只能存在于基团的外部。H+对电极电位的正电加强作用弱化,使得HNO3到HNO2的标准电极电位φ°=0.94(V)小于HNO2的电极电位φ°=1.27(V)。
四、氢键与分子间的作用决定了其低价的电极电位高于其高价
1.亚硝酸
HNO2是弱酸,其分子中羟基(—OH)的极性小。大多数HNO2以分子形式存在于溶液中,这同样会增加其氧化能力,使其标准电极电位较高。另外,HNO2分子中一个氧原子形成的氢键,使得与氮原子相连的另一个氧原子的电子被吸引,加大了氮原子的氧化力,增加了电极电位数值。
2.硝酸
HNO3分子自身含有氢键,使得本身的偶极在分子内部被进一步“削弱”,分子间的相互作用力小,这一点可以从HNO3的挥发性与沸点低上得到证实。由于分子内的氢键,使得分子间的范德华力削弱,造成溶液中H+的正电加强效应变弱。由于HNO3分子结构的对称性,特别是HNO3溶于水后形成NO3-,其π46键加强了氮原子对电子的束缚能力,造成NO3-正负电荷中心的高度重合,不容易被外界的离子干扰与极化,从而削弱了NO3-的氧化性,使得HNO3的电极电位相对较低。
氮的低价化合物电极电位高于其高价化合物电极电位其形成内因是其分子结构,形成外因则是酸性与氢键。

