红芪多糖对D-半乳糖致衰老小鼠抗免疫衰老作用的研究*
柳春玲,寇 宁,张高林,李磊强,庞大勇,程卫东
(1.兰州市中医医院,甘肃 兰州 730050; 2.兰州大学基础医学院,甘肃 兰州 730000)
·实验研究·
红芪多糖对D-半乳糖致衰老小鼠抗免疫衰老作用的研究*
柳春玲1,寇宁2,张高林2,李磊强2,庞大勇2,程卫东2
(1.兰州市中医医院,甘肃 兰州 730050; 2.兰州大学基础医学院,甘肃 兰州 730000)
摘要目的:研究红芪多糖(hedysamn polysaccharide, HPS)的抗免疫衰老作用。方法:使用清洁级昆明种小鼠,采取D-半乳糖腹腔注射的方法构建亚急性衰老小鼠模型;分为正常对照组,模型对照组,维生素E组和HPS高、中、低剂量组。除正常对照组外,其余各组小鼠连续腹腔注射D-半乳糖(120 μg/g);正常对照组灌胃生理盐水,维生素E组灌胃维生素E溶液(50 μg/g),HPS高、中、低剂量组依次灌胃200 ,100,50 μg/g HPS水溶液。观察小鼠胸腺和脾脏指数、T淋巴细胞增殖能力、T淋巴细胞亚群的水平,测定小鼠血清IL-2、IFN-γ、IL-4、TNF-α含量。结果:模型对照组小鼠脏器指数、T淋巴细胞增殖能力、T淋巴细胞亚群测定、血清IL-2、IFN-γ、IL-4、TNF-α与正常对照组对比,差别有统计学意义(P<0.01)。与模型对照组对比,HPS高、中、低剂量组的胸腺指数和脾脏指数、T淋巴细胞的增殖能力,CD3+T、CD3+CD4+T、CD3+CD8+T细胞百分比,CD3+CD28+T细胞均升高;HPS高、中、低剂量组小鼠血清细胞因子IL-2、IFN-γ、IL-4水平升高,TNF-α水平降低。HPS高、中、低剂量组间诸指标对比,高、中剂量作用明显。结论: HPS具有一定的抗免疫衰老作用,可通过调节T淋巴细胞作用来延缓衰老,能有效改善亚急性衰老小鼠的细胞免疫和体液免疫功能。
关键词红芪多糖;D-半乳糖;衰老小鼠;抗免疫衰老
伴随着人类平均寿命的延长,人口老龄化问题日益成为深刻的社会和医学问题,与衰老相关的疾病呈逐年上升趋势,寻找能够延缓衰老、减少老年疾病发生的药物和方法,具有非常重要的社会价值。红芪为豆科植物多序岩黄芪(HedysarumpolybotrysHand.-Mazz.)的干燥根,具有补气升阳、固表止汗、利水消肿等功效[1]。现代药理研究表明:红芪具有抗自由基、免疫调节、抗肿瘤等作用[2]。有关衰老机制的研究发现:衰老在免疫系统最早出现[3]。本实验通过建立D-半乳糖致衰老小鼠模型[4],采用常规水提醇沉法[5]制备红芪多糖(hedysamn polysaccharide, HPS),进一步研究红芪抗免疫衰老的作用机制,以期为红芪在延缓衰老方面的推广使用提供依据。
1材料与方法
1.1动物
清洁级昆明种小鼠60只,体质量18~22g,雌雄各半,由兰州大学实验动物中心提供,许可证号:SKXK(甘)201106-0014。
1.2药品、试剂与仪器
红芪购自甘肃武都。胎牛灭活血清,杭州四季青生物工程材料有限公司产品,批号0908162;EZ-SepTMMOUSEIX淋巴细胞分离液,深圳达科为生物技术有限公司产品,批号DKW33_R0100;MTT(批号20140102418)、ConA(批号201405162161),均为美国Sigma公司产品;SDS,天津化学试剂一厂产品,批号2014021615;RPMI 1640培养基,恒星生物工程有限公司产品,批号NAC1352;小鼠IL-2(ELISA)检测试剂盒(批号E2020-1506-1)、小鼠IL-4(ELISA)检测试剂盒(批号E2020-1504-2)、小鼠IFN-γ(ELISA)检测试剂盒(批号20140801A)和小鼠TNF-α(ELISA)检测试剂盒(批号E2720-1507-1),均为深圳达科为生物技术有限公司产品;FITC-抗小鼠CD 3单克隆抗体(批号B172038)、PE/CY5-抗小鼠CD 4单克隆抗体(批号B17682014)、PerCP-抗小鼠CD 8单克隆抗体(批号B15852815)和PE-抗小鼠CD28单克隆抗体(批号B163165),均为Biolegend公司产品;维生素E软胶囊,青岛双鲸药业有限公司产品,批号20140515;D-半乳糖,上海中泰试剂有限公司产品,批号Z00140730。LxJ-IIB飞鸽牌低速大容量多管离心机,上海安亭科学仪器厂产品;Heto-lyo-lab 3000冷冻干燥机,丹麦heto公司产品;SHE-D循环水式真空泵,河南巩义市予华仪器有限责任公司产品;A06061422超净台,苏州安泰空气技术有限公司产品;CO2培养箱,日本SANYO公司产品;TDL-40B型、TGL-16G型离心机,上海安亭科学仪器厂产品;全自动酶标仪,美国BIO-RAD公司产品;流式细胞仪,美国贝克曼COULTER公司产品。
1.3红芪多糖的提取
精确称取红芪干燥根1 000 g,粉碎,加950 mL/L乙醇,回流脱脂2 h;药渣干燥后加水煎煮3次(煎煮时间分别为2 h、1.5 h、1 h),合并煎煮液并浓缩;冷却后加入950 mL/L 乙醇,充分混匀,静置,离心得到沉淀。将沉淀溶于蒸馏水中,上清液用Sevage法去除蛋白质,剧烈振荡30 min后静置12 h,离心,经冷冻干燥后得到HPS,4 ℃冰箱保存备用。
1.4动物分组、模型的建立与给药
将60只小鼠适应性饲养1周后按照随机数字表法分为正常对照组,模型对照组,维生素E组和 HPS高、中、低剂量组6组,每组10只,雌雄各半。
各组小鼠灌胃药物剂量均按照体表面积[6]进行换算,得到小鼠所需剂量。成人红芪每日用量9~30 g,根据实验动物药物剂量和红芪多糖提取率3.24%换算,HPS高、中、低剂量组等效剂量(生药量)依次为6,3,1.5 g/(kg·d) 。正常对照组以 9 g/L 生理盐水灌胃 10 μL/g,不行腹腔注射;模型对照组腹腔注射D-半乳糖120 μg/g[7],灌胃9 g/L生理盐水10 μL/g;维生素E组腹腔注射D-半乳糖120 μg/g,灌胃维生素E溶液50 μg/g; HPS高、中、低3个剂量组腹腔注射D-半乳糖120 μg/g,并依次灌胃红芪多糖水溶液200,100,50 μg/g。连续42 d。
1.5检测指标
1.5.1胸腺指数和脾脏指数
末次给药24 h后,称小鼠体质量,经眼眶取血后处死小鼠,取胸腺、脾脏。精确称量胸腺、脾脏质量,计算胸腺指数和脾脏指数。计算公式如下:
脏器指数=脏器质量(mg)/体质量(g)
1.5.2T淋巴细胞增殖能力和T淋巴细胞亚群
脾淋巴悬液的制备:将小鼠处死后置于750 mL/L的乙醇中浸泡,超净台下在无菌环境下取脾脏;用200目尼龙膜平铺于装有EZ-SepTMMOUSEIX淋巴细胞分离液的无菌培养皿上,将摘取的脾脏放置于尼龙膜上,使用适中力度进行研磨,分离并提取淋巴细胞;将含有脾细胞的淋巴细胞分离液移至离心管,加入200 μL 1640完全培养液,离心后吸出淋巴细胞,再次加入10 mL 1640培养液经吹打混匀,再次离心弃去上清,加入1640完全培养液,吹打混匀之后计数,调整淋巴细胞悬液浓度为1×107/mL为后续实验准备。
T淋巴细胞增殖能力测定:将制备好的淋巴细胞悬液调整为1×106/mL,加入96孔培养板中;每个样本设8个复孔,其中4孔加ConA(质量分数为5 mg/L),另外4孔加含胎牛血清的完全RPMI-1640培养液做阴性对照。每孔加淋巴细胞悬液100 μL,在培养箱内37 ℃培养68 h后,取出并加入MTT(最终质量分数为5 g/L)10 μL/孔,继续培养4 h。培养结束后,每孔加入100 μL 100 g/L SDS,吹打混匀,37 ℃放置过夜,于酶标仪570 nm处测定OD值。按照下列公式计算刺激指数,以代表小鼠脾脏T淋巴细胞的增殖程度。刺激指数(SI)=实验孔OD值/对照孔OD值
淋巴细胞亚群的测定: 取制备好的淋巴细胞悬液(1×107/mL),在EP管中加100 μL,共分装2组,每组6管,共12管。第一组每管加FITC-抗小鼠CD3 1 μL、PE/CY5-抗小鼠CD4(用PBS 稀释10倍)3 μL、PE-抗小鼠CD28 2 μL,第二组每管加FITC-抗小鼠CD3 1μL、PerCP-抗小鼠CD8 1.25 μL、PE-抗小鼠CD28 2μL,混合均匀后4 ℃冰箱避光孵育30 min;加PBS洗涤2次,2 500 r/min离心5 min,弃上清,加500 μL PBS,吹打混匀;流式细胞仪检测CD3+T、CD3+CD4+T、CD3+CD8+T、CD3+CD28+T淋巴细胞水平。
1.5.3血清IL-2、IL-4、IFN-γ和TNF-α
将静脉血自然静置3 h,使血清充分析出,以1 500 r/min 离心10 min,收集血清。用生理盐水将各组血清样本稀释10倍后用酶联免疫吸附试验方法检测血清IL-2、IL-4、IFN-γ、TNF-α的含量。具体操作步骤严格按照说明书进行,在酶标仪450 nm波长测定OD值,根据标准品绘制标准曲线,以ng/L为单位,计算其含量。
1.6统计学方法

2结果
2.1各组小鼠胸腺指数和脾脏指数对比
模型对照组的胸腺指数和脾脏指数低于正常对照组,差别有统计学意义(P<0.01)。与模型对照组对比,HPS高、中剂量组和维生素E组的胸腺指数和脾脏指数提高,差别有统计学意义(P<0.05或P<0.01);低剂量组较之差别无统计学意义(P>0.05)。见表1。

表1 各组小鼠胸腺指数和脾脏指数对比 ±s
注:与正常对照组对比, **P<0.01;与模型对照组对比,#P<0.05,##P<0.01。
2.2各组小鼠T淋巴细胞增殖能力对比
与正常对照组对比,模型对照组脾淋巴细胞刺激指数下降, 差别有统计学意义(P<0.01)。与模型对照组对比,HPS高、中剂量组和维生素E组的刺激指数增高,差别均有统计学意义(P<0.01);低剂量组较之差别无统计学意义(P>0.05)。见表2。
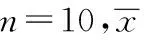
表2 各组小鼠T淋巴细胞增殖能力对比±s
注:与正常对照组对比,**P<0.01;与模型对照组对比,##P<0.01。
2.3各组小鼠T淋巴细胞亚群对比
2.3.1各组小鼠CD3+T、CD3+CD4+T、CD3+CD8+T对比
与正常对照组对比,模型对照组CD3+T、CD3+CD4+T、CD3+CD8+T淋巴细胞亚群百分比均减少,差别有统计学意义(P<0.01)。与模型对照组对比,HPS高、中、低剂量组和维生素E组CD3+T、CD3+CD4+T均升高,差别有统计学意义(P<0.05或P<0.01);与模型对照组对比,HPS高、中剂量组和维生素E组CD3+CD8+T细胞升高,差别有统计学意义(P<0.01)。与低剂量组对比,高剂量组CD3+T、CD3+CD4+T、CD3+CD8+T细胞均升高明显,差别有统计学意义(P<0.01);中剂量组CD3+T、CD3+CD4+T、CD3+CD8+T细胞均升高明显,差别有统计学意义(P<0.01)。与HPS中剂量组对比,高剂量组CD3+T、CD3+CD4+T细胞升高,差别有统计学意义(P<0.05)。见表3。
表3各组小鼠CD3+T、CD3+CD4+T、CD3+CD8+T对比


组 别剂量/(g·kg-1·d-1)CD3+T/%CD3+CD4+T/%CD3+CD8+T/%正常对照组—63.07±4.0740.98±5.2523.03±5.17模型对照组0.1231.54±2.33**21.40±4.65**11.54±2.98**维生素E组0.0546.02±2.46##36.45±5.67##21.26±4.85##HPS高剂量组0.250.53±3.06##△△*38.17±3.26##△△*22.78±4.64##△△HPS中剂量组0.145.33±4.42##△△33.70±4.84##△△20.36±4.79##△△HPS低剂量组0.0537.67±2.34#27.72±4.31##14.42±2.49
注:与正常对照组对比,*P<0.05,**P<0.01;与模型对照组对比,#P<0.05, ##P<0.01;与HPS低剂量组对比,△△P<0.01;与HPS中剂量组对比,*P<0.05。
2.3.2各组小鼠CD28分子表达对比
与正常对照组对比,模型对照组CD3+CD28-T细胞升高,CD3+CD28+T细胞降低,差别有统计学意义(P<0.01)。与模型对照组对比,HPS高剂量组CD3+CD28-T细胞升高, HPS高、中、低剂量组和维生素E组CD3+CD28+T淋巴细胞明显降低,差别均有统计学意义(P<0.01)。与低剂量组对比,HPS高、中剂量组CD3+CD28+T细胞升高,差别有统计学意义(P<0.01)。与HPS中剂量组对比,高剂量组CD3+CD28+T细胞升高,差别有统计学意义(P<0.05)。见表4。
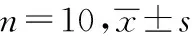
表4 各组小鼠CD28分子表达对比
注:与正常对照组对比,*P<0.05,**P<0.01;与模型对照组对比,#P<0.05,##P<0.01;与HPS低剂量组对比,△△P<0.01;与HPS中剂量组对比,*P<0.05。
2.4各组小鼠血清IL-2、IFN-γ、IL-4、TNF-α对比
与正常对照组对比,模型对照组血清IL-2、IFN-γ、IL-4降低,TNF-α升高,差别有统计学意义(P<0.01)。与模型对照组对比,HPS高、中、低剂量组和维生素E组血清IL-2水平升高,差别有统计学意义(P<0.05或P<0.01);HPS高、中剂量组和维生素E组血清IFN-γ、IL-4水平升高,差别有统计学意义(P<0.05或P<0.01); HPS高剂量组和维生素E组血清TNF-α水平降低,差别有统计学意义(P<0.01)。与HPS低剂量组对比,高剂量组血清IL-2、IFN-γ、IL-4升高、TNF-α降低,差别有统计学意义(P<0.05或P<0.01);中剂量组血清IFN-γ、IL-4水平升高,差别有统计学意义(P<0.05或P<0.01)。与HPS中剂量组对比,高剂量组血清IL-2升高,差别有统计学意义(P<0.01)。见表5。
表5各组小鼠血清IL-2、IFN-γ、IL-4、TNF-α对比

组 别剂量/(g·kg-1·d-1)IL-2IFN-γIL-4TNF-α正常对照组—24.35±3.5397.63±4.0419.28±4.8350.26±2.82模型对照组0.1210.35±2.67**77.21±2.23**13.08±2.28**58.36±3.61**维生素E组0.0520.96±4.01##90.58±2.43##17.99±2.15##53.46±2.36##HPS高剂量组0.221.79±2.75##△△**91.35±2.57##△△18.15±3.76##△△53.74±2.81##△HPS中剂量组0.117.65±3.05##91.61±4.36#△△17.76±2.23##△56.86±4.65HPS低剂量组0.0514.77±3.81#80.23±4.0114.33±0.9257.76±4.76
注:与正常对照组对比,*P<0.05,**P<0.01;与模型对照组对比,#P<0.05,##P<0.01;与HPS低剂量组对比,△P<0.05,△△P<0.01;与HPS中剂量组对比,**P<0.01。
3结果
红芪具有多种活性成分,包括红芪多糖、黄酮、皂苷、氨基酸等。在对红芪的药理作用研究中发现,红芪具有一定的抗癌活性,对心脑血管系统具有保护作用,还能提高体液免疫和细胞免疫能力,具有清除自由基和抗氧化作用等[8]。
本实验结果显示:模型对照组小鼠的脏器指数、T淋巴细胞增殖程度、T细胞亚群水平、血清IL-2、IFN-γ、IL-4、TNF-α均与正常对照组存在明显差异,表明亚急性衰老小鼠模型建立。HPS高、中、低剂量组均可提高小鼠胸腺指数和脾脏指数,对衰老动物模型免疫器官萎缩有一定的抑制作用,还可升高T淋巴细胞刺激指数,HPS对亚急性衰老小鼠的T淋巴细胞增殖能力有恢复作用,能够升高T淋巴细胞亚群的百分比, CD3+T、CD3+CD4+T、CD3+CD8+T、CD3+、CD28+T细胞升高作用明显,HPS具有一定的抗免疫衰老作用,可通过调节T淋巴细胞作用来延缓衰老。HPS高、中、低剂量组小鼠血清细胞因子IL-2、IFN-γ、IL-4、TNF-α水平均发生不同程度变化。因此,HPS能有效改善亚急性衰老小鼠模型的免疫功能,纠正机体细胞因子的免疫失衡状态。HPS 3个剂量组之间,高、中剂量组作用明显,说明HPS剂量的高低会影响其抗免疫衰老作用,在一定剂量能增强机体细胞免疫和体液免疫应答。
胸腺和脾脏是机体重要的免疫器官,测定脏器指数可粗略估计免疫功能的强弱,对判断是否衰老具有一定的参考价值。研究表明,免疫细胞的增殖及分化都会引起脾脏质量的增加。本实验结果显示,模型对照组小鼠的胸腺指数和脾脏指数明显低于正常对照组。胸腺和脾脏萎缩,反映出机体免疫功能减弱。与模型对照组对比,HPS高、中、低剂量组和维生素E组小鼠的胸腺和脾脏指数不同程度提高,说明红芪多糖对亚急性衰老小鼠的胸腺及脾脏萎缩起到了抑制作用,对老龄小鼠的免疫器官有一定的保护作用,而且在HPS高、中剂量时的保护作用更加显著。
T淋巴细胞体外增殖反应[9]是检测细胞免疫功能的常用方法之一,通过观察实验药物对T淋巴细胞增殖反应的影响来判断其对细胞免疫功能的影响,有较高灵敏度且结果可靠[10]。实验数据表明,模型对照组小鼠的T淋巴细胞增殖反应中刺激指数明显降低,机体对ConA的增殖反应能力下降,是衰老的免疫学特征之一。HPS高、中、低剂量组和维生素E组均不同程度升高了小鼠的T淋巴细胞增殖反应的刺激指数,其中HPS高、中剂量组升高作用明显,说明红芪多糖对亚急性衰老小鼠的T淋巴细胞增殖能力有恢复作用,而且在HPS高、中剂量时的作用较明显。
CD3是T细胞重要的表面抗原,通常以CD3+T细胞亚群代表T淋巴细胞总数。CD3+T细胞水平下降表示成熟T淋巴细胞减少,细胞免疫功能下降。外周血成熟T淋巴细胞又可以分为CD4+T细胞和CD8+T细胞。辅助性T细胞(Th细胞)通常表达CD4,而细胞毒性T细胞(Tc细胞)表达CD8。Th细胞又分为Th1细胞和Th2细胞亚群,并产生不同的细胞因子。通常Th1细胞和Th2细胞的百分比、INF-γ、IL-4水平应维持平衡。CD4+T和CD8+T在体内免疫应答时既相互协同又相互拮抗,其平衡失调会导致免疫功能紊乱。本实验结果表明,模型对照组与正常对照组相比,CD3+T细胞、CD3+CD4+T细胞降低,说明参与免疫功能的T细胞总数和T细胞亚群减少,而免疫功能的正常发挥是以足够数量的免疫细胞为物质基础的,T细胞及其亚群的减少将会影响到如黏附功能、信号转导等免疫功能,造成老龄个体的免疫功能降低。HPS高、中、低剂量组和维生素E组均使小鼠CD3+T、CD3+CD4+T、CD3+CD8+T细胞百分比升高,说明红芪多糖对亚急性衰老小鼠的T淋巴细胞及亚群有升高作用。
CD28分子是T细胞表面重要的共刺激分子, CD28分子表达的缺失是免疫衰老的重要标志之一[11],随着年龄的增加,CD28分子的表达逐渐下降甚至丧失[12]。CD28表达水平的降低会使T细胞缺乏共刺激信号而失去免疫功能,在无CD28信号时,TCR表现为失活状态。在本实验中,模型对照组CD3+CD28+T细胞明显减少,提示由其介导的免疫功能已经降低。HPS高、中、低剂量组和维生素E组不同程度升高了小鼠CD3+CD28+T细胞百分比,并且在HPS高、中剂量时的作用表现的较为明显。
白细胞介素(IL-1、IL-2、IL-4等)、干扰素(IFN-α、IFN-β、IFN-γ)、肿瘤坏死因子(TNF)和转化生长因子β(TGFβ)等是重要的细胞因子,可调节免疫反应。与衰老关系最密切的是IL-2,是参与免疫应答的重要细胞因子[13]。研究表明,老龄小鼠T细胞分泌IL-2含量和活性均比青龄小鼠明显降低[14]。本实验中,模型对照组小鼠IL-2水平明显降低,在HPS作用后,HPS 3个剂量组小鼠IL-2水平均升高,促进了T淋巴细胞分泌IL-2的能力。IL-4是由Th2细胞产生,具有较强的免疫调节作用。本实验中,HPS 3个剂量均能不同程度升高IL-4水平,说明能够增强小鼠的体液免疫。
机体的IL-4和INF-γ通常维持在相对平衡的状态,对小鼠免疫系统的正常功能具有调节作用。本实验中,模型对照组小鼠IFN-γ水平明显降低,在经HPS作用后,HPS 3个剂量组小鼠IFN-γ水平均升高,从而促进Th1细胞的增殖、分化,增强细胞免疫应答的能力。
肿瘤坏死因子为一类能引起肿瘤组织出血坏死的细胞因子,是重要的促炎性细胞因子,在慢性炎症中发挥重要作用。TNF-α可以诱导多种细胞的增殖及凋亡,肿瘤发生和衰老等与其相关,TNF-α与受体结合后能够通过细胞内信号转导引起自由基产生过量,进而加速机体的衰老[15]。本实验中,模型对照组TNF-α升高,在血清中表达有增加的趋势,在衰老过程中可能存在慢性炎症。红芪多糖3个剂量组和维生素E组TNF-α均不同程度下降,减轻了机体的炎症反应,可能对机体衰老的慢性炎症过程有对抗作用。
本实验中,对红芪多糖高、中、低剂量组相关实验数据进行比较后表明, HPS高、中剂量组作用较显著,说明红芪多糖在一定剂量能够纠正机体细胞因子的免疫失衡状态,增强机体细胞免疫和体液免疫应答。
4参考文献
[1]国家药典委员会.中华人民共和国药典:一部[M].北京:化学工业出版社,2005.
[2]杨林,谭玉玲.中药红芪研究现状[J].中外医疗,2010,5(5):120-121.
[3]AGARWAL S, BUSSE PJ.Innate and adaptive immunosenescence[J].Annals of Allergy, Asthma & Immunology,2010, 104(3):183-190.
[4]龚国清,徐黻本.小鼠衰老模型研究[J].中国药科大学学报,1991,22(2):101-103.
[5]韦巍,李雪华.多糖的研究进展[J].国外医学(药学分册),2005,32(3):179-184.
[6]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理与治疗学,2004, 9(9): 1069-1072.
[7]朱亚珍,朱虹光.D-半乳糖致衰老动物模型的建立及其检测方法[J].复旦学报(医学版),2007,34(4):617-619.
[8]程卫东,李顺保.红芪研究与开发[M].兰州:甘肃文化出版社,2012.
[9]HEROLD KC, PESCOVITZ MD, MCGEE P, et al.Increased T cell proliferative responses to islet antigens identify clinical responders to anti-CD20 monoclonal antibody(rituximab) therapy in type 1 diabetes[J].Journal of immunology,2011,187(4):1998-2005.
[10]WANG LISHENG, SUN JUNHONG, MARGRET HORVAT.Evaluation of MTS, XTT, MTT and 3HTdR incorporation for assessing hepatocyte density[J].Methods in Cell Science,1996, 18(3):249-255.
[11]MALAGUARNERA L, FERLITO L, IMBESI RM, et al.Immunosenescence : a review[J].Archives of Gerontology and Geriatrics,2001, 32(1):1-14.
[12]VALLEJO ABBE N.CD28 extinction in human T cells: altered functions and the program of T cell senescence[J].Immunological Reviews,2005, 205:158-69.
[13]张锡涛,贺松其,刘永源,等.二陈汤对亚急性衰老小鼠器官指数及自由基代谢的影响[J].广西中医学院学报,2002,5(4):1.
[14]曹雪涛.白细胞介素-2的基础与临床[M].北京:北京科技出版社,1990.
[15]周建军,高云飞,王宏芳,等.TNF-α诱导血管内皮细胞的衰老[J].科学通报,2001,46(19):1636-1640.
(编辑陶珠)
文章编号:1001-6910(2016)06-0063-06
中图分类号:R285.5
文献标志码:B
doi:10.3969/j.issn.1001-6910.2016.06.31
通信作者:程卫东,博士,教授,博士生导师,chengweidong888@sina.com
* 基金项目:国家自然科学基金项目(81373806);甘肃省中医药管理局中医药科学技术研究课题(GZK-2012-43);甘肃省中医药管理局中医药科学技术研究课题(GZK-2013-18)
收稿日期:2015-04-23;修回日期:2016-03-28

