增强的UV-B辐射对高粱幼苗光合和抗氧化系统的影响
石新新, 李佐同, 杨克军,赵长江*, 杨荣斌, 于高波, 黄寿光,
徐晶宇1, 2, 贺 琳1, 2,赵 莹1, 许艳梅1,马丽峰1, 范博文1
增强的UV-B辐射对高粱幼苗光合和抗氧化系统的影响
石新新1, 2, 3, 李佐同1, 2*, 杨克军1, 2,赵长江1, 2, 3*, 杨荣斌4, 于高波1, 黄寿光1,
徐晶宇1, 2, 贺 琳1, 2,赵 莹1, 许艳梅1,马丽峰1, 范博文1
1.黑龙江八一农垦大学农学院,黑龙江 大庆 163319 2.黑龙江省教育厅寒地作物种质改良与栽培重点实验室,黑龙江 大庆 163319 3.国家杂粮工程技术研究中心,黑龙江 大庆 163319 4.北大荒垦丰种业股份有限公司北安分公司, 黑龙江 黑河 164000
由于臭氧层逐渐变薄,到达地球表面UV-B辐射不断增加,因UV-B辐射改变的太阳光谱将会对陆地植物造成不同程度的伤害。本试验以高粱龙杂5为材料,对二叶一心高粱进行四种剂量UV-B处理,恢复2 d采用光合仪测定光合参数,并取样测定抗氧化酶活性。随着UV-B剂量的升高,高粱叶片褐化损伤加重,植株矮化,鲜重和干重显著降低; 花青素含量显著升高,叶绿素和类胡萝卜素含量显著减少,净光合速率和叶绿素荧光参数显著下降。同时,随UV-B剂量升高,高粱幼苗气孔导度、胞间CO2浓度和蒸腾速率表现为“降-升-降”变化; POD和CAT活性呈现“降-升-降”变化; SOD和GR活性呈现“降-升”变化,APX和GPX呈现“升-降-升”变化。在供试的四种剂量中,UV-B处理6 h(相当2.4 J·m-2)的高粱幼苗净光合急剧下降,其他光合指标以及抗氧化酶活性也表现出明显转折。结果表明,增强的UV-B辐射直接导致高粱光合色素、净光合速率和叶绿素荧光参数的改变; 高粱抗氧化系统对高、低剂量UV-B响应机制不同, 其中 ASA-GSH循环对低剂量UV-B反应更敏感,高剂量UV-B辐射不仅破坏高粱光合作用,而且启动植物酶促和非酶抗氧化系统,导致叶片褐化坏死,植株生物量累积减少、株高矮化,甚至死亡。
高粱; UV-B; 光合作用; 抗氧化系统
引 言
作为太阳光谱的一部分,紫外线辐射按波长可分为短波紫外辐射(UV-C, 200~280 nm)、中波紫外辐射(UV-B, 280~320 nm)、长波紫外辐射(UV-A, 320~400 nm),其中UV-A和UV-C绝大部分可以被大气层吸收; 被少量吸收的UV-B可直接到达地球表面,对陆生生物造成一定的影响。近些年,由于氟氯代烷的大量使用,使臭氧浓度下降,臭氧层变薄、空洞,导致到达地球表面的UV-B辐射不断增强,对地球陆生不可移动植物造成损伤有逐渐加重的趋势。有研究表明高强度UV-B辐射导致植物(作物)节间缩短矮化[1],叶面积减小、特定叶重增加[2]。另有研究表明, 植物特定叶重的增加有利于提高其适应环境辐射的能力,且叶组织的上层可作为一种解剖学屏障来减少UV-B进入敏感区域[1]。并且UV-B辐射会破坏叶表皮细胞,甚至叶肉细胞,导致受伤害植物叶片表面产生褐色坏死斑块,从而影响植物生长和发育。

目前关于增强的UV-B辐射对于高光效C4作物高粱[Sorghumbicolor(L.Moench)]的影响及生理生化机理鲜有报道。本研究通过对高粱幼苗进行不同剂量UV-B辐射处理,旨在明确增强的UV-B辐射对高粱幼苗生长的影响,并揭示高粱幼苗光合作用和抗氧化系统对逐渐增强的UV-B辐射响应的生化机理,有助于进一步揭示因UV-B辐射不断增强而改变的太阳光谱,对粮食作物生长发育、产量和品质的影响。
1 实验部分
1.1 材料与处理
试验于2013年—2014年在黑龙江八一农垦大学寒地作物种质改良与栽培重点实验室进行。试验材料高粱杂交品种龙杂5号,由黑龙江省农科院作物育种研究所提供。精选大小一致、饱满、无破损的高粱种子置于阳光下2~3 d,10%次氯酸钠消毒、洗净、浸种,置于28 ℃培养箱培养24 h,播种于花卉土与蛭石1∶1混合的土壤中,覆土2~3 cm,培养条件为:昼夜温度(25±2)℃/(20±2)℃, 光照12 h·d-1, 光强为1 000 μmol·m-2·s-1, 相对湿度为60%~80%。二叶一心高粱幼苗,进行UV-B处理,UV-B强度为40 μw·cm-2,分别处理0,3,6,9,12 h,恢复2 d测定指标并取样。
不同剂量UV-B辐射采用UV-B灯(UV-B313 lamp, Q-Panel Lab Products),灯管外侧使用0.13 mm醋酸纤维素膜进行包裹(Cadillac.USA),已达到过滤UV-C辐射。灯管悬挂于高粱幼苗顶部,用紫外辐照计(北京师范大学光电仪器厂)测定UV-B辐射强度为40 μw·cm-2。
1.2 花青素的测定
参考张志良、王学奎等[11-12]方法并改进。称取0.5 g样品置于离心管中,用5 mL 0.1 mol·L-1的盐酸乙醇溶液(8.3 mL浓盐酸用95%乙醇稀释成1 L)于28 ℃浸提2~3 d,采用分光光度计测定提取液在530,620,650 nm下的光密度值。
1.3 光合参数的测定
UV-B处理并恢复2 d,用Li-6400XTR光合仪(美国Li-COR公司)测定第二片功能叶的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)。测定时叶室CO2浓度为400μL·L-1, 光强约为800μmol·m-2·s-1, 温度为(25±2)℃, 每个处理至少重复5次。
1.4 叶绿素及叶绿素荧光参数的测定
参考张志良、王学奎等[10-11]的方法并改进。将叶片剪碎置于试管中,并加入5mL95%乙醇,28 ℃培养箱中浸提2~3d,以95%乙醇溶液做参比溶液,用分光光度计测定提取液在663,645,470nm下的光密度值。
采用OS-30p荧光仪(美国Opti-Sciences公司)分别测定功能叶光合参数的动态变化和光系统Ⅱ(PSII) 最大光化学效率(Fv/Fm)。
1.5 抗氧化酶的测定
超氧化物歧化酶活性(SOD)测定,参考Giannopolitis和Ries等[12]的方法并改进,采用分光光度计(日本HITACHI公司)于560 nm测吸光值。
过氧化物酶(POD)活性的测定,参考Britton和Mehley等[13]的方法并改进,于470 nm测OD值比色。
过氧化氢酶(CAT)活性的测定,参照Aebi等[14]的方法并改进,最后加H2O2。抗坏血酸过氧化物酶(APX)的测定,参照Nakano和Asada(1981)[15]的方法。谷胱甘肽过氧化物酶(GPX)活性的测定,参照Urbanek(1991)[16]的方法。谷胱甘肽还原酶(GR)活性的测定,参照Schaedle和Bassham(1977)[17]方法。
1.6 统计分析
用Excel 2003对数据进行统计分析,采用IBM SPSS Statistics 19软件做单因素方差分析、多重比较及差异显著性分析,文中数据均为重复3次或3次以上所得平均值。
2 结果与讨论
2.1 不同剂量UV-B辐射对高粱幼苗表型的影响
对二叶一心高粱幼苗进行不同剂量UV-B处理。UV0:对照,剂量: 0; UV3: 40 μw·cm-2处理3 h, 相当1.2 J·m-2; UV6: 40 μw·cm-2处理6 h, 相当2.4 J·m-2; UV9: 40 μw·cm-2处理8 h, 相当3.6 J·m-2; UV12: 40 μw·cm-2处理12 h, 相当4.8 J·m-2。
如图1所示,经不同剂量UV-B处理后,高粱幼苗呈现出不同的伤害表型。随着UV-B剂量的升高,幼苗受到的伤害逐渐加重。首先,幼苗的株高依次降低且差异明显,根长呈逐渐变短的趋势但差异不明显。另外,高粱幼苗的三片叶片也表现出不同程度的坏死斑块并伴随萎蔫。

图1 不同剂量UV-B辐射对高粱幼苗表型的影响
不同剂量UV-B辐射对植株的干鲜重也会产生一定的影响,且差异显著(表1)。UV-B辐射能够使植株地上、地下部分的干鲜重显著降低,干物质的积累明显减少。与对照UV0相比,UV3,UV6,UV9和UV12处理地上鲜重分别显著降低6.03%,30.54%,38.52%和54.28%; 地下鲜重分别降低5.88%,17.11%,20.32%和29, 41%。说明UV-B辐射致使植株体内的含水量减少,细胞失水、叶片萎蔫。地上干重分别降低21.50%,30.00%,37.00%和44.50%; 地下干重分别降低5.13%,17.95%,23.08%和25.64%。证明了UV-B辐射剂量的增大会降低植物的总生物量积累,影响了植株的生长。
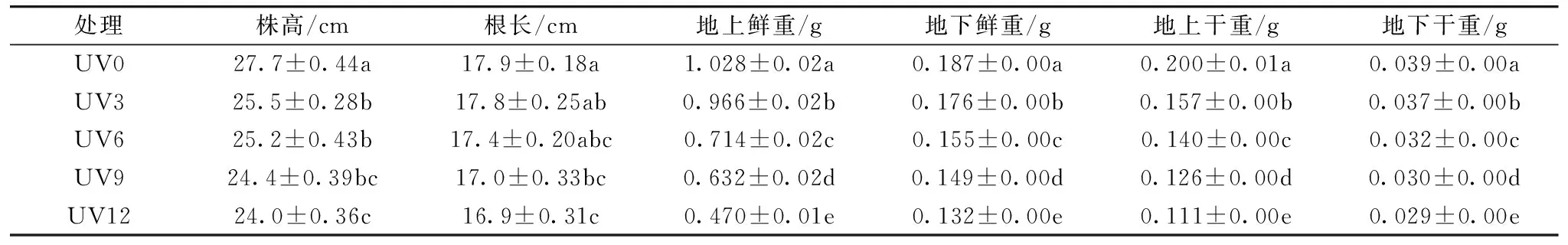
表1 不同剂量UV-B辐射对高粱幼苗生物量的影响
注:a, b, c, d, e分别代表数据之间的差异显著性
当植物受到UV-B处理时,叶片表面会积累大量的花青素,呈红色斑点状。而且,花青素也是类黄酮类色素的一类,其含量的提高有助于植物对UV-B处理的抵抗作用。如图1所示,植物叶片中花青素含量随着UV-B辐射剂量的增加呈上升趋势,且差异显著。UV3,UV6,UV9和UV12较UV0分别降低14.46%,33.92%,57.64%和85.46%。说明UV-B辐射可以使植物体内花青素含量升高用以增强植物的抗性抗逆境能力。
2.2 不同剂量UV-B辐射对高粱苗期叶片光合参数的影响
净光合速率体现了植物合成有机物能力; 气孔导度表现出叶片表面气孔的开闭状态; 蒸腾作用是植物吸收、运输水分以及有机物运输的主要动力,也是降低植物体温度的重要方式,其正常运行为CO2同化提供了保障。
如图2(a)所示,UV-B胁迫下的高粱幼苗叶片的净光合速率呈明显下降趋势,且差异显著。与对照相比,UV3,UV6,UV9和UV12分别下降5.64%,21.33%,24.60%和26.48%。其中UV6处理下净光合速率急剧下降,表明UV-B辐射可以使植物的净光合速率下降,且随着UV-B剂量的升高逐渐降低。
如图2(b), (c), (d)所示,气孔导度、胞间CO2浓度、蒸腾速率皆呈现先下降后上升再下降的趋势,且都在UV6处理时达到最低点、UV9时达到最高点,差异显著。说明40 μW·cm-2UV-B辐射6 h可能是一个伤害临界点,即当辐射剂量超过2.4 J·m-2时,气孔将被破坏。
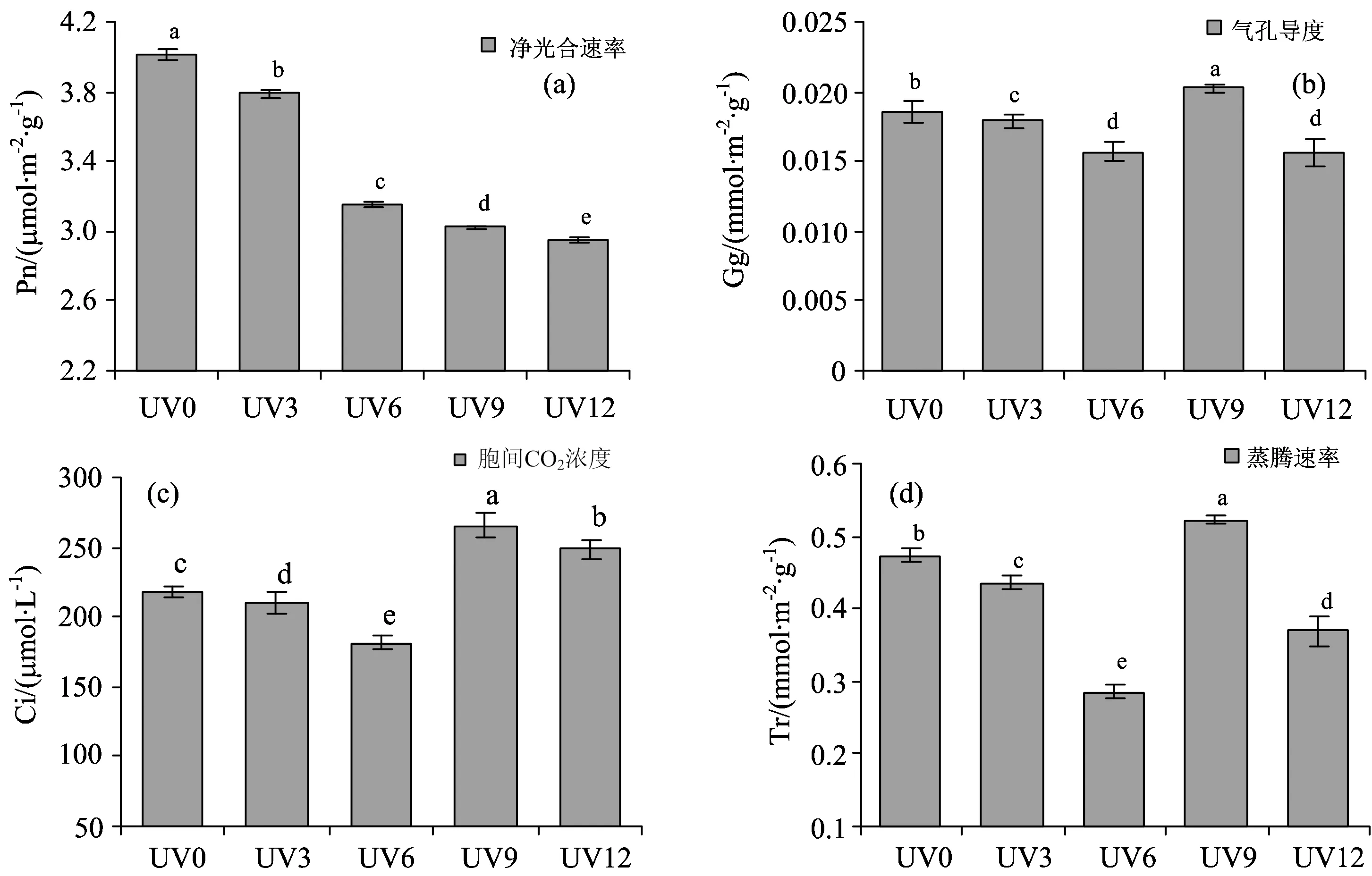
图2 不同剂量UV-B处理对高粱幼苗叶片的净光合速率、气孔导度、胞间CO2浓度、蒸腾速率的影响
2.3 不同剂量UV-B辐射对光合色素的影响
叶绿素是植物吸收、传递、转化光能的主要媒介,植物中叶绿素含量在一定程度上反映了光合能力强弱,进而影响到植物干物质的积累以及生长发育。类胡萝卜素也可以吸收光能,并能够将其传递给叶绿素; 值得一提的是,类胡萝卜素也是一种光保护色素,其含量的多少对植物耐强光性起到一定作用。如表2所示,随着UV-B剂量的增加,叶绿素总量、类胡萝卜素含量皆呈降低趋势、差异显著,与对照相比UV3,UV6,UV9和UV12的叶绿素总量分别下降5.46%,15.55%,23.11%和34.03%; 类胡萝卜素含量分别下降5.26%,10.53%,15.79%和26.32%。且各处理间叶绿素a含量、叶绿素b含量变化明显、差异显著。UV3,UV6,UV9和UV12的叶绿素a含量较UV0分别降低4.61%,13.82%,20.39%和28.95%; 叶绿素b含量分别降低8.05%,19.54%,28.74%和43.68%。说明高剂量UV-B辐射使光合色素含量下降,破坏了植物的光合体系。
表2 不同剂量UV-B处理对高粱幼苗叶片中叶绿素和类胡萝卜素含量的影响

Table 2 Effects of different dosages of UV-B treatment on contents of chlorophyll and chlorophyll fluorescence parameters in leaves of Sorghum seedlings
2.4 不同剂量UV-B辐射对叶绿素荧光参数的影响
叶绿素荧光参数(Fv/Fm)体现了植物潜在的光合能力,即PSII原初光能转化率的大小。如表2所示,UV3,UV6,UV9和UV12较UV0依次降低0.13%,6.02%,14.97%和26.74%。说明植物受到不同剂量UV-B处理,其荧光值下降,PSII原初光能转化率减小,潜在的光合能力下降,不利于植物的生长发育。

图3 不同剂量UV-B处理对高粱幼苗叶片中荧光值的影响
2.5 不同剂量UV-B辐射对抗氧化酶的影响


图4 高粱幼苗叶片中SOD活性、POD活性、CAT活性
2.6 不同剂量UV-B辐射对ASA-GSH循环系统中三大酶类的影响
APX,GPX和GR是ASA-GSH循环系统中三类非常重要的酶,也是清除活性氧ROS的关键酶。如表3所示,叶片中APX呈现先上升后下降再上升的趋势,且差异显著。UV3,UV12较UV0分别上升2.09%和0.26%,UV6和UV9较UV0分别下降2.55%和0.09%。说明不同剂量的UV-B辐射会影响APX活性。当APX清除H2O2时需要底物,低剂量时底物充足APX活性升高; 伴随着UV-B剂量的增加,H2O2大量产生,APX呈现下降趋势; 植物在感受到外界高剂量UV-B伤害时,启动应激反应,促进APX清除H2O2。如表3所示,叶片经不同剂量UV-B辐射后GPX活性变化明显、差异显著。UV3和UV9较UV0上升2.69%和5.04%,UV6和UV12分别降低2.38%和3.84%。GR活性表现为先下降后上升的趋势,UV3和UV6较UV0分别下降3.44%和0.75%,UV9和UV12分别上升0.53%和0.93%。说明不同剂量的UV-B辐射使APX、GPX和GR的活性发生了变化,即影响ASA-GSH循环系统对活性氧ROS的清除作用,提高了植物在高剂量UV-B处理下的抗氧化能力。

表3 不同剂量UV-B对高粱幼苗APX,GPX,GR活性的影响
UV-B辐射不仅是太阳光的一个特殊波段,随着到达地球表面剂量的增加也将是一种胁迫因子[18],增强的UV-B辐射是陆地植物必须要面对的环境逆境之一,不利于陆地植物的生长发育, 导致作物减产。
研究表明,随着UV-B剂量的升高,植物体内花青素含量呈明显上升趋势且差异显著, 叶片表面暗红色斑块逐渐增多,植株矮小。花青素是类黄酮的一种,是吸收UV-B辐射的一种重要的次生代谢产物。黄酮类物质可以使色素沉积、植株矮小[19]。UV-B辐射可能激活了类黄酮类物质代谢途径,或刺激活化代谢调控基因,如查尔酮合成酶(chalcone synthase, CHS)基因产生大量类黄酮类物质,提高植物的抗UV-B辐射能力[20-21]。
试验研究表明UV-B辐射导致叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量皆下降,且差异显著。这与杨景宏等研究结果相一致,即UV-B辐射降低了光合色素的含量,特别是叶绿素a含量[22],然而也有试验证明UV-B辐射不会使植株体内叶绿素含量发生变化,甚至会使其含量上升[23-27],且类胡萝卜素含量增加[28],这可能与植物本身的差异性有关。大量研究证明,高强度UV-B辐射会破坏PSI和PSII,且PSII的损伤更为严重[29]。本试验中Fv/Fm随着UV-B剂量的升高呈明显下降趋势,这与朱玉安的研究结果相一致。光合作用是植物进行正常的生命活动的保证,也是植物积累有机物的重要途径。本试验中,伴随着UV-B剂量的升高,植物的净光合速率表现出逐渐下降趋势,且差异显著。气孔导度、胞间CO2浓度和蒸腾速率都表现出先下降后上升再下降的趋势,原因可能是低剂量UV-B辐射导致叶片气孔关闭,从而气孔导度等指标下降; 高剂量UV-B辐射可能破坏了叶片表面的部分气孔,使其失去开闭能力。这与吴杏春等研究UV-B辐射处理使水稻叶片气孔受到破坏,叶绿体结构变形,基粒片层排列紊乱[30]相吻合。然而,本试验中叶片气孔是否全部损伤,且植物自身是否可以修复还有待于进一步的证明。
当植物处于增强UV-B辐射时,其体内酶类物质的种类、活性、含量都会发生变化,抗氧化酶是植物抵御逆境时很重要的一类酶。Fedina等[31]认为在UV-B辐射处理后,植物体中SOD,POD和CAT活性上升; 然而,本研究中低剂量UV-B辐射处理SOD,POD和CAT均呈现下降趋势,可能是作物间差异所致,或者是处理用的UV波段不一样。这与方云忠[32]的试验结果相吻合。当UV-B辐射增强将会刺激植物产生活性氧信号及胁迫伤害,辐射增强到一定剂量时,植物启动自身的抗氧化防御机制。本研究中,SOD酶活性先下降后上升,可能是高剂量辐射致使高粱产生超氧阴离子,激发SOD的清除活性;POD和CAT活性呈先下降后上升再下降的趋势,可能是低剂量UV-B辐射产生较少的信号活性氧,而不是伤害活性氧,或者是产生的少量活性氧由ASA-GSH循环进行清除; 当UV-B剂量过高时,可能是POD清除H2O2底物不足,导致POD活性下降; 也可能高剂量UV-B辐射破坏抗氧化酶蛋白或抑制酶蛋白形成; 也可能高剂量的UV-B辐射对细胞有直接损害,致使CAT活性下降[33]。具体响应机制尚不明确,需进一步研究。
3 结 论
随着UV-B辐射剂量的升高,高粱幼苗的抗氧化及光合系统响应机制不完全相同。净光合速率Pn和最大光化学效率Fv/Fm呈显著下降趋势; SOD和GR表现为“降-升”变化;Gg,Ci,Tr,POD和CAT呈“降-升-降”趋势;APX和GPX表现为“升-降-升”变化。低剂量UV-B(≤1.2J·m-2) 辐射不会对植物造成严重伤害,有利于植物的生存; 高剂量UV-B(≥3.6J·m-2)辐射使植物的抗氧化系统和光合系统受到损伤、叶片花青素沉积褐化坏死、植株矮化、甚至死亡,不利于植物的生长发育。
[1] CAI Mei-ju, FENG HU-yuan, AN Li-zhe, et al(蔡美菊, 冯虎元, 安黎哲, 等).Chinese Journal of Applied Ecology(应用生态学报), 2002, 13(3): 359.
[2] Biggs R H, Kouthus S V.UV-B Biological and Climate Effects Research Final Report US Department of Agriculture University of Florida Press, Gainesville, 1978.
[3] Caldwel M M.Physiology (New Serries), Springer Verlay, 1981, 12A: 169.
[4] Archana A, Eric S M, May R B, et al.Journal of Chemical Ecology, 1993, 19(12): 2813.
[5] Jordan B R, HE J, Chow W S, et al.Plant Cell Environment, 1992, 15(1): 91.
[6] Jorden B R, James P E, Strid A, et al.Plant Cell and Environment, 1994, 17 (1): 45.
[7] TANG Xu-dong, AN Li-zhe, WANG Xun-ling(唐旭东, 安黎哲, 王勋陵).Academic of Plant Physiology(植物生理学报), 1998, 24(2): 171.
[8] YAN Bin, DAI Qiu-jie(宴 斌, 戴秋杰).Academic of Plant Physiology(植物生理学报), 1996, 22(4): 373.
[9] Krizek D T.Plant Physiology, 1993, 90(3): 593.
[10] ZHANG Zhi-liang(张志良).Handbook of Plant Physiology Experiment(植物生理学实验指导).Beijing: Higher Education Press(北京: 高等教育出版社), 1990.
[11] WANG Xue-kui(王学奎).Principle and Technology of Plant Physiological and Biochemical Experiments(植物生理生化实验原理和技术).Beijing: Higher Education Press(北京: 高等教育出版社), 2006.
[12] Giannopolitis C N, Ries S K.Plant Physiology, 1977, 59: 309.
[13] Britton C, Mehley A C.Methods in Enzymology.Academic Press, New York, 1955.764.
[14] Aebi H.Methods Enzymol.,1984, 105:121.
[15] Nakano Y, Asada K.Plant and Cell Physiology, 1981, 22: 867.
[16] Egley G H, Paul R N, Vaughn K C, et al.Planta, 1983, 157: 224.
[17] Schaedle M, Bassham J A.Plant Physiology, 1977, 59: 1011.
[18] Barnes P W, Fijnt S D, Caldwell M M.American Journal of Botany, 1990, 77(10): 1354.
[19] Buer C S, Muday G K.Plant Cell, 2004, 16: 1191.
[20] Kakani V G, Reddy K R, Zhao D, et al.Agricultural and Forest Meteorology, 2003, 120(1/4): 191.
[21] Jenkins G.Plant Cell & Environment, 1997, 20(6): 773.
[22] YANG Jing-hong, CHEN Tuo, WANG Xun-ling(杨景宏, 陈 拓, 王勋陵).Chinese Journal of Plant Ecology(植物生态学报), 2000, 24(2): 102.
[23] Well E.Ber.Dtsch.Bot.Ges., 1974, 87: 267.
[24] Rech M, Moucet J L, Manceau A M, et al.Botanica Marina, 2005, 48(5): 407.
[25] Ruhland C T, Xiong F S, Clark W D, et al.Photochemistry and Photobiology, 2005, 81(5): 1086.
[26] LIU Min, LI Rong-gui, FAN Hai, et al(刘 敏, 李荣贵, 范 海, 等).Acta Botanica Boreali-Occidentalia Sinica(西北植物学报), 2007, 27(2): 291.
[27] SHI Sheng-bo, BEN Du-ying, ZHAO Xin-quan, et al(师生波, 贲杜英, 赵新全, 等).Chinese Journal of Plant Ecology(植物生态学报), 2001, 25(5): 520.
[28] Billings, Mooney H A.Annual Review of Biochemisty, 1968, 43: 481.
[29] ZHU Yu-an(朱玉安).Shannxi Journal of Agricultural Sciences(陕西农业科学), 2007, 4: 78.
[30] WU Xing-chun, LIN Wen-xiong, HUANG Zhong-liang(吴杏春, 林文雄, 黄忠良).Acta Ecological Sinica(生态学报), 2007, 27(2): 554.
[31] Fedina I, Hidema J, Velitchkova M, et al.Biologia Plantarum, 2010, 54, (3): 571.
[32] FANG Yun-zhong, ZHENG Rong-liang(方允中, 郑荣梁).The Theory and Application of Free Radical Biology(自由基生物学的理论与应用).Beijing: Science Press(北京: 科学出版社), 2002.295.
[33] DONG Xin-chun, ZHAO Shi-jie, GUO Shan-shan, et al(董新纯, 赵世杰, 郭姗姗, 等).Journal of Shandong Agricultural University·Natural Science Edition(山东农业大学学报·自然科学版), 2006, 37(2): 157.
Effects of Enhanced Ultraviolet B Irradiation on Photosynthetic and Antioxidant System of Sorghum Seedlings
SHI Xin-xin1, 2, 3, LI Zuo-tong1, 2*, YANG Ke-jun1, 2, ZHAO Chang-jiang1, 2, 3*, YANG Rong-bin4, YU Gao-bo1,HUANG Shou-guang1, XU Jing-yu1, 2, HE Lin1, 2, ZHAO Ying1, XU Yan-mei1, MA Li-feng1, FAN Bo-wen1
1.College of Agronomy Heilongjiang Bayi Agricultural University, Daqing 163319, 2.Key Laboratory of Crop Germplasm Improvement and Cultivation in Cold Regions of Heilongjiang Province Education Department, Daqing 163319, 3.National Engineering Research Center for Coarse Cereals, Daqing 163319, 4.Beidahuang Ken Feng Seed Industry, Heihe 164000, China
The UV-B radiation on the surface of our planet has been enhanced due to gradual thinning of ozone layer.The change of solar spectrum UV-B radiation will cause damage to all kinds of terrestrial plants at certain degree.In this paper, taking breeding sorghum (Sorghumbicolor(L.Moench))variety Longza No.5 as sample, 40 μW·cm-2UV-B radiation treatment was conducted on sorghum seedlings at two-leaf and one-heart stage and different time courses; then after a 2 d recovering, photosynthetic parameters were measured with a photosynthetic apparatus; the activities of antioxidant enzymes were detected as well.Our results revealed that, as the dosages of UV-B increasing, leaf browning injury was aggravated, plants dwarfing and significantly were reduced fresh weight and dry weight were observed; anthocyanin content was significantly increased; chlorophyll and carotenoid content significantly were reduced and net photosynthetic rate and chlorophyll fluorescence parameters were decreased.Meanwhile, with the increase in UV-B dosages, stomatal conductance, intercellular CO2concentration and transpiration rate showed “down - up - down” trend; the activities of SOD and GR presented “down - up” changes; activities of POD and CAT demonstrated “down - up - down”, and APX, GPX showed an “up - down - up” pattern.It is worth to note that, under the four-dose treatment, a sharp decline in net photosynthesis in sorghum seedlings was observed at 6 h UV-B treatment (equals to 2.4 J·m-2), and an obvious turning point was also found for other photosynthetic parameters and activities of antioxidant enzymes at the same time point.In summary, the results indicated that the enhanced UV-B radiation directly accounted for the damages in photosynthesis system including photosynthetic pigment content, net photosynthetic rate and chlorophyll fluorescence parameters of sorghum; the antioxidant system showed different responses to UV-B radiation below or above 6 h treatment: ASA-GSH cycle was more sensitive to low-dose UV-B radiation, while high-dose UV-B radiation not only undermined the photosynthesis system, but also triggered plant enzymatic and non-enzymatic antioxidant systems, resulting in leaf browning and necrosis,biomass accumulation reduction, plant dwarfing and even death.
Sorghum; UV-B; Antioxidant systems; Photosynthesis
s
2015-01-12,
2015-04-29
国家自然科学基金项目(31101429),农业部公益性项目(201303007),黑龙江省教育厅科学技术研究项目(12511360),黑龙江八一农垦大学引进人才科研启动基金项目(201101005),黑龙江八一农垦大学研究生创新项目(201301003)和黑龙江八一农垦大学大学生创新创业项目(201201008)资助
石新新, 女,1990年生,黑龙江八一农垦大学农学院硕士研究生 e-mail: 1181979286@qq.com *通讯联系人 e-mail: lxg6401999@163.com; zhaocj15@126.com
S132
A
10.3964/j.issn.1000-0593(2016)05-1389-07
(Received Jan.12, 2015; accepted Apr.29, 2015)

