不锈钢管网中氯胺的生成及衰减规律
何桂琳++李聪++张土乔++赵桃桃++李训超++毛欣炜��

摘要:依托大型中试给水管网实验平台,研究了不锈钢管中不同形态的氯胺在不同氯氮比(Cl/N)下的生成和衰减.将管网试验结果与烧杯试验结果进行对比,结果表明:在Cl/N为1~12的范围内,不同水质条件下的自由氯、一氯胺和总氯的生成趋势均为去离子水>主体水>不锈钢管;而不锈钢管中二氯胺的生成量远高于烧杯情况下的生成量,且在Cl/N为10时,不锈钢管中二氯胺浓度占总氯浓度的90%以上.不同Cl/N下,不锈钢管中各种形态的氯胺衰减趋势是一致的,一氯胺的衰减速率为 6∶1> 3∶1> 4∶1> 5∶1,随着反应的进行,二氯胺浓度先增大后减小,且这种变化与Cl/N没有明显的相关性.
关键词:不锈钢管;氯胺;氯氮比
中图分类号:X5 文献标识码:A
为防止水致疾病的传播,消毒一直是自来水厂最重要的工艺环节之一.在饮用水处理中,氯作为消毒剂灭活微生物,防止以水为媒介的大规模疾病的流行已经有 100多年的历史,但是它的使用,会使水中产生毒性较强的卤代消毒副产物[1-4].因此,在过去几十年中,氯胺作为一种替代的消毒剂,在世界范围内得到了广泛地使用(如:中国,澳大利亚,新加坡,美国等).氯胺消毒可以有效降低消毒副产物,特别是三卤甲烷和卤乙酸的生成[5],此外,由于氯胺的氧化性比自由氯弱,因此可以使供水管网在较长时间内保持一定余氯水平.
根据自由氯和氨氮质量比,自由氯和氨氮逐步发生反应生成一氯胺(NH2Cl)、二氯胺(NHCl2)和三氯胺(NCl3),溶液中3种形态的氯胺所占的比例除了与初始Cl/N(质量比,下同)有关外,还与反应的pH、温度以及反应时间有关[6-7].这3种形态的氯胺消毒效果方面的差异如下: NHCl2消毒最好,其次是NH2Cl,但是NHCl2具有臭味, NHCl3消毒效果最差, 并且具有恶臭气味.所以在3种氯胺形态中,既能达到良好效果又不会对水质产生不利影响的形态是NH2Cl,因此,在采用氯胺消毒的工艺中应控制好反应条件,使反应向更有利于生成NH2Cl的方向进行,尽可能多地生成NH2Cl[8].
关于氯胺生成和衰减的烧杯实验研究已经有很多[8-11],但是对于氯胺在管网中的生成和衰减却鲜有研究.在实际供水中,复杂庞大的供水管网相当于一个大型的“反应器”,水在流经管网的过程中与管内壁充分接触并发生复杂的物理、化学及生物反应,从而导致管网末端水质与出厂水水质有很大不同,而水质的变化使得采用氯胺消毒时管网中氯胺的衰减与纯水理想情况下的衰减有很大不同.
本研究依托大型给水管网实验平台,研究了不锈钢管中不同形态的氯胺在不同氯氮比(Cl/N)下的生成和衰减,并将其与烧杯中的反应规律进行对比,初步探索了氯胺在管网与烧杯条件下规律不同的主要原因,对供水管网实际消毒条件的最优控制提供理论依据.
1实验材料与方法
1.1实验材料
试剂:十二水合磷酸氢二钠(分析纯);氢氧化钠(分析纯);磷酸二氢钾(分析纯);二水合EDTA(分析纯);氯化铵(分析纯);磷酸(化学纯),以上试剂来自国药集团化学试剂有限公司.DPD硫酸盐(分析纯),阿拉丁试剂;次氯酸钠溶液(分析纯),阿拉丁试剂;余氯粉枕包,HACH.实验用水来源:浙江大学市政管网.
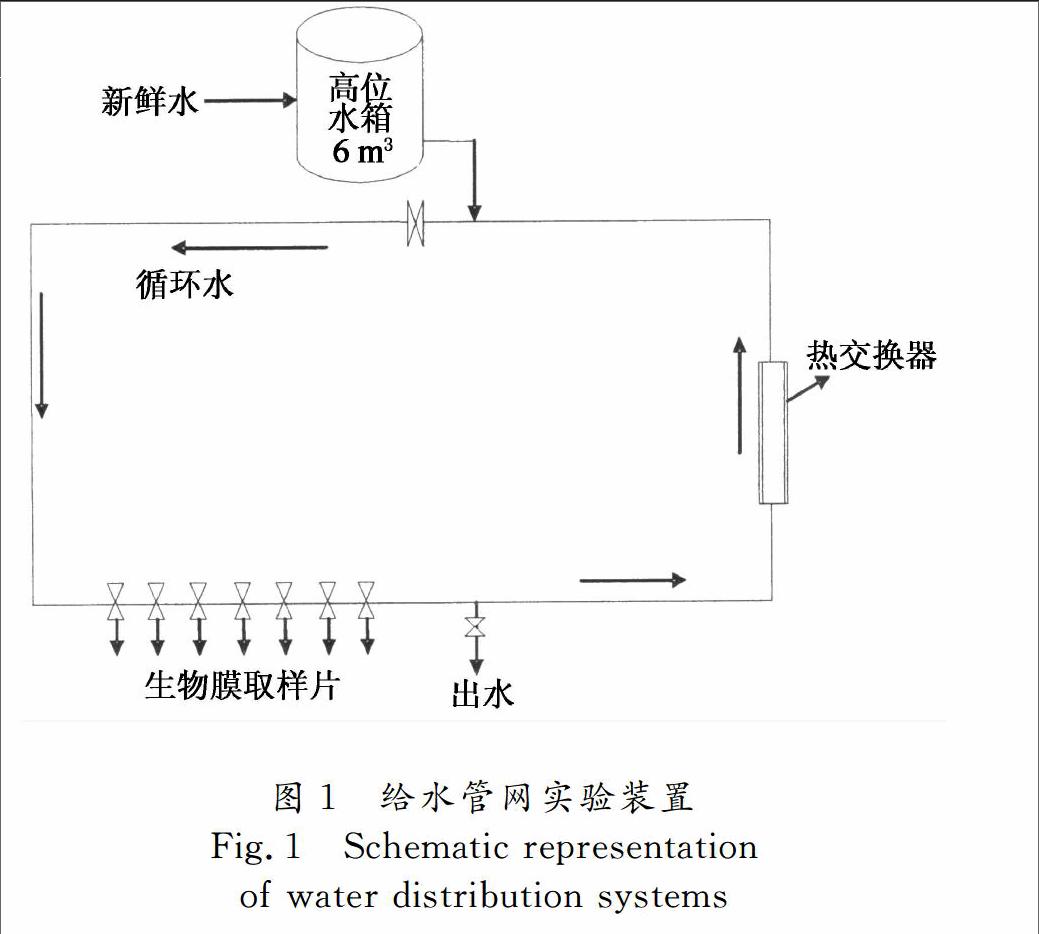
设备及仪器:浙江大学大型管网实验系统,如图1所示.DR2800分光光度计(HACH);UV1800紫外可见分光光度计(岛津,日本);纯水仪;电磁搅拌器等.
1.2实验方法
管网实验:实验系统共有A,B,C和D 4套环路,其中A,D环路为球墨铸铁内衬水泥管;B环路为PE管;C环路为不锈钢管.管长约80 m,管径为150 mm,本实验选用C环路.实验开始前,先清洗环路30 min,待管网排空清洗水后,再次注入新鲜实验用水,并使管网达到满管流流态,通过中控系统调节水温(20 ℃±2 ℃)、流速(1 m/s)等实验条件,并用自动加药装置向管网中加注适量的磷酸溶液或NaOH溶液调节实验所需pH=7.3±0.2.待所有实验条件稳定到所需值后,先向管网中投加一定量的氯化铵溶液,使管网中的氯化铵浓度为0.5 mg/L,然后再向管网中投加不同量的次氯酸钠溶液,使管网中的Cl/N在1~12之间.用250 mL烧杯于不同时刻取样,并立即用UV1800紫外可见光分光光度计测试溶液中不同形态的氯胺含量.
烧杯实验:加入100 mL的去离子水或管网所取实验水于250 mL的棕色容量瓶中,然后加入一定量的氯化铵溶液,再根据不同Cl/N,加入不同量的次氯酸钠溶液,并通过投加适量磷酸氢二钠和磷酸二氢钾调节pH为7.3±0.2,然后在20 ℃±2 ℃条件下于磁力搅拌器上搅拌,不同时刻取样,并立即用UV1800紫外可见光分光光度计测试溶液中不同形态的氯胺含量.
1.3分析方法
不同形态的氯胺浓度采用N,N二乙基1,4苯二胺光度法[12],用UV1800紫外可见光光度计测定.
2结果与讨论
2.1不同水质条件下氯胺的生成
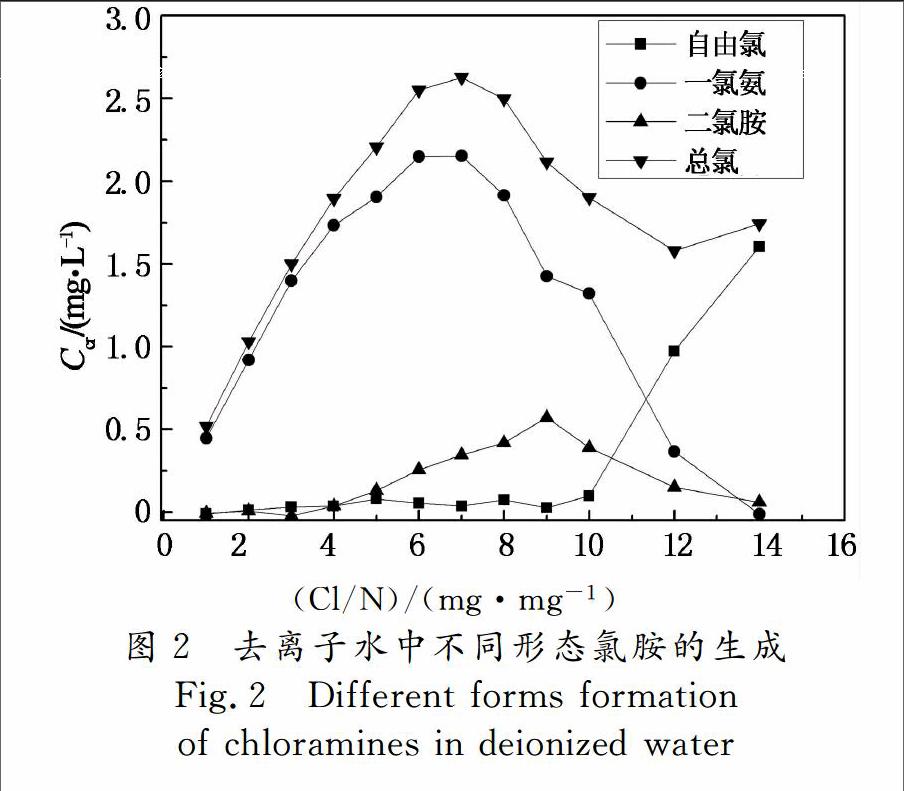
加入100 mL的去离子水于250 mL的棕色容量瓶中,然后加入一定量的氯化铵溶液,使氯化铵的初始浓度为0.5 mg/L,再根据不同Cl/N,加入一定量的次氯酸钠溶液,使Cl/N在1~12之间,调节pH为7.3±0.2,然后在20 ℃±2 ℃条件下于磁力搅拌器上搅拌,45 min后测试去离子水中不同形态氯胺的生成,结果如图2所示,图中Ccr为有效氯浓度.
由图2可知,当Cl/N约为7时,总氯浓度达到峰值,浓度为2.63 mg/L;Cl/N为8之前溶液中主要有效氯成分为一氯胺,占总有效氯浓度的80%以上.这是由于在低Cl/N下,溶液中氯化铵的浓度是过量的,溶液中主要发生式(1)所示的反应,几乎所有的次氯酸钠均参与反应转化为一氯胺.随着Cl/N的增加,参与式(1)反应的次氯酸钠的量逐渐增加,生成的一氯胺量也随之增加[7].在峰值点时,几乎所有的氯化铵都参与反应,生成的一氯胺达到最大值2.15 mg/L.峰值点之后,随着Cl/N的继续增加,溶液中开始发生式(2)所示反应,使溶液中二氯胺的浓度开始升高,并在Cl/N为9时取得最大值.此外,由于二氯胺极不稳定,容易发生自降解反应使其中的Cl+转化为Cl-,从而失去氧化能力,使得峰值点之后随着Cl/N的增大总氯浓度逐渐降低[13].在Cl/N为12时,总氯浓度达到最低,浓度为1.58 mg/L,此点后,由于前期反应基本进行完毕,故随着加氯量的增加,自由氯累积,有效氯浓度上升.由于NCl3在pH<4时才占优势成分,而本实验的pH控制在7.3±0.2,因此没有检测到NCl3的存在.
HClO+NH3NH2Cl+H2O(1)
HClO+NH2ClNHCl2+H2O(2)
管网实验环路为不锈钢管,调节管网流速1.0 m/s,温度20 ℃±2 ℃,pH=7.3±0.2,管网运行45 min后取样测定不同形式氯胺的生成量.实验用水来自浙江大学市政管网,水质条件如下:pH为7.11~7.49;温度为291.3~294.5 K,电导为563~607 μs/cm;溶解氧为8.20~9.63 mg/L;TOC为3.087~4.265 mg/L.
从管网中取一定量的主体水于250 mL容量瓶中,向容量瓶和管网中分别加入相应量的氯化铵,初始浓度均为0.5 mg/L,将容量瓶置于磁力搅拌器上搅拌,同时开始管网实验.将两者反应结果连同相同条件下的烧杯去离子水实验进行对比,结果如图3所示;3种情况下不同形态氯胺的对比结果如图4所示,图中Ccr为有效氯浓度.
(Cl/N)/(mg·mg-1)(a)主体水
(Cl/N)/(mg·mg-1)(b)管网
图3不同水质条件下氯胺的生成
Fig.3Different forms formation
of chloramines in different water quality
由图3,图4对比去离子水、主体水和管网3种状态下不同形态氯胺的生成可知,主体水中不同形态的氯胺生成情况与去离子水中一致,不锈钢管中不同形态氯胺的生成则与前两者差别较大,这种差别主要体现在二氯胺的生成量,不锈钢管中,二氯胺在Cl/N为10时取得最大值,此时溶液中NHCl2的含量占总有效氯的90%以上.自由氯、一氯胺、总氯的生成趋势均为去离子水、主体水、不锈钢管.对于自由氯,在Cl/N小于12时,3种情况下的浓度没有明显差别,在Cl/N为12时,去离子水、主体水和不锈钢管中自由氯浓度分别为0.973,0.562和0.017 mg/L;对于一氯胺,在Cl/N为6时去离子水、主体水和不锈钢管中一氯胺浓度分别为2.149,1.910和1.422 mg/L;在Cl/N为6时去离子水、主体水和不锈钢管中总氯浓度分别为2.55, 2.282 和2.039 mg/L.这是由于自由氯和一氯胺中含有Cl+,自由氯和一氯胺可以与主体水中的天然有机物发生反应,使得主体水中自由氯和一氯胺的生成量低于其在去离子水中的生成量[14].而管网中氯胺生成情况是受多方面因素影响的,如水利条件、管垢含量以及基础设施情况等[15].对于管壁的作用,主要考虑以下方面的影响.首先,管垢中含有大量的有机物,可以与自由氯或者一氯胺发生反应,消耗一部分的自由氯和一氯胺;此外,对3种水体中金属阳离子分析发现,去离子水和主体水中铁离子质量浓度为0 mg/L,反应2 h后不锈钢管中铁离子浓度为0.17 mg/L,一方面自由氯和一氯胺可以作为受体参与铁腐蚀反应,引起铁离子释放,消耗一部分有效氯,另一方面自由氯和一氯胺又可将Fe2+ 氧化成Fe3+消耗一部分有效氯.因此在上述因素作用下,与去离子水和主体水相比,管网中的自由氯和一氯胺生成量是最低的.对于二氯胺,不锈钢管中浓度明显高于去离子水和主体水,Cl/N为8时,去离子水、主体水和不锈钢管中二氯胺浓度分别为0.397,0.405和0.911 mg/L.图5所示为反应10 h内3种水体中二氯胺浓度的变化,管壁对二氯胺浓度变化的贡献率在52.6%~62.0%之间,这是因为相较于去离子水和主体水的简单条件,管网中的反应条件更加复杂,管垢中可能存在使生成二氯胺的反应更易进行,而二氯胺的衰减反应受到抑制的物质,使得管网中的二氯胺含量明显高于去离子水和主体水中.
2.2不同Cl/N下氯胺的衰减动力学
实际生产中常采用的Cl/N为3~5,本实验中总氯在Cl/N为6时取得最大值,因此在初始氯化铵浓度为0.5 mg/L,Cl/N为3~6,管网流速为1.0 m/s,温度为20 ℃±2 ℃,pH=7.3±0.2,管材为不锈钢管的情况下,考察不同形态的氯胺衰减情况,结果如图6所示,图中Ccr为有效氯浓度.
由图6可知,不同Cl/N下,随着反应时间的增大,自由氯、一氯胺和总氯浓度逐渐减少.由于本实验控制初始氯化铵浓度不变,随着Cl/N的增加,氯胺的初始浓度也增加,这是Cl/N和初始浓度共同作用的结果.而二氯胺浓度随着时间的处长增加后减少.这是由于在反应开始的几个小时内,溶液中有多余的氨氮存在,相较二氯胺,次氯酸钠更易与氨氮反应,且在氨氮存在的情况下,二氯胺的衰减速率较慢[13];此外,由于这一阶段一氯胺生成二氯胺的反应也在进行,在上述因素的共同作用下,反应开始的几个小时内,二氯胺的生成大于衰减.随着反应的进行,氨氮和次氯酸钠的浓度逐渐降低,二氯胺的衰减速度加快,并且水中的有机物也消耗二氯胺,最终使得二氯胺的衰减大于生成.
通常情况下用一氯胺的浓度来表示氯胺的浓度.图7所示为不同Cl/N情况下一氯胺的衰减情况,其中CMCA为一氯胺浓度,表1所示为不同Cl/N情况下一氯胺的衰减速率常数.可以看出,在10 h内,不同Cl/N情况下一氯胺的衰减较好地符合一阶反应动力学.在Cl/N为3,4和5时,一氯胺的衰减速率常数分别为0.207,0.193和0.185 h-1,即Cl/N越大,衰减速率常数越小.根据张永吉等人[10]的研究,初始一氯胺浓度越高, Cl/N越低,则一氯胺衰减越快.本实验中在Cl/N为3,4和5时,一氯胺的初始浓度分别为0.696,1.057和1.236 mg/L,衰减速率为3∶1>4∶1> 5∶1,说明在常用Cl/N范围内,Cl/N的作用大于初始一氯胺浓度的影响.当Cl/N为6时,衰减速率常数为0.237 h-1,说明在高Cl/N下,初始浓度的影响大于Cl/N的影响.
3结论
1)在氯化铵的初始浓度为0.5 mg/L, Cl/N为1~12的情况下,主体水与去离子水中各形态氯胺生成趋势较一致;与主体水和去离子水相比管网中二氯胺的生成远大于前两者,在Cl/N为10时取得最大值,此时溶液中二氯胺的含量占总有效氯的90%以上,这是由于管垢和主体水有机物等在内的各因素共同作用造成的.
2)氯胺的衰减动力学试验中,随着反应时间的增大,自由氯、一氯胺和总氯浓度逐渐减少,而二氯胺浓度随着时间的延长先增加后减少.在氯化铵的初始浓度为0.5 mg/L, Cl/N为3~6的情况下,在10 h内不锈钢管中一氯胺的衰减较好地符合一阶反应动力学.在Cl/N为3~5时,随着Cl/N的增大,衰减速率常数逐渐变小,即在较高的Cl/N和较高的初始浓度下一氯胺较稳定,说明在常用Cl/N范围内,Cl/N的作用大于初始一氯胺浓度的影响.当Cl/N为6时,衰减速率常数最大,即在高Cl/N下,初始浓度的影响大于Cl/N的影响.
实际生产中以氯胺作为消毒剂或者二次加氯选择氯胺时,仅从消毒效果持续时间长短来考虑易选择较高的氯氮比.
参考文献
[1]GOLFINOPOULOS S K, NIKOLAOU A D. Survey of disinfection byproducts in drinking water in Athens[J]. Greece Desalination, 2005, 176(1): 13-24.
[2]RICHARDSON S D, PLEWA M J, WAGNER E D, et al. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection byproducts in drinking water: a review and roadmap for research[J]. Mutation Research, 2007, 636: 178-242.
[3]GOSLAN E H, KRASNER S W, BOWER M, et al. A comparison of disinfection by-products found in chlorinated and chloraminated drinking waters in Scotland[J].Water Research, 2009, 43(18): 4698-4706.
[4]KRASNER S W, WESTERHOFF P, CHEN B, et al. Impact of wastewater treatment processes on organic carbon, organic nitrogen, and DBP precursors in effluent organic matter[J].Environmental Science & Technology, 2009, 43(8): 2911-2918.
[5]CHUANG Y H, LIN A Y C, WANG X, et al.The contribution of dissolved organic nitrogen and chloramines to nitrogenous disinfection byproduct formation from natural organic matter[J]. Water Research, 2013, 47(3): 1308-1316.
[6]KINANI S, RICHARD B, SOUISSI Y, et al.Analysis of inorganic chloramines in water[J]. Tractrends in Analytical Chemistry, 2012, 33: 55-67.
[7]DONNERMAIR M M, BLATCHLEY E R. Disinfection efficacy of organic chloramines[J].Water Research, 2003,37(7): 1557-1570.
[8]汪雪娇. 氯胺消毒特性及其副产物的生成研究[D]. 上海: 同济大学环境科学与工程学院,2008: 39-41.
WANG Xuejiao. Study on characteristics of chloramoine disinfection and byproducts formation[D]. Shanghai: College of Environmental Science and Engineering,Tongji University, 2008:39-41. (In Chinese)
[9]MAESTRE J P, WAHMAN D G, SPEITEL G E. Monochloramine cometabolism by Nitrosomonas europaea under drinking water conditions[J].Water Research, 2013, 47(13): 4701-4709.
[10]张永吉,曾果,周玲玲,等. 氯胺在管网中水相衰减影响因素研究[J]. 北京工业大学学报,2012,38(2):282-287.
ZHANG Yongji, ZENG Guo, ZHOU Lingling, et al. Influence factors of chloramine decay in bulk water[J].Journal of Beijing University of Technology, 2012, 38(2):282-287. (In Chinese)
[11]SOLTERMANN F, WIDLER T, CANONICA S, et al. Photolysis of inorganic chloramines and efficiency of trichloramine abatement by UV treatment of swimming pool water[J]. Water Research, 2014, 56: 280-291.
[12]国家环境保护总局. 水与废水监测分析方法[M].4版. 北京: 中国环境科学出版社,2006:177-179.
State Environmental Protection Administration. Water and wastewater monitoring analysis method [M]. 4 ed. Beijing: China Environmental Science Press, 2006:177-179.(In Chinese)
[13]HAND V C, MARGERUM D W. Kinetics and mechanisms of the decomposition of dichloramine in aqueous solution[J].Inorganic Chemistry, 1983, 22(10): 1449-1456.
[14]VIKESLAND P J, OZEKIN K, VALENTINE R L. Effect of natural organic matter on monochloramine decomposition: pathway elucidation through the use of mass and redox balances[J].Environmental Science & Technology, 1998, 32(10): 1409-1416.
[15]ROSSMAN L A. The effect of advanced treatment on chlorine decay in metallic pipes[J]. Water Research, 2006, 40(13): 2493-2502.

