不同价态阳离子盐改性沸石吸附氨氮能力差异
刘泉利 林海 董颖博 贺银海

摘要:采用5种不同价态阳离子盐对天然斜发沸石进行改性,通过SEM,EDS,ICP以及氮吸附分析仪等测试手段对改性前后的沸石颗粒进行表征,发现不同价态阳离子和相同价态不同阳离子的盐改性沸石后对其物化性质和应用性能均会产生影响.EDS及ICP测试发现由于离子交换作用改性后沸石中5种盐对应的金属阳离子含量均会升高,其中KCl改性沸石中钾元素含量增加量最多.比表面积与孔径分布测试结果发现随着阳离子价态升高,沸石比表面积下降幅度逐渐增大,其中一价钾盐的改性沸石比表面积下降幅度最小为33.9 m2/g,三价铝盐下降幅度最大为29.27 m2/g;而改性沸石孔体积变化规律有所不同,其中一价盐改性沸石介孔体积增加量最大、大孔体积减少量最多.对不同价态阳离子盐改性沸石进行了阳离子交换容量和污水脱氮能力测试,结果表明,其阳离子交换容量和脱氮能力大小排序为:NaCl>AlCl3>CaCl2>MgCl2>KCl.说明改性沸石的污水脱氮能力与其阳离子交换容量呈正相关关系,但是阳离子价态的高低与改性沸石的阳离子交换容量、比表面积、孔体积和脱氮能力并不是正相关关系.
关键词:沸石;盐改性;阳离子价态;阳离子交换容量;氨氮吸附
中图分类号:X703 文献标识码:A
沸石是一种分布较多的天然矿物,因其特殊的单斜晶体结构,具有特异性吸附作用,已被广泛应用到水处理领域.天然沸石形成时由于受地质条件及环境条件的影响,孔道分布不均匀且相互不连通,孔道含杂质也较多.为了提高其吸附水中氨氮等污染物的能力,目前常用的沸石改性方法有焙烧改性、微波改性、碱改性、酸改性、盐改性、稀土改性和表面活性剂改性等[1].
盐改性对提高沸石的氨氮吸附能力优于其他改性方法,国内外许多研究者对盐改性进行了系统的研究.Huo等[2]发现,沸石经2%的NaCl改性2 h后,再经0.4% FeCl3改性1 h,将复合改性后的沸石在200 °C下焙烧1 h,其氨氮去除率可达98.46%,氨氮的吸附过程满足Elovich吸附动力学方程,符合Langmuir吸附等温模型.江乐勇等[3]用质量分数为5.66%的NaCl改性沸石时,氨氮去除率为77.46%,较原沸石提高了24.17%;同时发现盐改性后的沸石进行焙烧复合改性,焙烧温度500 ℃,焙烧0.5 h,氨氮的去除率可以达到84.87%.
常规的盐改性研究主要集中在描述一种盐对沸石的改性作用,包括改性的最佳条件、改性后沸石对氨氮的吸附特征、改性及吸附机理,但是对于不同价态阳离子盐改性沸石的差异和结果分析研究未见报道.本文挑选了5种较常用、阳离子价态不同的盐对沸石进行改性,考察了5种盐改性对沸石形貌、孔道特征、阳离子交换容量、氨氮吸附能力的影响,并分析不同物理化学特征变化对沸石氨氮吸附能力的影响程度,研究成果对于盐改性非金属矿物制备环境材料具有一定的指导意义.
1试验材料与方法
1.1盐改性沸石的制备方法
选取阳离子为不同价态的盐(NaCl,MgCl2,CaCl2,KCl,AlCl3)分别配制浓度为3.0 mol/L的溶液200 mL于锥形瓶中,加入6 g沸石,放入全温振荡培养箱中,在200 r/min,25 ℃条件下振荡12 h,用0.45 μm滤膜过滤并用蒸馏水冲洗沸石至滤液为中性,低温烘干得到盐改性沸石,并做2组平行样,将改性后样品进行混合.
1.2测试及表征方法
配制6 mg/L的氨氮水样200 mL于250 mL锥形瓶中,分别投入0.4 g天然沸石和改性沸石,放入全温振荡培养箱中,在25 ℃,200 r/min条件下搅拌4 h,用0.45 μm滤膜过滤并通过纳氏分光光度法测试氨氮剩余浓度.采用甲醛法测定阳离子交换容量[4].氨氮吸附实验与阳离子交换容量实验均为一式三份.
采用日本产JSM6510A型扫描电镜观察改性沸石前后形貌变化,通过EDS能谱分析改性沸石化学元素成分变化,采用ICPOES测试改性溶液中剩余离子浓度,采用金埃谱VSorb 4800P氮吸附分析仪对改性沸石比表面积及孔径特征进行分析测定.
2结果与讨论
2.1不同价态阳离子盐改性前、后沸石的SEM测试
5种不同的盐改性沸石的形貌变化如图1所示.由图1可知,不同盐改性沸石形貌特征相互间存在差异,但均出现不同程度的沟壑与碎片,并增加了沸石表面细小孔洞数量.天然沸石与NaCl改性沸石孔道堵塞较严重,而其它几种盐改性后的沸石表面变得比较松软,孔结构更加明显,结合氨氮测试结果发现与孔道和比表面积关系较大的静电吸附作用不是增强改性沸石吸附氨氮能力的主导作用,这与Katal等[5]、林建伟等[6]的研究结果较一致,沸石对氨氮的吸附作用以离子交换为主,且钠离子的作用比较明显[7].同时发现不同价态阳离子盐改性后,沸石的形貌变化与阳离子的价态关系不大,而与阳离子盐的种类有关.
2.2不同价态阳离子盐改性对沸石组份的影响分析
表1为盐改性前后沸石的EDS面分布测试结果,表2为采用ICPOES测试不同盐改性后残留在溶液中的离子浓度.结果表明,5种不同阳离子价态盐改性后沸石的化学成分会发生不同程度的变化,其对应的金属阳离子含量会升高,而硅元素的含量几乎不变,KCl改性沸石中的钾元素质量分数由1.39%增加到3.33%,变化程度最大.NaCl改性后,钠元素的含量增加也较多,质量分数由0.86%增加到1.72%.MgCl2,CaCl2,AlCl3改性后对应阳离子的质量分数分别增加了0.41%,0.52%和0.38%.Ca2+,Mg2+和Al3+对沸石中K+,Na+的置换能力较弱,因此K盐和Na盐改性沸石,除Mg元素外,所有金属元素含量均会下降,Na,K元素含量上升,而Ca,Mg和Al盐改性时,Na,K元素含量下降较小[6].表明5种盐改性时其金属阳离子会与沸石中的金属阳离子发生离子交换作用,这与ICPOES测试结果一致.
ICPOES测试结果可以看出5种盐改性后溶液中几乎没有Al,Si元素,K,Na元素增加最多,Ca元素也有一定量的增加,Mg元素增加量较少,这与EDS结果较一致.Mg元素虽然为二价离子,价态低于Al元素,但溶液中离子浓度增加较少是因为Mg2+半径(0.78 )比K+(1.33 ),Na+(0.95 )和Ca2+(1.05 )半径都小,进入沸石孔道更为容易,同时含量较低,对其交换作用不明显,因此其它盐改性时Mg元素含量变化较小,溶液中增加的也较少,这也表明沸石中Mg2+活性较差,很难与溶液中半径大的离子进行交换[8].
5种盐改性后,沸石中金属阳离子含量的变化及溶液中离子浓度的变化与斜发沸石优先交换的离子顺序为[9]: K+>NH4+> Na+>Ca2+ >Al3+ > Mg2+呈正相关关系.说明溶液中增加的离子浓度,是通过盐改性时的离子交换作用产生的.一价阳离子盐NaCl与KCl改性后,溶液中增加的离子浓度最多.这是因为K元素与Na元素排在斜发沸石优先交换离子顺序的最前面且均为一价离子,KCl与NaCl改性最易交换出沸石中的其它金属阳离子,使改性溶液中相应的金属阳离子浓度增加.结果还可以发现,沸石中K元素最易被其它阳离子交换出来,因此非钾盐改性溶液中K离子浓度增加最多.阳离子价态越低越易被交换,但盐改性对沸石中离子的交换作用还受其它因素的影响,包括离子半径与活性等因素.
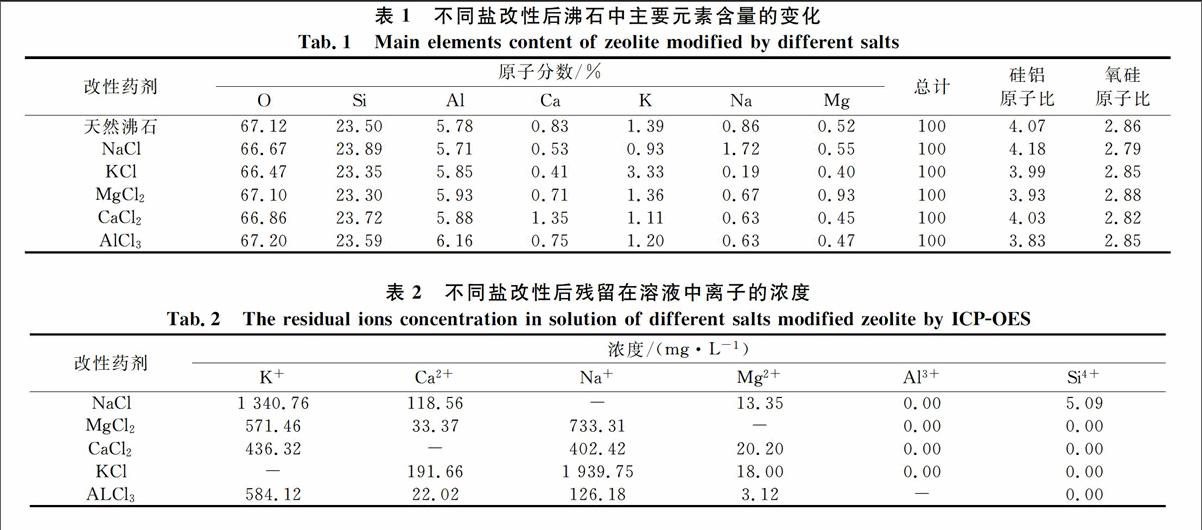
2.3盐改性对沸石孔道特征的影响
图2为盐改性沸石比表面积变化结果,可以发现,沸石经盐改性后比表面积均会小幅下降,其中一价的阳离子盐KCl改性沸石下降幅度最小,为33.9 m2/g;三价的阳离子盐AlCl3改性沸石下降幅度最大,为29.27 m2/g.结合EDS结果,5种盐改性后其对应的金属阳离子含量会增加,表明盐中的金属阳离子与沸石中的元素可能会发生离子交换反应.K+与骨架氧的作用力较弱,所以吸附进入沸石孔道的K+也较少,因此其比表面积下降幅度较其它盐改性沸石小;而AlCl3改性时,Al3+进入沸石取代沸石四面体硅的位置,Al-O键(1.75 )比Si-O(1.60 )长,导致晶胞扩张,部分孔道联通,大孔增加[10-11],这可能是导致沸石比表面积下降的原因.
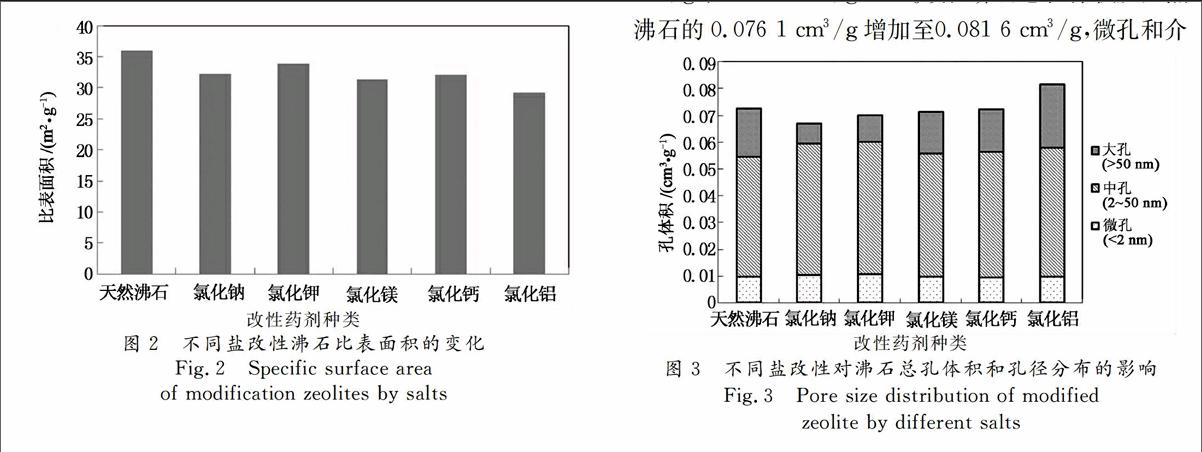
盐改性沸石总孔体积和孔径分布变化如图3所示.结果发现,除三价盐AlCl3改性沸石外,其它盐改性沸石微孔变化较小,介孔增加,大孔减少,总孔体积小幅降低.其中一价盐NaCl和KCl改性沸石孔径分布变化较为明显,NaCl,KCl改性沸石介孔体积分别从天然沸石的0.044 9 cm3/g增加至0.050 1 cm3/g,0.049 4 cm3/g;大孔体积从天然沸石的0.017 9 cm3/g降至0.007 5 cm3/g,0.009 8 cm3/g.这是因为EDS,ICPOES结果发现NaCl,KCl改性后沸石中及改性溶液中阳离子含量的变化最大.Na元素与K元素可交换沸石中较大的阳离子,并进入骨架中,引起介孔增加.MgCl2和CaCl2改性沸石介孔与大孔体积变化幅度较小,介孔体积分别为0.046 2 cm3/g,0.046 8 cm3/g;大孔体积为0.155 cm3/g和0.160 cm3/g.AlCl3改性沸石总孔体积从天然沸石的0.076 1 cm3/g增加至0.081 6 cm3/g,微孔和介改性药剂种类
孔体积变化较小,大孔体积增加至0.023 7 cm3/g,改性沸石总孔体积的增加主要是因大孔体积增加引起的.
2.4盐改性对沸石阳离子交换容量的影响
沸石的离子交换性能,主要与沸石结构中的硅铝比、沸石孔穴、阳离子的位置有关.盐改性之所以对沸石阳离子交换容量影响明显,一是因为金属阳离子与沸石中的阳离子发生了交换作用,这种交换作用,使部分骨架上阳离子得到活化;二是沸石骨架带负电荷,同时有部分空位未被金属阳离子填补,盐改性会使金属阳离子进入沸石孔道内填补空位,从而使阳离子交换容量上升[12].
不同盐改性对沸石阳离子交换容量的影响如图4所示.可以发现,盐改性后沸石阳离子交换容量均升高,其中NaCl从天然沸石的169.7 mmol/(100 g)提高至192.3 mmol/(100 g),而KCl,MgCl2,CaCl2,AlCl3提高幅度较低,仅提高至179.7 mmol/(100 g),181.2 mmol/(100 g),182.8 mmol/(100 g),186.3 mmol/(100 g).
改性药剂种类
盐所含的金属阳离子的半径和电荷数对沸石化学元素成分和阳离子交换容量影响较大.结合EDS,ICPOES结果发现KCl,NaCl改性可使沸石中的其它金属阳离子大量被交换出来,且交换出来的为二价及三价元素,为了平衡电荷,同时沸石本身为负电性,会有更多的一价阳离子K元素与Na元素进入骨架中.K+的半径为1.33 ,比Na+半径0.95 大,进入骨架占位相对困难,只能占据八元环位置,Na+还可进入沸石骨架中,占据六元环位置,因此Na盐改性沸石阳离子交换容量较K盐改性沸石高,半径较小的Ca2+,Mg2+和Al3+因带二价、三价正电荷进入沸石骨架占位的活性较Na+弱,因此改性阳离子交换容量增加幅度也较Na盐改性沸石小[10,13].表明二价与三价离子活性比一价要弱,Na+扩散阻力最小且性质活泼,所以NaCl改性后沸石的CEC值有大幅提升[14].
2.5盐改性对沸石吸附氨氮性能的影响
盐改性沸石对水中氨氮的吸附效果如图5所示.由图5可知,NaCl改性沸石对水中氨氮的去除效果有大幅提升,去除率分别由天然沸石的53.15%提升至82.17%,吸附量从天然沸石的1.59 mg/g提升至2.47 mg/g;一价盐KCl、二价盐MgCl2、三价盐CaCl2与AlCl3改性沸石对水中氨氮的去除效果也有小幅提升,去除率分别提高至60.49%,63.23%,65.74%,67.56%,吸附量提高至1.81 mg/g,1.90 mg/g,1.97 mg/g,2.03 mg/g,不同价态阳离子盐改性后,吸附氨氮能力差距不大.测试结果发现盐改性会使部分金属阳离子进入沸石,使改性沸石比表面积小幅下降,吸附作用有一定程度减弱.而盐改性后,沸石吸附氨氮的能力增强,这与大家的研究结果较一致,静电吸附不是沸石吸附氨氮的主导作用,离子交换作用是增强沸石吸附氨氮能力增强的主要原因[15].改性沸石吸附氨氮的能力与其阳离子交换作用呈正比.
5种盐改性后沸石吸附氨氮性能均会有一定程度的增强,结合SEM,EDS,ICPOES,比表面积与孔径分布及阳离子交换容量结果发现:扫描电镜结果发现氯化钠改性沸石表面出现较多杂质,孔道有一定堵塞;比表面积与孔径分布结果表明盐改性后沸石的比表面积及总孔体积会有小幅下降;扫描电镜与孔径分布测试结果可证明改性沸石的静电吸附作用是否会增强.而EDS,ICPOES与阳离子交换容量表明5种盐改性沸石的阳离子发生了较大的变化,骨架中金属阳离子减少,溶液中对应的阳离子含量增加,5种盐改性沸石的阳离子交换容量均增加.EDS,ICPOES与阳离子交换容量表征的是改性沸石的离子交换能力.
综上测试结果及改性沸石吸附氨氮能力的差异发现:物理静电吸附作用不是引起改性沸石吸附氨氮能力的主导作用,改性沸石吸附氨氮能力的增强是由离子交换作用引起的[16].同时EDS与ICPOES结果表明盐改性过程中发生了离子交换作用,交换出的离子含量的多少只在一定程度上影响了其吸附氨氮能力的大小,其与阳离子盐的种类有很大的关系.阳离子交换容量与沸石吸附氨氮的能力呈正相关,因此阳离子交换容量可以表征沸石吸附氨氮能力的差异.盐改性沸石的氨氮吸附能力与其阳离子盐的价态无关,与离子的种类有关.
3结论
1)一价阳离子盐KCl改性沸石的比表面积下降幅度最小,为33.9 m2/g;三价阳离子盐AlCl3改性沸石下降幅度最大,为29.27 m2/g.除AlCl3改性沸石外,其它盐改性沸石微孔变化较小,介孔增加,大孔减少,总孔体积小幅降低.其中NaCl和KCl改性沸石孔径分布变化较为明显,MgCl2和CaCl2改性沸石介孔与大孔体积变化幅度较小,AlCl3改性沸石微孔和介孔体积变化较小,大孔体积增加.
2)扫描电镜与孔径分布测试结果表明,物理静电吸附作用不是引起改性沸石吸附氨氮能力的主导作用.改性后沸石中5种盐对应的金属阳离子含量均会升高,KCl改性沸石中K元素升高最多.而其它金属阳离子会有不同程度的下降,ICPOES测试结果与EDS结果较一致.表明盐改性导致盐的阳离子与沸石颗粒本身的阳离子发生了离子交换.
3)改性沸石阳离子交换容量大小排序为NaCl>AlCl3>CaCl2>MgCl2>KCl.盐改性沸石的脱氮能力与其阳离子交换容量的大小呈正相关关系,与改性盐的阳离子价态无关联.NaCl改性后的沸石对氨氮的吸附能力提高最多,由原沸石的53.15%提高到80%以上,其它盐改性后沸石对氨氮的去除率在65%左右.
参考文献
[1]HUANG H, XIAO X, YAN B, et al. Ammonium removal from aqueous solutions by using natural Chinese (Chende) zeolite as adsorbent[J]. Journal of Hazardous Materials, 2010, 175(1): 247-252.
[2]HUO H, LIN H, DONG Y, et al. Ammonianitrogen and phosphates sorption from simulated reclaimed waters by modified clinoptilolite[J]. Journal of Hazardous Materials, 2012, 229/230: 292-297.
[3]林海,江乐勇,赵志英,等. 市政污水厂二级出水深度脱氮除磷吸附材料[J]. 北京科技大学学报, 2009, 31(5): 551-556.
LIN Hai,JIANG Leyong,ZHAO Zhiying,et al. Adsorption materials of nitrate and phosphate removal in secondary effluent advanced treatment[J]. Journal of University of Science and Technology Beijing, 2009, 31(5): 551-556. (In Chinese)
[4]DU Y J, WANG J, QIU M Q. Research of decontamination ammonia nitrogen from the tiny polluted water by modified zeolite[J]. Advanced Materials Research, 2013, 671: 2670-2673.
[5]KATAL R, BAEI M S, RAHMATI H T, et al. Kinetic, isotherm and thermodynamic study of nitrate adsorption from aqueous solution using modified rice husk[J]. Journal of Industrial and Engineering Chemistry, 2012, 18(1): 295-302.
[6]林建伟,詹艳慧,陆霞. 锆改性沸石对水中磷酸盐和铵的吸附特性[J]. 中国环境科学, 2012, 32(11): 2023-2031.
LIN Jianwei,ZHAN Yanhui,LU Xia. Adsorption of phosphate and ammonium from aqueous solution on zirconium modified zeolite[J]. China Environmental Science, 2012, 32(11): 2023-2031. (In Chinese)
[7]林海,郑倩倩,董颖博,等. SDS对焙烧沸石物化性质和除氨氮效果的影响[J]. 湖南大学学报: 自然科学版, 2014, 41(12): 89-95.
LIN Hai,ZHENG Qianqian, DONG Yingbo, et al. Effect of modification by SDS on roastingassisted[J]. Journal of Hunan University: Natural Sciences, 2014,41(12):89-95. (In Chinese)
[8]WEN J. Synthesis of small crystal NaY zeolite by dynamic crystallization methods[J]. Journal of Natural Science of Hunan Normal University, 2012, 35(6): 62-66.
[9]汤泉,陈南春. 天然沸石改性方法的研究进展[J]. 材料导报, 2009, 23(14): 439-441.
TANG Quan,CHEN Nanchun. Progress in research on natural zeolite modified methods[J]. Materials Review, 2009, 23(14): 439-441. (In Chinese)
[10]LI X, LI B, XU J. Synthesis and characterization of transitional metalrich zeolite MMFI (M=Fe, Co, Ni, Cu) with regular mesoporous channels[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, 434:287-295.
[11]宋科,管景奇,吴淑杰,等. 以微孔沸石MCM49和MCM56为硅铝源合成强酸性介孔分子筛[J]. 高等学校化学学报, 2009,30(2): 344-348.
SONG Ke,GUAN Jingqi,WU Shujie,et al. Synthesis of mesoporous alum inosilicates with enhanced acidity from zeolites MCM56 and MCM49 [J]. Chemical Journal of Chinese Universities, 2009, 30(2): 344-348.
[12]TIAN J, GUAN J, YAN C, et al. Study on treatment of ammonia nitrogen waste water by zeolitegranuleadsorbent[J]. Advanced Materials Research, 2013, 668: 211-215.
[13]KAMARUDIN N H N, JALIL A A, TRIWAHYONO S, et al. Interaction of Zn2+ with extraframework aluminum in HBEA zeolite and its role in enhancing npentane isomerization[J]. Applied Catalysis A: General, 2012, 431(432):104-112.
[14]LIU C, GU W, KONG D, et al. The significant effects of the alkalimetal cations on ZSM5 zeolite synthesis: From mechanism to morphology[J]. Microporous and Mesoporous Materials, 2014, 183:30-36.
[15]WANG W, WANG W, ZHOU Y. Adsorption characteristics of natural zeolite on ammonia nitrogen[J].Advanced Materials, 2012: 599:501-504.
[16]WEI Y X, YE Z F, WANG Y L, et al. Enhanced ammonia nitrogen removal using consistent ammonium exchange of modifiedzeolite and biological regeneration in a sequencing batch reactor process[J]. Environ Technol, 2011, 32(11/12): 1337-1343.

