HDAC6和Ac-α-Tub在肺腺癌中表达的临床病理意义
张晕生 宋旭东
HDAC6和Ac-α-Tub在肺腺癌中表达的临床病理意义
张晕生 宋旭东
目的 研究组蛋白去乙酰化酶(HDAC)6和乙酰化微管蛋白α(Ac-α-Tub)在非小细胞肺癌(NSCLC)中的表达及其临床病理学意义。方法 收集2013-06—2015-06期间在秦皇岛市肿瘤医院手术切除并经临床病理证实的NSCLC标本52例,以同例患者癌旁肺组织作为对照组。免疫组织化学染色法和免疫印迹法检测HDAC6和Ac-α-Tub在NSCLC及对照组中的表达,分析其与临床病理参数(性别、年龄、吸烟史、肿瘤大小、组织学类型、分化程度、淋巴结转移和临床病理分期)的关系。结果 在癌旁组中HDAC6阳性表达率为5.77%,显著低于NSCLC组的76.92%,且NSCLC组HDAC6蛋白表达水平为对照组的6倍,而Ac-α-Tub在NSCLC组织中和阳性表达率显著低于癌旁组,其在NSCLC组织中的表达水平为癌旁的31.03%,差异均具有统计学意义(P<0.05)。NSCLC组中HDAC6的阳性表达与分化程度、临床分期和淋巴结转移关系密切;Ac-α-Tub的阳性表达与分化程度和淋巴结转移关系密切。且HDAC6在NSCLC组中的表达与Ac-α-Tub的表达呈负相关。结论HDAC6在NSCLC中高表达,而α-Ac-Tub蛋白表达下调,与肿瘤的侵袭和转移关系密切,二者可能在NSCLC的发生、发展中起到了关键的调节作用。
肺癌;组蛋白去乙酰化酶;乙酰化微管蛋白
非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的恶性肿瘤,其发病率和死亡率居恶性肿瘤的第一位,然而70%以上患者确诊时已经失去了手术机会,即使辅以放、化疗等多种综合治疗手段,仍然不能显著提高肺癌的生存率[1]。因此,寻找NSCLC早期诊断标志物及靶向治疗位点一直是肿瘤研究领域的难点和热点问题。
作为Ⅱb类组蛋白去乙酰化酶(histone deacetylases,HDAC)的代表,HDAC6与肿瘤发生、发展关系密切。有研究显示,HDAC6的缺失表达能够促进顺铂诱导的NSCLC细胞DNA损伤和凋亡,减少裸鼠体内移植瘤的体积,而高表达HDAC6则增加了瘤体对顺铂的耐药性[2]。在其他肿瘤中也发现,HDAC6与微管蛋白 (tubulin,Tub)的去乙酰化(acetylation,Ac)、泛素化失衡和氧化应激关系密切,在卵巢癌、乳腺癌和食管癌、胃癌的发生发展中起到了重要的调控作用[3-4]。因此,本研究拟通过分析HDAC6和Ac-α-Tub在NSCLC中的表达及其临床病理学意义,探讨HDAC6对NSCLC的影响,为NSCLC基因治疗中靶点的选择提供一定的理论和实验依据。
1 材料与方法
1.1 临床资料 收集2013-06—2015-06期间在秦皇岛市第四医院(肿瘤医院)手术切除并经临床病理证实的NSCLC标本52例。所有患者临床资料完整,均为肺癌原发病灶,无其他肿瘤病史;术前均未接受放、化疗治疗;无肝炎、肝硬化、自身免疫性疾病或其他严重的基础疾病。以肿瘤组织石蜡标本作为实验组,并挑选同例患者的癌旁肺组织石蜡标本作为对照组(距离肿瘤>5 cm,镜下无癌细胞浸润及转移),所有标本采用10%福尔马林固定,石蜡包埋,4 μm切片,由病理科诊断、存档并提供。
1.2 实验试剂 HDAC6(ab1440)购置于美国abcam公司;Ac-α-Tub(sc-23950)购置于美国santa cruz公司;免疫组化试剂盒(PV-6000)、DAB显色液(ZLI-9018)购置于北京中杉金桥生物技术有限公司;免疫印迹二抗(074-1506/074-1806)购置于英国KPL公司。
1.3 免疫组化法检测HDAC6和Ac-α-Tub在肺癌和癌旁组织中的定位和表达 按照北京中杉PV6000免疫组化试剂盒说明书进行,石蜡切片常规脱蜡至水,高压修复及H2O2去除内源性过氧化物酶后,加一抗(1∶200稀释)4℃过夜,次日滴加二抗37℃孵育30 min,DAB显色,苏木素复染,脱水、透明中性树胶封片。高倍视野下随机选取5个视野,每个视野计数100个肿瘤细胞,计算阳性细胞百分比,按照以下4级进行计分,0分:阳性细胞数<10%;1分:10%~25%;2分:26%~50%;3分:51%~75%;4分:>75%。染色强度评分标准:无色0分,淡黄色1分,棕黄色2分,棕色或棕褐色3分。以两者乘积作为阳性评判标准,其中4分以上定义为阳性。采用PBS替代一抗作为阴性对照。
1.4 Western blot法检测HDAC6和Ac-α-Tub在肺癌和癌旁组织中的表达 常规提取组织蛋白,经考马斯亮蓝法测定蛋白浓度后上样(20 μg/泳道),常规电泳和电转。孵育一抗(1∶500)4℃过夜,二抗(1∶5 000)37℃ 1 h后,ECL发光显色,采用Image-Lab 5.1软件定量分析条带。
1.5 统计学处理 用Excel建库,SPSS 13.0进行统计分析。定性资料比较采用χ2检验,定量资料采用方差分析,相关性分析采用Spearman相关系数法,以P<0.05表示差异具有统计学意义。
2 结果
2.1 HDAC6和Ac-α-Tub在NSCLC中的表达 免疫组化结果显示,在肺癌组织中HDAC6阳性表达于肿瘤细胞,主要定位于细胞浆,偶见孤立的单个肿瘤细胞核内阳性表达。其在肿瘤组织中的阳性表达率为76.92%(40/52),而在癌旁组织中阳性表达率为5.77%(3/52),两者相比差异具有统计学意义(表1,图1)。而无论在癌旁组还是在肿瘤样本中,部分支气管上皮细胞可见阳性表达,不计为阳性结果。Ac-α-Tub在腺癌和癌旁组织均强表达于支气管上皮细胞。且在癌旁肺组织中,还可表达于多种细胞类型,包括肺泡上皮细胞、内皮细胞和间质成纤维细胞,在癌旁组织其阳性表达率为80.77%;而在癌组织中其阳性表达率为26.92%,两者相比差异具有统计学意义(χ2=30.333,P=0.000,表2,图2)。免疫印迹法检测结果显示,在52例NSCLC临床样本中,HDAC6的表达量为对照组的6倍,而Ac-α-Tub表达为对照组的31.03%(表3,图3)。
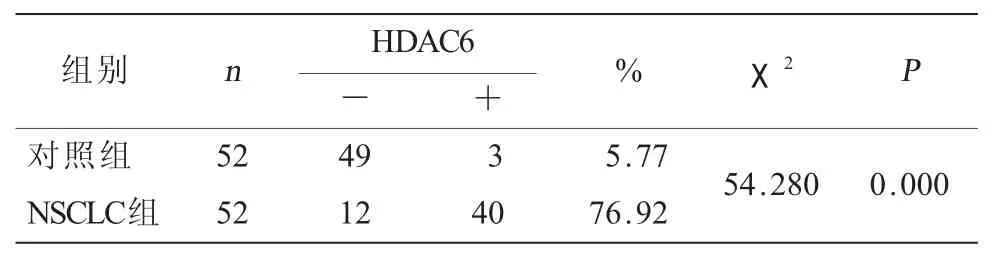
表1 HDAC6在对照组及NSCLC组中的表达
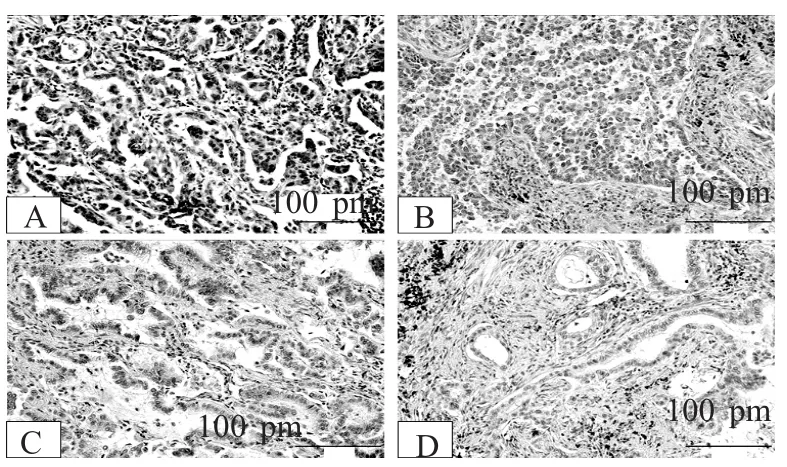
图1 HDAC6在NSCLC中的阳性表达

表2 Ac-α-Tub在对照组及NSCLC组中的表达
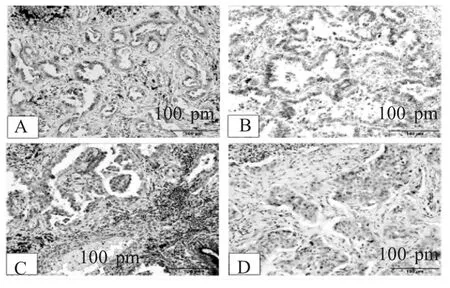
图2 Ac-α-Tub在NSCLC中的弱阳性表达
表3 HDAC6和Ac-α-Tub在对照组和NSCLC组蛋白表达量(免疫印迹法,±s)
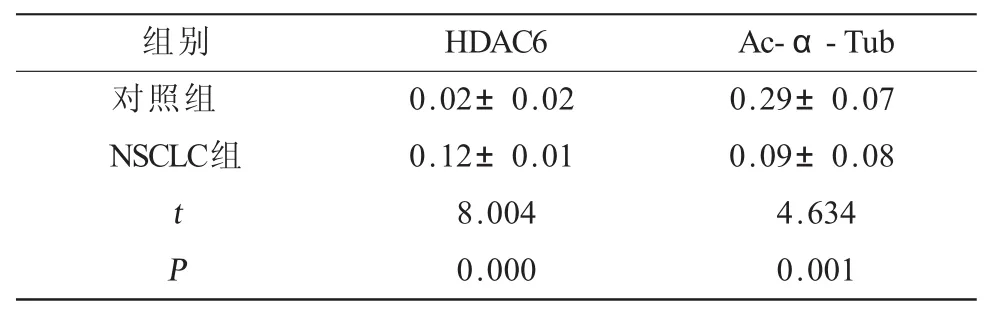
表3 HDAC6和Ac-α-Tub在对照组和NSCLC组蛋白表达量(免疫印迹法,±s)
组别 HDAC6 Ac-α-Tub对照组 0.02±0.02 0.29±0.07 NSCLC组 0.12±0.01 0.09±0.08t8.004 4.634P0.000 0.001
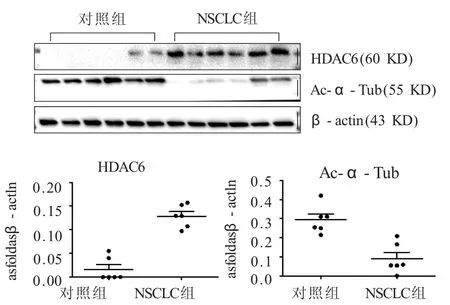
图3 HDAC6和Ac-α-Tub在对照组和肺癌组蛋白水平的表达(免疫印迹法)
2.2 HDAC6和Ac-α-Tub在NSCLC中表达与临床病理特征的关系 χ2检验结果显示,HDAC6在NSCLC中阳性表达情况与性别、年龄、吸烟史、瘤体大小、肿瘤类型无关,而在分化程度、淋巴结转移和病理分期方面有统计学意义,两组相比差异有统计学意义(P<0.05)。而Ac-α-Tub在NSCLC中的阳性表达与分化程度和淋巴结转移有关(P<0.05),而在性别、年龄、吸烟史、瘤体大小、肿瘤类型和病理分期方面差异无统计学意义(表4)。在52例NSCLC临床样本中,HDAC6与Ac-α-Tub阳性共表达4例,二者在NSCLC中呈负相关(r=-0.697,P=0.000)。
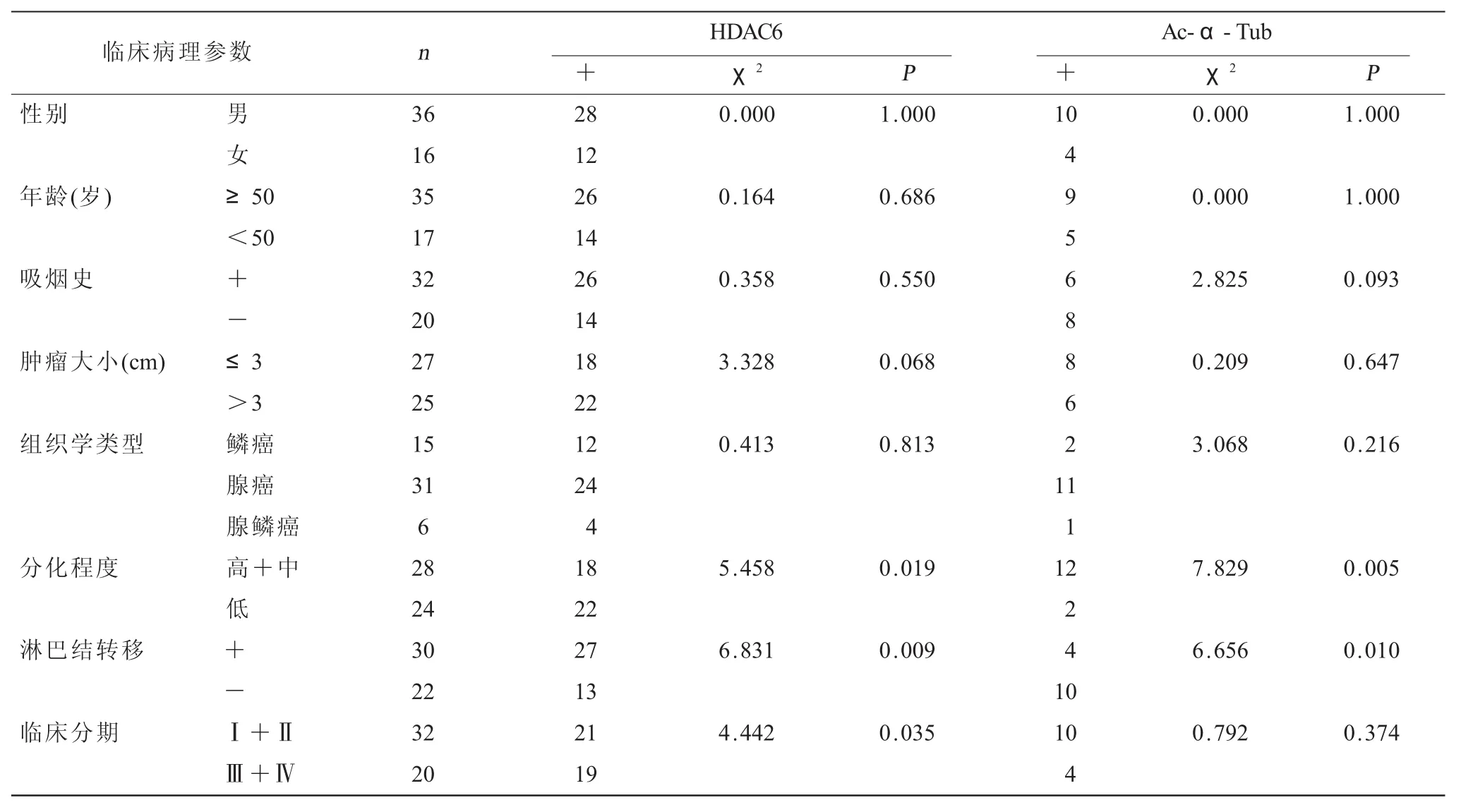
表4 HDAC6和Ac-α-Tub在NSCLC中表达的临床病理意义
3 讨论
中国三次恶性肿瘤抽样回顾性调查数据显示,肺癌死亡率逐年攀升,由20世纪70年代的第4位上升至现在的第1位[5]。
近些年研究发现,HDAC6在多种实体瘤中高表达,且对肿瘤的发生、发展发挥双向调控作用,其差异取决于HDAC6在细胞中的定位。在乳腺癌临床样本中发现,HDAC6在一些较为正常的上皮细胞呈胞核表达,而在大部分肿瘤细胞中呈胞浆表达[6]。本研究也发现52例NSCLC患者样本中,76.92%患者肿瘤细胞胞浆阳性表达HDAC6,偶见细胞核表达。HDAC6在核内能够去乙酰化NF-κB的p65亚基,减少其与基质金属蛋白酶(matrix metallo preteinases,MMP)2启动子的结合,导致MMP2表达下调,因此影响肿瘤细胞的侵袭能力。体外研究也发现,胞浆内过表达HDAC6能够显著促进A549和H661细胞的侵袭和迁移,然而在核内表达的HDAC6则反过来能够抑制细胞侵袭(对迁移无明显的抑制作用)[7]。这说明,HDAC6在多数研究认为,其在核中表达多提示预后良好,而在胞浆中阳性表达则能够促进肿瘤的发生、发展。由于胞核内HDAC6阳性表达较少,且在同一样本中多以胞浆阳性表达为主,因此本研究并未进一步探讨HDAC6在细胞浆/核中的差异表达与临床病理之间的关系。发现HDAC6阳性表达率与NSCLC分化程度、临床分期和淋巴结转移关系密切。
微管蛋白α(α-Tub)是细胞骨架蛋白之一,广泛参与维持细胞结构和功能的稳定。有研究报道了α-Tub与乳腺癌、胃癌、直肠癌和前列腺癌中高表达与肿瘤的侵袭、转移关系密切,且微管动力学的破坏和异常有丝分裂能够导致紫杉醇耐药,同时微管的异常也能导致细胞间信息传递异常,引起黏附能力下降,而侵袭性伪足与微管的伸长有关[3-4]。诸多研究显示,HDAC6能够通过对α-Tub乙酰化的调节,影响肿瘤细胞的增殖和迁移。在转化生长因子(transforming growth factor,TGF)-β1诱导的肺泡Ⅱ型上皮A549细胞[8]和人肺成纤维细胞中均发现HDAC6表达上调和Ac-α-Tub表达下调,并伴随上皮-间质转化(epithelial-mesenchymal transition,EMT)能够诱导促进Ac-α-Tub去乙酰化,从而诱导EMT的形成[9-10]。从α-Tub的乙酰化修饰来讲,HDAC6抑制剂已经被证明是治疗肿瘤的一个新的靶点。本研究结果显示,Ac-α-Tub主要阳性表达于癌旁组织,而在癌组织中多缺失表达,Ac-α-Tub与HDAC6的表达呈负相关,其缺失表达与肿瘤分化程度、淋巴结转移相关(P<0.05)。提示α-Ac-Tub在NSCLC中的缺失表达可能在肺癌的发生、发展具有一定的调节作用,其表达缺失可能与HDAC6的负调控有关,具体机制仍待进一步研究和探讨。
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):359-386.
[2]Lei W,Shengyan X,Williams KA,et al.Depletion of HDAC6 enhances cisplatin-induced DNA damage and apoptosis in non-small cell lung cancer cells[J].Plos One,2012,7(9):e44265.
[3]顾洪丰.微管与肿瘤关系研究进展[J].中医药研究,2001,17(5):56-57.
[4]彭琦,李君君,张济,等.α-微管蛋白与肿瘤的研究[J].中华临床医师,2013,7(20):9315-9316.
[5]刘永军,杨婵婵.我国肺癌流行趋势及疾病负担概况[J].现代商贸工业,2016,2(2):212-214.
[6]Zhenhuan Z,Hiroko Y,Tatsuya T,et al.HDAC6 expression is correlated with better survival in breast cancer[J].Clinical Cancer Research An Official Journal of the American Association for Cancer Research,2004,10(20):6962-6968.
[7]Chih-Jen Y,Yu-Peng L,Hong-Ying D,et al.Nuclear HDAC6 inhibits invasion by suppressing NF-κB/MMP2 and is inversely correlated with metastasis of non-small cell lung cance[J].Oncotarget,2015,6(30):30263-30276.
[8]Shan B,Yao TP,Nguyen HT,et al.Requirement of HDAC6 for transforming growth factor-beta1-induced epithelial-mesenchymal transition[J].J Biol Chem,2008,283(30):21065-21073.
[9]Wang Z,Chen C,FingerSN,etal.Suberoylanilide hydroxamic acid:a potentialepigenetic therapeutic agentforlung fibrosis[J].Eur Respir J,2009,34(1):145-155.
[10]Hashimoto-Komatsu A,Hirase T,Asaka M,et al.AngiotensinⅡinduces microtubule reorganization mediated by a deacetylase SIRT2 in endothelial cells[J].Hypertens Res,2011,34(8):949-956.
Objective To study the expression of HDAC6 and Ac-α-Tub and the clinic pathological significance in non-small cell lung cancer(NSCLC).Methods 52 cases confirmed with NSCLC with clinic pathology after surgical resection at Qinhuangdao Tumor Hospital from June 2013 to June 2016 were collected for samples,and adjacent cancer lung tissues of the same sufferers were taken as control group.Immunohistochemical staining and immunoblotting were adopted to detect HDAC6 and Ac-α-Tub expression in NSCLC group and control group and its relationship with clinicopathological parameters(sex,age,smoking history,tumor size,histological type,differentiated degree,lymphatic metastasis and clinicopathological stage)was analyzed.Results The positive expression rate of HDAC6 in adjacent cancer group was 5.77%,lower than 76.92%in NSCLC group,and HDAC6 protein expression level in NSCLC group was six times of that in adjacent cancer group,while Ac-α-Tub and its positive expression rate in NSCLC group were clearly lower than those in adjacent cancer group,among which the positive expression rate in NSCLC group was 31.03%of that in adjacent cancer group,with differences of statistical significance(P<0.05).The HDAC6 positive expression in NSCLC group was closely related to differentiated degree,clinical stages,and lymphatic metastasis.The Ac-α-Tub positive expression was closely related to differentiated degree and lymphatic metastasis.The HDAC6 expression in NSCLC group was negatively related to Ac-α-Tub expression.Conclusion The high HDAC6 expression in NSCLC group and down-regulated expression of α-Ac-Tub protein were closely related to tumor invasion and metastasis,both can have critical regulating effects in the occurrence and development of NSCLC.
Lung cancer;HDAC;Acetylated tubulin
2016-05-20)
1005-619X(2016)09-0903-04
10.13517/j.cnki.ccm.2016.09.003
063000 华北理工大学基础医学院
——水芹主要害虫识别与为害症状

