千里光脂肪酸脱氢酶(D6D)的保守基序(CSM)与功能结构域分析
王蕾++罗才林++徐德林+钱刚


摘要:Δ6-脂肪酸脱氢酶(Δ6 desaturase,D6D)是不饱和脂肪酸合成途径中的限速酶。以高等植物千里光为材料,通过构建全长cDNA文库克隆得到脂肪酸脱氢酶基因(D6D),明确了D6D基因的氨基酸保守基元序列(conserved sequence motif,CSM)对蛋白质功能结构域的决定作用。结果显示,千里光D6D基因由466个氨基酸残基组成;预测蛋白分子量为53.40 ku,理论等电点为8.48;进化树和序列比对结果提示3个富含His的保守基元序列(HisⅠ-片段、HisⅡ-片段、HisⅢ-片段)在不同物种中表现出高度保守性;三维结构预测结果表明,D6D基因的保守结构域以及一个类似于细胞色素(cytochrome,cyt)b5的血红素结合区是形成底物结合部位和酶催化活性中心的结构基础。
关键词:千里光;脂肪酸脱氢酶(D6D基因);保守基元序列(CSM);三维结构
中图分类号: S567.23+9.01文献标志码: A文章编号:1002-1302(2016)06-0073-05
收稿日期:2015-11-03
基金项目:国家自然科学基金(31560087);贵州省优秀科技教育人才省长基金(编号:黔省专合字2008-61号)。
作者简介:王蕾(1991—),女,黑龙江五大连池人,硕士研究生,主要从事药用植物分子遗传学研究。E-mail:1807840035@qq.com。
通信作者:钱刚,博士,教授,主要从事药用植物分子遗传学研究。E-mail:pengjiaqiong@163.com。脂肪酸脱氢酶是多不饱和脂肪酸合成途径中的关键酶,分为可溶性脱氢酶和膜结合脱氢酶,其中膜结合脱氢酶又可分为羧基定向的脂肪酸脱氢酶(“frond-end”脱氢酶)和甲基定向的脂肪酸脱氢酶[1]。脂肪酸脱氢酶结构上都有3个保守的组氨酸富集区,除此之外羧基定向的脱氢酶N端还有1个类似于细胞色素b5 Cytb5的血红素结合区(HPGG)[2-3]。
Δ6-脂肪酸脱氢酶(D6D)属于羧基定向的膜结合脱氢酶,它以NADH、细胞色素b5氧化还原酶和细胞色素b5作为电子供体催化甘油脂中的脂肪酸脱氢[4]。Δ6-脂肪酸脱氢酶具有催化亚油酸、α-亚麻酸分别脱氢形成γ亚麻酸和十八碳四烯酸的功能[5]。
千里光(Senecio scandens Buch.-Ham. ex D. DO)为菊科(Compositae),属多年生草本植物,它是中国传统中药之一,具有清热解毒、明目、杀虫、保肝、凉血、驱风除湿、抗菌、抗钩端螺旋体等诸多功效[6-7]。迄今为止,已经从蓝细菌[8]、黑茶藨子[9]、深黄被孢菌[10]、高山被孢菌[11]、月见草[12]、假狼紫草[13]、雅致枝霉[14]、卷枝毛霉[15]、少根根霉[16]中克隆到Δ6-脂肪酸脱氢酶。尽管Δ6-脂肪酸脱氢酶基因在微生物和植物等不同物种中已有报道[1],目前,关于D6D基因高级结构和功能关系的研究尚少,该基因在菊科植物的相关研究也未见报道。本研究率先开展药用植物千里光Δ6-脂肪酸脱氢酶基因的功能研究,分析了该蛋白理化性质和保守基序对功能结构域的决定作用,为深入了解高等植物多不饱和脂肪酸(PUFAs)合成的次生代谢途径和蛋白质组学研究提供依据。
1材料与方法
1.1材料
试验材料千里光资源(SC-36)系笔者所在课题组采自贵州省遵义地区野生种。
1.2方法
1.2.1千里光全长cDNA 文库的构建按照RNA提取试剂盒说明提取千里光叶片组织的总RNA,采用SMART方法构建了千里光的全长cDNA文库[17],随机挑选阳性克隆进行测序(华大基因)。
1.2.2D6D基因生物信息学的分析依据测序结果,通过NCBI(http://blast.ncbi.nlm.nih.gov/Blast)的BLAST进行核苷酸序列比对,并利用ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析开放阅读框;采用Expasy ProtParam程序(http://web.expasy.org/protparam/)分析蛋白质的分子量、等电点和氨基酸组成;使用MEGA 5.0软件邻接法(Neighbor-Joining)构建系统发生树;依据软件DNAMAN进行多物种氨基酸序列比对并确定蛋白质保守结构域;使用在线工具SOPM(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopm.html)对千里光D6D基因进行二级结构分析;通过NCBI 数据库GenBank和Conserved domains分析蛋白质保守结构域;将氨基酸序列信息提交(European Bioinformatics Institute(http://www.isb-sib.ch),采用同源模型服务软件SWISS-MODEL构建D6D基因的3-D结构[17],根据最小叠合法利用Swiss-Pdb Viewer软件对3-D结构进行修正和叠合[18]。
2结果与分析
2.1千里光D6D基因的理化性质
从表1可以看出,该千里光D6D基因的分子量为 53.40 ku,理论等电点pI为8.48,不稳定系数为42.98,表明该千里光D6D基因状态不稳定;脂溶指数为90.58;平均疏水指数为 0.078。该千里光D6D基因由20种氨基酸组成,亮氨酸含量较高,为12.0%,不含脯氨酸和硒半胱氨酸;原子组成为C2462H3694N640O64S25。
2.2D6D基因系统进化分析
利用MEGA 5.0软件,选择NJ法构建系统进化树(图1)。
结果表明,D6D基因与钩柱花草(XP_003588984.1)、苜蓿(ABU98945.1)处于同一进化分支上,表明它与二者亲缘关系较近;与月见草(ACB47482.1)、野生大豆(KHN01208.1)亲缘关系较远。
2.3D6D基因的保守基序分析
根据D6D基因遗传进化树,选择包含千里光在内的5个亲缘关系差异最大的物种进行序列比对。序列比对结果显示,这5个亲缘关系差异最显著的物种表现出高度同源性,同源性为76.31%。序列比对结果发现,3个富含组氨酸的保守基元序列HisⅠ-片段、HisⅡ-片段、HisⅢ-片段和N端的1个类似于细胞色素b5(Cytb5)的血红素结合区(HPGG)在不同物种中表现出高度保守性(图2)。
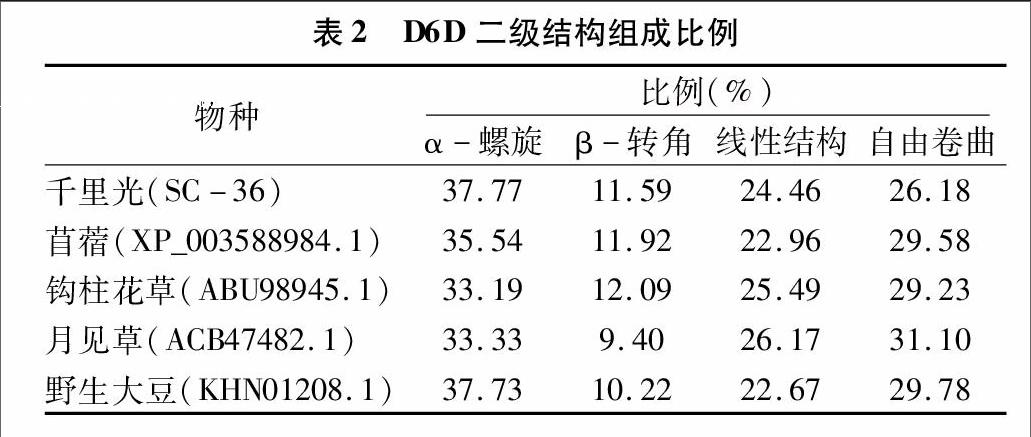
2.4D6D基因二级结构分析
使用在线工具SPOM分别对这5个物种的D6D基因进行二级结构分析,结果表明,D6D基因的二级结构主要由α-螺旋、β-转角、线性结构和自由卷曲等4种基本结构组成(表2),其中不同物种的二级结构组成比例都十分相近,例如α-螺旋的比例最高,自由卷曲的组成比例次之,β-转角的含量最低。
结果表明,酶脱氢所共有的3个组氨酸保守区,分别在氨基酸序列的172~176、209~213、395~402处。结合D6D基因保守基序形成的二级结构,结果发现,即使在亲缘关系相距最远的5个物种中,无论是保守基序还是非保守基序所形成的二级结构都非常相近(图3)。
2.5D6D基因的保守结构域与三维结构比对分析
利用Blast搜索高等植物脂肪酸脱氢酶功能结构域,结果表明,D6D是羧基定向的脂肪酸脱氢酶,它包含3个组氨酸保守结构域,分别为HXXXH、HXX(X)HH、H/QXX(X)HH,其N端存在类似于细胞色素b5(Cytb5)的血红素结合区(HPGG) (图2),这也在D6D结构域预测图中得到进一步证明(图4)。三维结构结果表明,包括千里光在内的5个遗传差异最为显著的物种中,D6D基因具有高度相似的三维结构。如图5所示,在3-D结构中,D6D基因结构成分以α-螺旋和自由卷曲为主;3个组氨酸保守区以及类似于细胞色素b5(Cytb5)的血红素结合区(HPGG)是形成底物结合部位和酶催化活性中心的结构基础。
3结论与讨论
1993年,Reddy等首先从1株产6,9,12-十八碳三稀酸的蓝细菌(Synechocystis sp. PCC6803)中克隆得到Δ6-脂肪酸脱氢酶基因,并在Δ6-脂肪酸脱氢酶缺陷的蓝细菌(Anabaena sp. PCC7120)中得到功能性表达[8]。这一科研成果为后续脂肪酸脱氢酶的深入研究奠定了基础。目前,通过 cDNA 文库筛选、cDNA文库随机测序和cDNA末端扩增技术(RACE)等多种方法已经从动植物和真菌等不同生物中克隆到Δ6-脂肪酸脱氢酶基因[19]。本研究是基于提取并且纯化千里光叶片mRNA构建的全长cDNA文库[20],表明D6D基因合成中产物对高等植物千里光有重要作用。目前,可以推测D6D是决定千里光合成多不饱和脂肪酸的关键基因之一。但由于大部分高等植物不能合成Δ6位脱氢的脂肪酸,所以D6D基因在高等植物中的具体作用机制还有待于进一步研究。
研究证实,用蛋白质氨基酸序列所构建的遗传进化树分支不仅可以反映物种间的亲缘关系,还可以作为蛋白功能相关性评价的依据,这是因为植物在长期适应环境的进化过程中,执行相关生理功能的基因因其重要的保护作用会表现得相对保守[21-22]。本研究构建了D6D基因的遗传进化树,选择了与千里光亲缘关系差异较大的4个物种进行结构与功能分析,发现其基元序列变异性较高,说明在代谢过程中可以有其他代谢途径将D6D基因替代,同时,这种较高的变异性也可以加速物种的进化,说明并不是所有生物体内都必须含有D6D基因。
为准确分析基元序列特征,本研究选择与高等植物千里光亲缘关系差异最为显著的4个物种,由此可见,该保守基序是构成羧基定向的膜结合脱氢酶功能域的基本结构单位,通过保守结构域的分析也证实了这一点。氨基酸序列分析发现D6D的N端和C端部分缺乏明显的同源性,但中部序列相对保守,含有3个极度保守的组氨酸富集区。Fox等提出,这3个保守区可能参与酶活性中心位点的形成,这一点已经在二价铁酶中得到验证[23]。D6D基因除了有这3个组氨酸富集区以外,在其N末端的1个类似Cytb5的亚铁血红素结合区,删除这段特殊序列区,或者对关键氨基酸位点进行突变,都会导致酶功能的紊乱[24],同时根据其基元序列,发现D6D基因的保守基序以及HPGG血红素结合区氨基酸片段高度保守,进一步证实D6D基因底物结合部位和酶催化活性中心的结构基础是3个组氨酸保守结构域和1个类似于细胞色素b5的结构域。除此之外,Δ6-脂肪酸脱氢酶还有2个特殊的组氨酸H53和H76,它们在Δ6-脂肪酸脱氢酶中的位置和血红素上的2个组氨酸在细胞色素中位置一致;推断这2个组氨酸与血红素的稳定性有关;对His53HPGG56序列进行预测,发现脂肪酸脱氢酶存在β-折叠,这样可以使His53更容易结合于血红素上而发挥Δ6-脂肪酸脱氢酶的活性[20],证明其三维结构中存在β-折叠的重要性。本研究为进一步阐明蛋白质结构和功能相关性,依据氨基酸的保守序列对结构蛋白和功能蛋白进行3-D同源建模[25-26]。研究发现,D6D基因保守结构域是以α-螺旋和β-转角相互作用形成的独立结构,进一步折叠形成蛋白质的三级结构[27],是脂肪酸脱氢酶底物结合位点和催化位点功能域的基本单位;千里光D6D基因所形成的高级结构相对较松散,表明D6D基因在形成四级结构的过程中,须要结合更大官能团的辅酶或辅基,抑或可为辅酶或辅基提供多个结合位点;意味着高等植物D6D基因在催化多不饱和脂肪酸的反应过程中,有利于结合并且转运较大基团的反应底物。
参考文献:
[1]李冠,杜钰,黄琼,等. 脂肪酸脱氢酶研究进展[J]. 食品与生物技术学报,2007,26(2):121-126.
[2]Los D A,Murata N. Structure and expression of fatty acid desaturases[J]. Biochimica Et Biophysica Acta,1998,1394(1):3-15.
[3]Shanklin J,Cahoon E B. Desaturation and related modification of fatty acids[J]. Annual Review of Plant Biology,1998,49:611-641.
[4]张琦,李明春,孙红妍,等. Δ6-脂肪酸脱氢酶的分子生物学研究进展[J]. 生物工程学报,2004,20(3):319-324.
[5]黄胜和,丁永红,哈斯阿古拉. 植物Δ6-脂肪酸脱氢酶及其基因的研究进展[J]. 北方园艺,2011(1):216-219.
[6]全国中国草药汇编编写组.全国中草药汇编[M]. 上海:上海科学技术出版社,1999:1390.
[7]孟凡君,张雪君,谢卫东.中草药千里光研究进展[J]. 东北农业大学学报,2010,41(9):156-160.
[8]Reddy A S,Nuccio M L,Gross L M,et al. Isolation of a Δ6-desaturase gene from the cyanobacterium Synechocystis sp. strain PCC 6803 by gain-of-function expression in Anabaena sp. strain PCC 7120[J]. Plant Molecular Biology,1993,22(2):293-300.
[9]宋丽英.黑茶藨子Δ6-脂肪酸脱氢酶基因的克隆及功能研究[D]. 北京:中国科学院研究生院,2010.
[10]李明春,刘莉,张丽,等. 深黄被孢霉Δ6-脂肪酸脱氢酶基因的克隆及序列分析[J]. 菌物系统,2001,20(1):44-50.
[11]李明春,刘莉,胡国武,等. 高山被孢霉Δ6-脂肪酸脱氢酶基因的克隆、结构分析及其功能的研究[J]. 微生物学报,2003,43(2):220-227.
[12]黄胜和.月见草Δ6-脂肪酸脱氢酶基因的克隆与异源表达[D]. 呼和浩特:内蒙古大学,2009.
[13]杜钰. 假狼紫草Δ6-脂肪酸脱氢酶基因克隆研究[D]. 乌鲁木齐:新疆大学,2006.
[14]王德培. 雅致枝霉Δ6-脂肪酸脱氢酶基因及其启动子的克隆与功能分析[D]. 天津:南开大学,2006.
[15]赵芳. 卷枝毛霉Δ6-脂肪酸脱氢酶基因在大肠杆菌和烟草中的表达[D]. 北京:中国农业大学,2006.
[16]张琦,李明春,孙颖,等. 少根根霉Δ6-脂肪酸脱氢酶基因的克隆和表达[J]. 遗传学报,2004,31(7):740-749.
[17]Biasini M,Bienert S,Waterhouse A,et al. SWISS-MODEL:modelling protein tertiary and quaternary structure using evolutionary information[J]. Nucleic Acids Research,2014,42:252-258.
[18]Arnold K,Bordoli L,Kopp J,et al. The SWISS-MODEL workspace:a web-based environment for protein structure homology modelling[J]. Bioinformatics,2006,22(2):195-201.
[19]白义春,康相涛,孙桂荣,等. Δ6-脂肪酸脱氢酶研究进展[J]. 河南农业科学,2008(2):9-12.
[20]平军娇,张珍,蔡振锋,等. 千里光全长cDNA文库的构建及分析[J]. 中草药,2012,43(3):557-561.
[21]Khuri S,Bakker F T,Dunwell J M. Phylogeny,function,and evolution of the cupins,a structurally conserved,functionally diverse superfamily of proteins[J]. Molecular Biology and Evolution,2001,18(4):593-605.
[22]钱刚,平军娇,张珍,等. 3种棱型大麦中脱水素6(DHN6)的性质、突变位点与蛋白质进化分析[J]. 基因组学与应用生物学,2011,30(3):322-329.
[23]Fox B G,Shanklin J,Ai J,et al. Resonance raman evidence for an Fe-O-Fe center in stearoyl-ACP desaturase. primary sequence identity with other diiron-oxo proteins[J]. Biochemistry,1994,33(43):12776-12786.
[24]Sayanova O,Shewry P R,Napier J A. Histidine-41 of the cytochrome b5 domain of the borage Δ6 fatty acid desaturase is essential for enzyme activity[J]. Plant Physiology,1999,121(2):641-646.
[25]Gelly J C,Lin H Y,de Brevern A G,et al. Selective constraint on human pre-mRNA splicing by protein structural properties[J]. Genome Biology and Evolution,2012,4(9):966-975.
[26]Broeker N K,Gohlke U,Müller J J,et al. Single amino acid exchange in bacteriophage HK620 tailspike protein results in thousand-fold increase of its oligosaccharide affinity[J]. Glycobiology,2013,23(1):59-68.
[27]纪兆林,石刘飞,李健,等. 卷曲螺旋结构及其研究进展[J]. 江苏农业科学,2014,42(2):6-11.

