大菱鲆周期蛋白依赖激酶基因cdk1、cdk6克隆及表达分析
郭佳伟,朱香萍,吴志昊,宋宗诚,范兆飞,4,谭训刚,尤 锋
(1. 青岛农业大学 动物科技学院,山东 青岛 266109; 2. 中国科学院 海洋研究所 中国科学院实验海洋生物学重点实验室,青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室,山东 青岛 266071;3. 威海圣航水产科技有限公司,山东 威海 264200; 4. 中国科学院大学,北京 100049)
大菱鲆周期蛋白依赖激酶基因cdk1、cdk6克隆及表达分析
郭佳伟1,朱香萍1,吴志昊2,宋宗诚3,范兆飞2,4,谭训刚2,尤 锋2
(1. 青岛农业大学 动物科技学院,山东 青岛 266109; 2. 中国科学院 海洋研究所 中国科学院实验海洋生物学重点实验室,青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室,山东 青岛 266071;3. 威海圣航水产科技有限公司,山东 威海 264200; 4. 中国科学院大学,北京 100049)
摘要:通过同源克隆以及5′/3′RACE的方法扩增得到大菱鲆(Scophthalmus maximus)细胞周期蛋白依赖激酶基因cdk1和cdk6的全长cDNA序列,在mRNA水平上分析了它们组织表达特征,并对比分析了静水压处理对其胚胎期表达的影响。结果显示,cdk1基因全长cDNA序列为1281 bp (GenBank登录号:KP339306),编码区为912 bp; cdk6基因cDNA全长1400 bp (GenBank登录号: KT186374),编码区长度为978 bp。组织RT-PCR分析表明,cdk1基因表达具有广泛性,在性腺、肾脏等生长发育较快的组织中表达量较高; cdk6基因也在多个组织中表达,在性腺中表达量最高。通过Real time RT-PCR检测基因在胚胎中的表达水平发现,静水压处理组 cdk1、cdk6在胚胎发育中,总体变化趋势与对照组类似。大菱鲆胚胎对照组中cdk1在原肠期以前相对神经胚期及以后时期表达量较高,静水压处理组基因表达变化与对照组趋势相同; 对照组中 cdk6在原肠期出现表达高峰,但静水压处理组在原肠期表达量相对较低。静水压处理对 cdk1和 cdk6的表达量的影响不同,这可能与基因还有除调控细胞周期的其他功能有关。为解析这两个基因在大菱鲆胚胎发育中的作用及其机制提供了参考。
关键词:大菱鲆(Scophthalmus maximus); cdk1和cdk6; 克隆; 组织; 胚胎; 静水压; RT-PCR
三倍体鱼性腺不发育或者低育而具有生长速度快的特性,但是,三倍体需要每次进行人工诱导,限制了其在生产中的应用。四倍体的生殖细胞含有偶数染色体组预期是可育的,成熟的四倍体与正常的二倍体杂交则可进行大批量、一劳永逸的三倍体生产,故四倍体研究一直被关注。据不完全统计,自20世纪80年代以来,已在超过40种鱼类中开展了人工诱导四倍体的尝试,如淡水鱼类罗非鱼(Oreochromis spp.)[1]、虹鳟(Oncorhynchus mykiss)[2]和海水鱼欧鲈(Dicentrarbus labrax)[3]等。这些研究多限于处理方法参数筛选优化,对其后期生长发育到成熟个体的报道较少,仅有淡水鱼异源四倍体鲫鲤(♀Carassius auratus red. Var X ♂Cyprinus carpio的杂交可育后代)[4]等的相关报道,故鱼类四倍体诱导技术尚需要进一步完善,其诱导机制研究也尤显重要。但目前,有关海水鱼中四倍体诱导的分子生物学研究几乎未见到,严重影响了海水鱼类四倍体诱导技术的提升及三倍体育种实现。
四倍体的诱导,既要有效地破坏纺锤体、抑制分裂进程,也要保证诱导结束后,受精卵能够准确地重新启动,确保加倍的染色体组协同一致, 完成后续分裂和发育过程,而该过程的顺利实现并非易事,这也许就是现今人们只获得了四倍化胚胎,而很难得到四倍体鱼的原因[5]。卵裂抑制后的重新启动与细胞分裂周期的重新启动密切相关。因此,通过细胞周期相关基因的表达变化,可以分析重新启动过程中分子水平变化和调整机制,研究四倍体的形成机制,从而指导诱导参数的优化。细胞周期指连续分裂的细胞从一次有丝分裂结束到下一次有丝分裂完成的
[Foundation: National High Technology Research and Development Program of China (863 Programme),No. 2012AA10A402; Natural Science Foundation of Shandong,No. ZR2011CM035; National Natural Science Foundation of China,No. 31502156; Science and Technology Development Project of Shandong,No. 2013GHY11526; and the National Flatfish Industry System Construction Programme,No. nycytx-50-G03]
大菱鲆(Scophthalmus maximus)20世纪90年代初由欧洲引入中国,目前已经成为中国北方重要的海水养殖鱼类[8]。近年对大菱鲆的研究比较多集中在温度和盐度对鱼体影响等方面[9-10],国外有关大菱鲆三倍体诱导研究发现,大菱鲆三倍体性腺的确不能正常发育,且一龄以上三倍体生长显著快于二倍体(P<0.05)[11],因而进行其三倍体育种研究具有实用价值。大菱鲆四倍体研究目前仅有本实验室开展的诱导报道[12],通过静水压法获得了四倍体胚胎及仔鱼。作者拟分析四倍体诱导组受精卵与对照组受精卵胚胎发育过程中,细胞周期相关基因 cdk1和cdk6的差异表达,以期为阐述这些基因在四倍体诱导中的作用机制提供基础数据,也为进一步完善鲆鲽鱼及其他海水鱼类四倍体诱导技术提供参考。
1 材料与方法
1.1 样品采集
进行相关基因克隆和组织表达的样品,取自中国科学院海洋研究所水族楼常规培育的大菱鲆,培育条件为: 每天换水2次,并吸底排污2次,投喂适口商业饵料2次; 水温变化范围为15~25℃,pH为7.8~8.2,盐度30,DO>5 mg/L。大菱鲆样品全长13~14.5 cm,共6尾。解剖取其心脏、肝脏、脾脏、鳃、头肾、肾脏、脑、眼、肌肉、肠、胃和性腺组织,立即置于液氮中速冻,然后在-80℃冰箱保存备用。
大菱鲆四倍体诱导实验在山东威海圣航水产科技有限公司进行,经控光控温培育,选取性腺发育成熟的雄鱼和雌鱼,分别人工挤出精卵后,进行半干湿法授精。受精卵在15.3±0.3℃海水中孵育,取大部分受精卵进行静水压诱导处理,其余少部分受精卵作为对照组。四倍体诱导条件为: 第一次卵裂前15 min以67.5 MPa静水压处理6 min[12],处理后与对照组在相同条件下孵育。在多胞期至出膜期的各发育阶段,诱导组与对照组分别取约 200粒胚胎置于0.5 mL RNA-Solv Reagent(Omega Bio-tek,美国)中,液氮暂时保存后转移到-80℃超低温冰箱,用于RNA提取、反转录和表达实验。
1.2 Cdk1、cdk6基因克隆及序列分析
取上述大菱鲆各组织,按照 RNA-Solv Reagent说明书抽提总RNA,通过1.0%琼脂糖凝胶电泳检测总RNA的完整度和纯度,使用NanoDrop 2000超微量分光光度计检测其浓度。取 1 μg总 RNA经过Dnase1(TAKARA,日本)消化处理,用 M-MLV Reverse Transcriptase(Promage,美国)反转录合成 cDNA的第一链模板20 μL,储存在-20℃备用。并用SMARTer RACE cDNA Amplication Kit(Clontech,美国)完成3′/ 5′RACE cDNA模板构建。
根据GenBank获得已知鱼类cdk1、cdk6的基因序列,设计简并引物(表1),以大菱鲆性腺和肾脏cDNA为模板通过PCR反应(2xEs Taq MasterMix 25 μL,ddW 19 μL,Primer-F(10 μmol/L) 2 μL,Primer-R(10 μmol/L)2 μL,cDNA 2 μL)扩增它们的保守序列,cdk1 PCR程序: 94℃预变性5 min; 94℃变性30 s,58℃退火30 s,72℃延伸2 min,30个循环; 72℃再延伸5 min; cdk6 PCR程序除退火温度为55℃、35个循环外,其余条件相同。PCR产物用 1.0%琼脂糖凝胶电泳检测后,经Gel Extraction Kit(OMEGA,美国)纯化,连接、转化,并经蓝白斑筛选和 PCR检测,将阳性克隆菌株送至上海桑尼生物科技有限公司测序。根据获得的cdk1、cdk6保守片段设计3′和5′RACE特异性引物(表1)。使用SMART RACE cDNA Amplification Kit扩增两基因cDNA的3′和5′端序列。PCR反应条件为: 94℃变性30 s; 68℃退火30 s,72℃延伸2 min,30个循环。PCR产物按照上述同样方法纯化、连接转化、检测、测序分析。测序结果在NCBI 网站上Blast比对,使用 BioEdit 进行拼接,获得 cDNA全长序列。设计特异性引物(表 1),进行全长验证。根据cDNA序列,用BioEdit软件翻译cdk1、cdk6基因的氨基酸序列,并用DNAMA进行氨基酸多序列比对,进化树的构建是采用软件ClustalX 和MEGA5结合GenBank上各物种的cdk1、cdk6氨基酸序列进行比对聚类分析而完成的。
1.3 Cdk1、cdk6表达分析
1.3.1 组织表达分析
利用Primer5.0软件设计特异性引物(表1),通过RT-PCR分析cdk1、cdk6在大菱鲆12种组织中的表达,β-actin作为内参基因。PCR反应体系: 2xEs TaqMasterMix,12.5 μL; H2O,9.5 μL; Primer-F(10 μmol/L),1 μL; Primer-R(10 μmol/L),1 μL; cDNA,1 μL。反应条件: 94℃预变性5 min; 94℃变性30 s,58℃退火30 s,72℃延伸30 s,共30个循环; 72℃再延伸10 min。PCR产物进行1.5%琼脂糖凝胶电泳检测,并将电泳检测结果使用Gel-Pro analyzer进行灰度分析,并使用SPSS Statistics 17.0软件进行单因素方差分析确定不同组织之间差异的显著水平。
1.3.2 胚胎发育阶段的表达分析
cDNA模板取来自相同亲本静水压处理组或对照组不同时期胚胎各约50粒,分别按照1.2中的方法提取,取1 μg总RNA反转录得到cDNA的第一链模板20 μL加RNase-free Water稀释到30 μL,每个样品3次重复。利用 Primer5.0软件设计 Real time RT-PCR特异性引物(表1),用TAKARA TP800荧光定量 PCR仪进行扩增。反应体系: SYBR Premix Ex TaqTMII(Tli RNaseH Plus),10 μL; RNase-free Water,7.8 μL;Primer-F(10 μmol/L),0.6 μL; Primer-R(10 μmol/L),0.6 μL; cDNA,1 μL。采用3部法程序: 95℃预变性30 s; 95℃变性10 s,55℃退火30 s,72℃延伸30 s,共40个循环。反应结束后绘制溶解曲线以确保扩增的特异性和准确性。通过检测SYBR Green荧光染料在PCR反应过程中荧光信号的变化,记录每个PCR反应的 Ct值,然后以 β-actin为内参基因,采用2-ΔΔct法分析基因的相对表达量。使用 SPSS Statistics 17.0软件选择tukey法进行单因素方差分析,确定不同发育阶段及诱导组与对照组之间差异的显著性水平。

表1 大菱鲆cdk1、cdk6基因克隆、RT-PCR和Real time RT-PCR分析所用引物序列Tab. 1 Primers used in cloning,RT-PCR,and real-time RT-PCR of Scophthalmus maximus cdk1 and cdk6 genes
2 实验结果
2.1 大菱鲆cdk1、cdk6 cDNA序列及氨基酸同源性分析
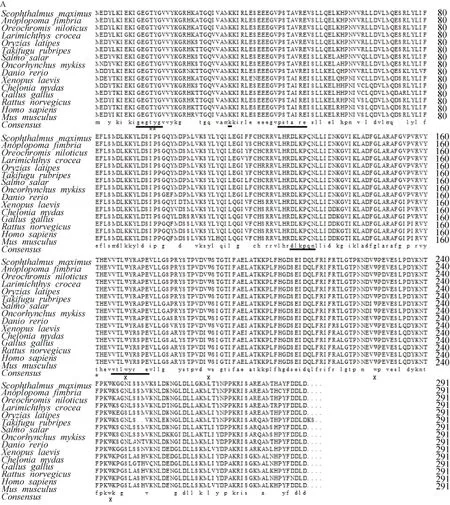
通过基因克隆和全长验证,获得了大菱鲆cdk1、cdk6基因的cDNA全长序列。cdk1基因cDNA全长1281 bp(KP339306),编码区长度为 912 bp,编码一条含 303个氨基酸的蛋白。保守结构域搜索发现了STKc-CDK1-euk结构域,属于PKc-like超家族的一员。通过Compute pI/MW在线软件分析等电点pI为8.30,相对分子质量为34591.15。大菱鲆CDK1氨基酸序列具有高度保守性,与银鳕鱼(Anoplopoma fimbria,ACQ58326.1)相似度最高达到 96%,与人类(Homo sapiens,NP_001777.1)相似度为81%。由氨基酸比对(图 1 A)和系统进化树(图1 B)可以看出其与鱼类的先聚在一起,然后再与其他物种聚在一起。
大菱鲆cdk6基因cDNA全长1400 bp,编码区长度为978 bp,编码一条含325个氨基酸的蛋白,也发现了STKc-CDK6-euk结构域,同属PKc-like超家族的一员。其等电点pI为5.62,相对分子量为36632.9。大菱鲆 CDK6氨基酸序列具有高度保守性,和亚马逊帆鳍鲈(Poecilia formosa,XP_007547583.1)相似度最高达到 98%,与人相似度为 85%。由氨基酸比对(图2 A)和系统进化树(图2B)可以看出,其与鱼类的相似性较高,与高等脊椎动物的相似性较低。

图1 大菱鲆cdk1基因氨基酸序列、结构及同源性分析Fig. 1 Multiple sequence alignment and phylogenetic analysis of the deduced amino acid sequences of Scophthalmus maximus cdk1
2.2 Cdk1、cdk6基因在大菱鲆各组织中的表达

Cdk1和cdk6基因在各组织中RT-PCR表达和电泳图灰度分析如图3所示。Cdk1基因在各组织中广泛表达,性腺中表达量最高,在肾脏、头肾中表达量次之,脑、眼睛和肌肉中表达量较低。大菱鲆 cdk6基因整体表达量较 cdk1低,在各个组织中也都有表达,性腺中表达量最高,在肝脏、脑、眼等组织中的表达量较低。

图2 大菱鲆cdk6基因氨基酸序列、结构及同源性分析Fig. 2 Multiple sequence alignment and phylogenetic analysis of the deduced amino acid sequences of Scophthalmus maximus cdk6
2.3 静水压处理后cdk1、cdk6在胚胎发育过程中的差异表达
实验中所获得的静水压处理组大菱鲆胚胎的四倍体诱导率(四倍体分裂相数/总分裂相数×100%)在70%~90%。

图3 大菱鲆cdk1和cdk6组织差异表达Fig. 3 Cdk1 and cdk6 expression patterns in 12 tissues of Scophthalmus maximus
大菱鲆胚胎cdk1基因Real time RT-PCR表达如图4所示。对照组中,多胞期到原肠后期均较高水平表达,神经胚期表达量降低,其后表达量相对较低。静水压处理组具有相同的总趋势,高囊胚、原肠早期表达量相对较高,神经胚以后处于稳定的低表达状态。在高表达阶段,对照组变化幅度较大,静水压处理组变化较小; 在高囊胚、原肠早期,对照组的表达水平显著高于处理组(P < 0.05)(图4)。

图4 大菱鲆cdk1基因在对照组和静水压处理组不同发育时期胚胎差异表达Fig. 4 The expression levels of cdk1 in Scophthalmus maximus embryos at different stages with hydrostatic pressure treatment
Cdk6基因Real time RT-PCR检测结果如图5所示,对照组多胞期到低囊胚期表达量较低,原肠早期表达量明显升高,原肠中期达到最高水平,随后原肠后期至克氏囊期表达量下降,直至出膜前期持续下降,出膜期时最低。静水压处理组的总体变化趋势与对照组相同,也是在原肠期至神经胚期表达量较高,但总体上较对照组低,在原肠早、中期显著低于对照组(P<0.05)(图5)。
3 讨论
3.1 大菱鲆cdk1和cdk6基因的序列结构及组织表达差异
Cdk1、cdk6是编码细胞周期蛋白依赖激酶的重要基因,其编码蛋白CDK1和CDK6在细胞周期各时相的转化中起重要作用。CDK1通过磷酸化一些功能蛋白而调控细胞周期进程[13]。大菱鲆cdk1氨基酸序列具有高度保守性,含有STKc-CDK1-euk结构域,属于PKC-like超家族的一员,也具有丝氨酸/苏氨酸蛋白激酶家族特征序列 DLKPQN和 G/V-T/S-X-XY/F-X-A-P-E、CDK1活性相关的 3个磷酸化位点T14、Y15、T161,以及与cyclin B结合位点保守序列 PSTAIRE和与 ATP结合位点相关保守序列GXGXXG和K33。在细胞周期进程中,CDK6是G1期重要的调控因子,它与 cyclinD结合形成复合物,在细胞周期蛋白依赖激酶活化激酶的协同作用下,使下游的 pRb磷酸化,从而解除对转录因子 E2F-1的抑制效应,启动DNA复制,促进细胞增殖[14]。大菱鲆 cdk6氨基酸序列和其他鱼类的高度保守,也含有丝氨酸/苏氨酸/酪氨酸蛋白激酶家族特征序列ADFGLARIYSFQMALTSVVVTLW,还有与 cyclin结合位点相关的保守序列 EEGM、SHR和 RIYSFQMALT以及与 ATP结合位点相关的保守序列GXGXXG和K32。
作者的组织表达分析发现,大菱鲆cdk1和cdk6基因组织表达具有相似性,在心脏、肝脏、脾脏等组织中均有不同程度的表达,但 cdk6表达量要略低于cdk1。两基因在脑、眼、肌肉中表达量都较低,性腺中表达量最高,分析可能与所取鱼体的性腺正处于快速生长发育期有关。这与大黄鱼(Larimicthys crocea)[15]、虹鳟[16]的 cdk1结果类似,各个组织中也均检测到其表达,且在性腺中表达量最高。在以往的人类研究中 cdk6在不同种类细胞中也都有表达,正常组织中的表达量较癌症组织中低[17]。即这两个基因在细胞分裂旺盛的组织中表达较高,可作为参考说明细胞的分裂情况。
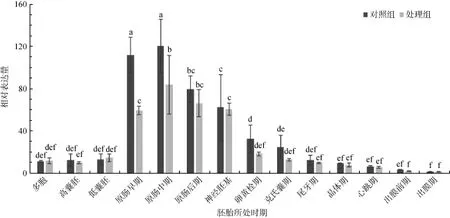
图5 大菱鲆cdk6基因在对照组和静水压处理组胚胎发育中的差异表达Fig. 5 The expression levels of cdk6 in Scophthalmus maximus embryos at different stages with hydrostatic pressure treatment
3.2 大菱鲆胚胎cdk1和cdk6基因的表达特点以及静水压处理对基因表达的影响
经静水压处理,作者获得了四倍体诱导率较高(70%~90%)的大菱鲆胚胎。对照组中检测大菱鲆cdk1基因在多胞期、囊胚期、原肠期表达量较高,这与胚胎发育过程中的生理特点密不可分,多胞期后细胞向四周扩散,在原肠作用下进行有规律的定向迁移、排列和分化形成胚层。这些时期胚胎发育速度快,细胞处于高速生长发育过程中有丝分裂旺盛,需要大量 CDK1对有丝分裂进程进行调控。在神经胚期以后 cdk1表达量处于相对稳定的低水平,这与该时期细胞分化程度增加、迁移减慢和细胞分化程度低有关。静水压处理后,检测 cdk1基因的转录水平在胚胎发育过程中的变化趋势与正常大菱鲆二倍体相同,且四倍体诱导组中的表达量略低于对照组的,也就是说水静压对其细胞分裂可能有一定的抑制作用。而在不同倍性鲫鲤鱼(红鲫(Carassius auratus red. Var)和湘江野鲤(Cyprinus carpio)杂交后代异源四倍体鲫鲤(allotetraploids hybrids)、雄性异源四倍体鲫鲤与雌性二倍体日本白鲫 (Carassius auratuscuvieri)交配产生三倍体湘云鲫(allotriploid crucian carp)、红鲫)卵巢中,cdk1基因的转录水平会随倍性的递增而依次升高[18]。两者结果不同,分析其原因可能是,在胚胎发育早期cdk1表达受到多种因子的调控并不因倍性增加而增加 cdk1的转录水平,抑或是如前所述水静压会减缓其细胞分裂引起的,但这需要进一步实验进行验证。关于cdk1基因功能研究在哺乳类中较深入,小鼠胚胎发育早期 cdk1基因缺失会引起胚胎死亡,推测其在胚胎发育中有重要作用[19]。通过shRNA技术低表达 cdk1使阻塞 G2/M 转换可诱导HO8910细胞凋亡[20]。研究表明,恶性肿瘤 cdk1的表达量一般高于正常组织,揭示 cdk1表达受细胞分化状态影响,大菱鲆胚胎发育早期细胞分化程度低时cdk1表达量较高,也提示其与细胞分化状态相关。
本实验对照组cdk6基因表达量在早期处于较低水平,在原肠早期突然升高,原肠中期达到最高,后期开始缓慢下降。如前所述,CDK6是G1期调控的重要因子,通过一系列诱导可以启动细胞周期进程及细胞增殖[21]。故大菱鲆原肠期高表达cdk6与旺盛的细胞分裂密切相关。静水压处理组胚胎cdk6在发育过程中的变化趋势与对照组基本一致,但总体上较低,特别在原肠期的表达量明显低于对照组。Cdk6主要集中在哺乳动物和人类癌症的相关研究。研究发现cdk6具有调节细胞周期、影响血细胞功能、影响特定细胞的分化等多种功能。当 CDK6的活性受到抑制或下降,能阻止细胞G1/S期转换[22]。在小鼠ES细胞的研究中发现,诱导ES细胞分化后cdk6表达水平明显下调,通过 siRNA技术沉默 cdk6基因,发现未分化相关基因明显下调,而分化相关基因明显上调,揭示 cdk6基因表达与细胞未分化状态密切相关[23]。关于cdk6基因在鱼类及其多倍体中都未见报道,大菱鲆静水压处理组 cdk6表达量降低的原因是否是由于水静压减缓其细胞分裂引起的,还需要进一步研究探讨。
在天然多倍体和成功获得成熟个体人工多倍体中基因表达的相关研究中仅见多倍体生长以及性别相关基因的研究。静水压诱导染色体加倍机制在细胞水平上是静水压处理早期胚胎破坏细胞内纺锤体结构抑制有丝分裂而形成[24]。在分子水平上细胞周期蛋白基因cdk1和cdk6在细胞周期中起到重要的调控作用,染色体完成加倍后细胞进入周期性有丝分裂,基因表达水平直接影响加倍胚胎的生长发育。在细胞周期中cdk1和 cdk6同样起到重要的调控作用,但在大菱鲆胚胎发育中的变化趋势不同,并且静水压处理后变化趋向亦不同。在多胞期、囊胚期、原肠期胚胎细胞分化程度低,cdk1高表达,不同的是cdk6在多胞期和囊胚期表达量较低,说明cdk6表达量和细胞未分化程度不是简单的正相关,还具有更复杂的关系。在静水压处理后cdk1基因在早期胚胎各时期中出现过表达或低表达现象,而 cdk6基因表达在处理后各个发育时期低表达,故两个基因在胚胎发育过程中可能有不同的作用机制,由此对静水压作用的响应机制也不同,但尚需深入研究。
参考文献:
[1] Myers J M. Tetraploid induction in Oreochromis spp.[J]. Aquaculture,1986,57: 281-287.
[2] 马涛,朱才宝,朱秉仁. 热休克诱导虹鳟四倍体[J].水生生物学报,2005,11(4): 329-336. Ma Tao,Zhu Caibao,Zhu Bingren. Tetraploid of rainbow trout (Salmo gairdneririchardson) induced by heat shocks[J]. Acta Hydrobiologica Sinica,2005,11(4):329-336.
[3] Peruzzi S,Chatain B. Induction of tetraploid gynogenesis in the European sea bass (Dicentrarbus labrax L.)[J]. Genetica,2003,119: 225-228.
[4] Long Y,Tao M,Liu S J,et al. Differential expression of Gnrh2,Gthβ,and Gthr genes in sterile triploids and fertile tetraploids[J]. Cell and Tissue Research,2009,338(1): 151-159.
[5] 桂建芳,肖武汉. 静水压休克诱导水晶彩鲫三倍体和四倍体的细胞学机理初探[J]. 水生生物学报,1995,19(1): 49-55. Gui Jianfang,Xiao Wuhan. Preliminary study on the cytological mecha-nism of triploidy and tetraploidy induced by hydrostatic pressure shock in tra-nsparent colored crucian carp[J]. Acta Hydrobiologica Sinica 1995,19(1)49-55.
[6] Kishimoto T. Cell-cycle control during meiotic maturation[J]. Current Opinion in Cell Biology,2003,15:654-663.
[7] Donjerkovic D,Scott D W. Regulation of the G1 phase of the mammalian cell cycle[J]. Cell Research,2000,10(1): 1-16.
[8] 申雪艳,宫庆礼,雷霁霖,等. 进口大菱鲆苗种的遗传结构分析[J]. 海洋与湖沼,2004,35(4): 332-341. Shen Xueyan,Gong Qingli,Lei Jilin,et al. Population genetic structure analysis of the imported turbot seedlings Scophthalmus maximus using RAPD and microsatellite technique[J]. Oceanologia et Limnologia Sinica,2004,35(4): 332-341.
[9] 纪利芹,蒋克勇,韩龙江,等. 连续降温对大菱鲆成鱼代谢机能的影响[J]. 海洋科学,2014,38(5): 46-53. Ji Liqin,Jiang Keyong,Han Longjiang,et al. Effect of continuous cooling on metabolic function of adult Scophthalmus maximus[J]. Marine Sciences,2014,38(5): 46-53.
[10] 王新安,郭黎,马爱军,等. 基于响应面法分析温度和盐度及其交互作用对大菱鲆幼鱼抗氧化酶活性的影响[J]. 海洋科学,2014,38(6): 17-23. Wang Xinan,Guo Li,Ma Aijun,et al. Effects of temperature,salinity and their interaction on the activities of antioxidant enzymes of juvenile turbot Scophthalmus maximus based on response surface methodology[J]. Marine Sciences,2014,38(6): 17-23.
[11] Cal R M,Vidal S,Gómez C,et al. Growth and gonadal development in diploid and triploid turbot (Scophthalmus maximus)[J]. Aquaculture,2006,251: 99-108.
[12] 吴志昊,尤锋,宋宗诚,等. 大菱鲆四倍体的人工诱导研究[J]. 海洋与湖沼,2014,45(3): 657-662. Wu Zhihao,You Feng,Song Zongcheng,et al. Induction of tetraploid in turbot Scophthalmus maximus[J]. Oceanologia Et Limnologia Sinica,2014,45(3): 657-662.
[13] Nurse P,Thuriaux P. Regulatory genes controlling mitosis in the fission yeast Schizosaccharomyces pombe[J]. Genetics,1980,96(3): 627-637.
[14] Rivadeneira D B,Mayhew C N,Thangavel C,et al. Proliferative suppression by CDK4/6 inhibition: complex function of the retinoblastoma pathway in liver tissue and hepatoma cells[J]. Gastroenterology,2010,138(5): 1920-1930.
[15] 蔡明夷,周鹏,韩坤煌,等. 大黄鱼 cyclinB1和cdc2cDNA序列特征及组织表达分析[J]. 厦门大学学报: 自然科学版,2014,53(1): 132-141. Cai Mingyi,Zhou Peng,Han Kunhuang,et al. Characterization and tissue expression profiles of cyclin B1 and Cdc2 in large yellow croaker(Larimichthys crocea) [J]. Journal of Xiamen University (Natural Science),2014,53(1): 132-141.
[16] Qiu G F,Ramachandra R K,Rexroad C E,et al. Molecular characterization and expression profiles of cyclin B1,B2 and Cdc2 kinase during oogenesis and spermatogenesis in rainbow trout (Oncorhynchus mykiss)[J]. Animal Reproduction Science,2008,105(3):209-225.
[17] Grossel M J,Hinds P W. From cell cycle to differentiation: an expanding role for cdk6[J]. Cell Cycle,2006,5(3): 266-270.
[18] 曾琛,陶敏,刘少军,等. 不同倍性鱼 cdc2基因cDNA 部分序列的克隆及其在卵巢中的表达分析[J].湖南师范大学自然科学学报,2006,29(3): 73-76. Zeng Chen,Tao Min,Liu Shaojun,et al. Comparative analysis of transcriptional level in ovaries with different ploidy level[J]. Journal of Natural Science of Hunan Normal University,2006,29(3): 73-76.
[19] Santamara D,Barrire C,Cerqueira A,et al. Cdk1 is sufficient todrive the mammalian cell cycle[J]. Nature,2007,448( 7155) : 811-815.
[20] Xi Q,Huang M,Wang Y,et al. The expression of CDK1 is associated with proliferation and can be a prognostic factor in epithelial ovarian cancer[J]. Tumor Biology,2015: 1-10.
[21] Cole A M,Myant K,Reed K R,et al. Cyclin D2- cyclin-dependent kinase 4/6 is required for efficient proliferation and tumorigenesis following Apc loss[J]. Cancer Research,2010,70(20): 8149-8158.
[22] Hu M G,Deshpande A,Enos M,et al. A requirement for cyclin-dependent kinase 6 in thymocyte development and tumorigenesis[J]. Cancer Research,2009,69(3): 810-818.
[23] 王娟娟,刘会贤,侯杰,等. Cdk6在维持ES细胞自我更新中的作用[J]. 中国生物化学与分子生物学报,2012,28(10): 958-965. Wang Juanjuan,Liu Huixian,Hou Jie,et al. The role of Cdk6 in maintaining the self-renewal state of ES cells[J]. Chinese Journal of Biochemistry and Molecular Biology,2012,28(10): 958-965.
[24] Zhang X,Onozato H. Hydrostatic pressure treatment during the first mitosis does not suppress the first cleavage but the second one[J]. Aquaculture,2004,240(1): 101-113.
(本文编辑: 谭雪静)
中图分类号:Q75
文献标识码:A
文章编号:1000-3096(2016)04-0011-11
doi:10.11759/hykx 20150726003
收稿日期:2015-07-26; 修回日期: 2015-10-21
基金项目:国家863计划资助项目(2012AA10A402); 山东省自然科学基金资助项目(ZR2011CM035); 国家自然科学基金资助项目(31502156); 山东省科技发展计划资助项目(2013GHY11526); 鲆鲽类产业技术体系课题(NYCYTX-50-G03)
作者简介:郭佳伟(1991-),女,山东菏泽人,硕士研究生,主要从事海水鱼类分子细胞学研究,E-mail: guojiawei51@126.com; 朱香萍,通信作者,副教授,E-mail: zhuxp980216@163.com; 尤锋,通信作者,研究员,E-mail: youfeng@qdio.ac.cn整个过程,分为G1、S、G2和M期4个时相。细胞周期进程的实现有赖于各级调控因子对细胞周期精确而严密的调控,细胞周期蛋白依赖激酶 CDKs对细胞周期不同时相的推进和转化有重要作用。其中,CDK1(又称p34CDC2、cdc2)在精母/卵母细胞减数分裂、G1/S和G2/M转化中发挥作用[6],而CDK6是一种多功能的蛋白,在生长因子刺激下,与Cyclin D结合,促使细胞进入S期,反之细胞周期停滞于G1期[7]。
Cloning and expression analysis of cdk1 and cdk6 in Scophthalmus maximus
GUO Jia-wei1,ZHU Xiang-ping1,WU Zhi-hao2,SONG Zong-cheng3,FAN Zhao-fei2,4,TAN Xun-gang2,YOU Feng2
(1. Animal Science and Technology Department,Qingdao Agricultural University,Qingdao 266109,China;2. Key Laboratory of Experimental Marine Biology,Institute of Oceanology,Chinese Academy of Sciences,Laboratory for Marine Biology and Biotechnology,Qingdao National Laboratory for Marine Science and Technology,Qingdao 266071,China; 3. Shenghang Aquatic Science and Technology Co.,Ltd.,Weihai 264200,China; 4. University of Chinese Academy of Sciences,Beijing 100049,China)
Received: Jul. 26,2015
Key words:Scophthalmus maximus; cdk1 and cdk6; cloning; tissue; embryo; hydrostatic pressure treatment; RT-PCR
Abstract:Whole cDNA sequences of cyclin-dependent protein kinase genes (cdk1 and cdk6) in turbot (Scophthalmus maximus) were sequenced using homologous cloning and 5'/3'-RACE. The open reading frames of cdk1 and cdk6 were 912 bp (GenBank accession number,KP339306) and 978 bp (GenBank accession number,KT186374),respectively. Gene expression in turbot tissues was analyzed using RT-PCR. The results showed that both cdk1 and cdk6 were widely expressed in several turbot tissues. cdk1 expression levels were higher in the gonads and kidneys than in other organs,and cdk6 expression level was the highest in the gonads. cdk1 and cdk6 expression levels in turbot embryos were studied using real-time RT-PCR. In the control group,cdk1 expression levels were higher at the gastrula stage and earlier compared to those at the neurula stage and later,and cdk6 expression level at the gastrula stage was the highest. Trend variation pertaining to cdk1 and cdk6 expression levels in the hydrostatic pressure treatment group (tetraploid induction group)was similar to that in the control group,except for the expression level,which was lower in the treatment group than in the control group. Hydrostatic pressure treatments had different effects on cdk1 and cdk6 expression levels,suggesting cdk1 and cdk6 in turbot to have different functions. The above results could provide a basis for the analysis of functions and mechanisms of the two genes in turbot embryo development.

