牛大力总黄酮抗氧化作用的研究
曹志方 ,杨雨辉,郝赫宣,姜亚磊,姚 倩,陈 涛
(1. 海南大学 农学院,海南 海口 570228;2.海南省热带动物繁育与疫病研究重点实验室,海南 海口 570228)
牛大力总黄酮抗氧化作用的研究
曹志方1,杨雨辉2,郝赫宣1,姜亚磊1,姚倩1,陈涛1
(1. 海南大学 农学院,海南 海口 570228;2.海南省热带动物繁育与疫病研究重点实验室,海南 海口 570228)
摘要:为了研究牛大力总黄酮(Flavonoids from Millettia specisoa Champ,以下简称FMSC)的抗氧化作用,通过制备牛大力总黄酮,分别测定了其体外和体内的抗氧化活性,FMSC的体外抗氧化活性结果表明: FMSC对DPPH·,OH·,O2·自由基有较强的清除能力,其IC50分别为31.50 μg/mL,225.04 μg/mL,115.39 μg/mL;此外,它对金属离子还具有较强的螯合和还原能力;在小鼠体内试验中,与模型组比较,FMSC不仅能降低小鼠血清中的BUN(29.63%) 含量和提高T-AOC (58.89%)的活性(P<0.05),而且它还能提高肝组织中的T-SOD (43.99%),CAT(47.33%)和GSH-Px(40.76%) 酶的活性和GSH(62.17%)的含量(P<0.05),此外,它还能降低MDA(36.53%)的含量(P<0.05).由此可得出:FMSC在机体内外的抗氧化作用存在差异,其在体外的作用强于其在体内的作用,整体而言,其抗氧化活性较强,且具有多途径和多方面参与抗氧化的特点.
关键词:牛大力; 黄酮; 抗氧化; 自由基
黄酮类化合物(flavonoids)是一类广泛存在于自然界中,且具有2-苯基色原酮结构的天然化合物,是许多中草药的有效成分.现已发现黄酮化合物有上万种,多以游离或与糖结合成苷的形式存在.黄酮类化合物的种类、含量存在很大差异,因而其药理作用也不尽相同,研究表明,黄酮类化合物的主要药理作用是保护心脑血管、清除自由基、抗氧化、利胆保肝、抗癌、抗菌、抗过敏、抗炎症和抗病毒.近年来,关于黄酮类化合物的抗氧化作用备受关注,并有望将其开发成为天然抗氧化剂,发挥其预防疾病和延缓衰老的作用.
牛大力,别名为山莲藕、大力薯等,为豆科崖豆藤属美丽崖豆藤(MillettiaspecisoaChamp)的干燥根茎.临床上已证明其对腰痛、肾虚带下、风湿性关节炎、腰肌劳损、慢性肝炎、病后体虚有显著疗效.有文献报道,牛大力提取物有较好的抗氧化能力,并推测其可能与黄酮类化合物有关[1];另有研究表明,牛大力生药中总黄酮的含量较高,其提取率高达2.14%[2].但是,到目前为止,尚未见关于牛大力总黄酮抗氧化作用的研究报道,为了深入地研究牛大力的药理作用,本研究通过体内和体外实验的方法评价了牛大力中总黄酮的抗氧化和抗衰老活性, 以期为牛大力天然抗氧化剂和天然保健品的开发提供理论和实验的依据.
1材料与方法
1.1实验药品与试剂牛大力,购于海南源安隆大药堂,经海南大学农学院王金花副教授鉴定,其为豆科崖豆藤属植物—美丽崖豆藤的干燥根茎;芦丁标准品(购自阿拉丁公司,D1515108);Vc(Solarbio公司,305D036);DPPH(武汉艾科化学试剂公司,201503101);菲洛嗪(Aladdin公司,L1416039);EDTA-Na(Dojindo公司,DE140);Ve(上海庆安药业集团宿州制药有限公司,141102);D-半乳糖(购自Sigma公司,C1518010);硫酸亚铁,氯化亚铁,氯化铁,三氯乙酸,硝酸铝,亚硝酸钠,氢氧化钠(均为分析纯).
1.2实验动物 昆明种小白鼠,SPF级,购于长沙市天勤生物技术有限公司,许可证号SCXK(湘)2014-0011,实验前分笼预养3d.
1.3实验测定试剂盒羟基自由基、抗超氧阴离子自由基、总抗氧化能力(TotalAntioxidantCapacity,T-AOC)、尿素氮(BloodUreaNitrogen,BUN)、丙二醛(Malondialdehyde,MDA)、总超氧化物歧化酶(TotalSuperoxideDismutase,T-SOD)、谷胱甘肽过氧化物酶(GlutathionePeroxidase,GSH-Px)、还原性谷胱甘肽(Glutathione,GSH)、过氧化氢酶(Catalase,CAT)、一氧化氮合酶(NitricOxideSynthase,NOS)分型、考马斯蛋白测定试剂盒,均购自南京建成生物工程研究所.
1.4方法
1.4.1牛大力总黄酮(FMSC)的制备及含量测定牛大力粉碎样品,过80目筛,80 ℃持续烘干6h,干燥冷却后称取2kg,加φ=95 %的乙醇溶液(料液比1g∶20mL),超声辅助提取3次,每次2.0h.抽滤后收集所有滤液,加入φ=15 %的三氟乙酸溶液以沉淀蛋白,静置沉淀后再过0.2μm孔径的滤膜.以w=4 %的氢氧化钠溶液调节滤液pH值至中性.所得滤液经减压浓缩后得到浓缩浸膏,然后再加入少量水分散后,离心(5 000r/min),收集沉淀.沉淀经适量无水乙醇再次完全溶解后,重复浓缩与析出结晶过程2次.最后所得到的沉淀经低温、冷冻、干燥后即为黄酮试样.以芦丁为标准测出黄酮样品的质量分数为81.24 %.
1.4.2FMSC体外抗氧化活性的测定
1.4.2.1FMSC对DPPH的清除作用反应体系包含2mL不同浓度的FMSC乙醇溶液和2mL0.1mmol·L-1的DPPH-乙醇溶液,于暗光处室温放置30min后,在517nm波长下测定溶液的吸光度[3].空白校准用乙醇溶液代替DPPH溶液.对照组用乙醇代替试样.相同浓度系列的维生素C(Vc)组作为阳性对照,清除率=(Ac-Ab)/(Ac-A0)×100%.
注:Ab为测定样品的吸光度,Ac为对照组的吸光度,A0为空白校准的吸光度.
1.4.2.2FMSC对羟基自由基(OH·)的清除作用采用抗羟基自由基试剂盒测定试样清除羟基自由基的能力,空白校准由蒸馏水代替样品和H2O2,吸光度为A0.对照组由蒸馏水替代样品,吸光度为Ac.以相同浓度系列的Vc组为阳性对照,清除率=(Ac-Ab)/(Ac-A0)×100%.
1.4.2.3FMSC对超氧阴离子(O2-)的清除作用采用抗超氧阴离子自由基测试盒测定试样清除超氧阴离子的能力,空白校准由蒸馏水代替样品和H2O2,吸光度为A0.对照组由蒸馏水替代样品,吸光度为Ac.以相同浓度系列的Vc组为阳性对照,计算出试样对超氧阴离子自由基的影响能力,清除率=(Ac-Ab)/(Ac-A0)×100%.
1.4.2.4FMSC对金属离子螯合力的测定[4]EDTA-Na对照曲线的绘制:取不同浓度的EDTA-2Na溶液1mL,加入6.7mL的水,0.2mLφ=0.1 %的菲洛嗪和0.1mLφ=0.35 % 的氯化亚铁,混合均匀后,在562nm处测定其吸光度值,并用蒸馏水代替样液做空白实验.
样品的测定:取1mL不同浓度的试样,按上述方法测得吸光度,并以蒸馏水代替样品做吸光度值.以相同浓度系列的Vc组作为阳性对照.
实验结果以螯合率来表示样品抗氧化程度的大小,螯合率=(A0-A1)/A0×100% ,
注:A0表示空白实验的吸光度,A1表示样品的吸光度.同时参照EDTA的螯合率来评价样品螯合率的大小,从而得出样品抗氧化能力的大小.
1.4.2.5FMSC还原力的测定采用铁氰化钾法测定还原能力[5],反应体系包括2.5mLpH6.6的磷酸盐缓冲液,2.5mLw=1 %的铁氰化钾溶液,样品液2.5mL,混合均匀后于50 ℃水浴反应20min;冷却后加入2.5mLφ=10 %的三氯乙酸溶液,以3 000r/min离心10min;取上清液5mL,加入1mLw=0.1 % 的FeCl3溶液和5mL蒸馏水,混匀,静置5min后,于700nm波长下测定其吸光度.测得的吸光度值越高,则表示待测物的还原能力越强.
1.4.3FMSC体内抗氧化活性的研究
1.4.3.1最佳给药方式及最大耐受量(MTD)的确定选取小鼠20 只,随机分为2组,分别采用灌胃和腹腔注射的方式给予高浓FMSC液,每天给药2次,给药量为每10g体质量0.1mL,连续10d,观察小鼠的外观、行为、精神状态、给药部位及死亡情况,比较后确定最佳的给药方式,最后计算出MTD值.
1.4.3.2动物分组、模型制备和给药选取健康的昆明小鼠60只,体重(22.5±1.4)g,随机分为6组,即正常对照组、模型对照组、Ve对照组、FMSC的高、中、低剂量组[0.16g·(kg·d)-1,0.04g·(kg·d)-1,0.01g·(kg·d))-1]建模时,除正常组注射等量生理盐水(每10g体质量0.1mL)外,其余各组每天均经腹腔注射D-半乳糖生理盐水[120mg·(kg·d)-1].连续建模2周后开始给药,根据耐受实验确定所有组均采用腹腔注射给药,正常组和模型组给予等量的生理盐水,持续给药3周.正常饲喂,每2天测定和记录各组平均采食量及小鼠体重1次,同时参考所测定的体重变化,及时调整当天的给药量.
1.4.3.3日常相关项目的记录和后续检测除记录各组小鼠日常采食及体重变化外,每天还应观察小鼠生理、行为和精神状态的变化.持续给药3周后, 于最后一次造模和给药后6h称重, 各小鼠摘眼球取血,3 000r·min-1离心10min,分离血清,低温保存备用.将小鼠立即断颈椎处死, 迅速取肝脏、肾脏、胸腺、脾脏,用预冷的生理盐水冲洗,并以滤纸吸干、称重,同时计算各脏器系数,脏器系数=脏器重量(g)/体重(g)×100 %.
取血清,按试剂盒说明书分别测定其血清总抗氧化能力和BUN含量;取肝脏,在冰水浴中制备w=10 %的肝匀浆,并按试剂盒说明书分别测定肝脏总蛋白、T-SOD、T-SOD、GSH-Px、CAT和TNOS/iNOS的活性以及GSH和MDA的含量.
1.5统计分析使用SPSS19 .0 统计软件进行统计比较,同时采用单因素方差分析中的LSD方法对组间差异显著性进行多重比较检验.
2结果与分析
2.1FMSC的体外抗氧化能力

2.1.1FMSC对DPPH的清除作用DPPH是一种较稳定的自由基, 当反应体系中存在质子供体(如抗氧化剂)时将会被清除,具体表现为溶液的吸光度降低[6].基于这一原理,用清除DPPH自由基的能力能够评价物质的抗氧化活性.由图1可以看出:牛大力黄酮类提取物对DPPH自由基具有较高的清除率,质量浓度与清除率呈正相关,FMSC的IC50值为31.50μg·mL-1.
2.1.2FMSC对羟基自由基(OH·)的清除作用
羟基自由基是一种重要的氧自由基,由氢氧根失去一个电子形成.在人体中如果大量存在羟基自由基,将会杀死红细胞,降解DNA、脂类和多糖等化合物,从而造成许多有害效应,当加入羟基自由基的清除剂后则会明显降低这类危害.因此,抗氧化物质清除羟自由基的能力常被作为评价抗氧化剂抗氧化功效的重要指标[7].从结果可以看出(见图2),FMSC和Vc对OH·自由基有较强的清除作用,随着其质量浓度的增大,其清除作用增强;其IC50值为225.04μg·mL-1,且当质量浓度高于200μg·mL-1时,等质量浓度的FMSC的清除能力开始强于Vc的清除能力.
2.1.3FMSC对超氧阴离子(O2-)自由基的清除作用该反应的机理是:通过黄嘌呤与黄嘌呤氧化酶反应产生超氧阴离子自由基,在加入电子传递物质和显色剂后,溶液将显紫红色,此时测得溶液的吸光度与O2-的量成正比关系;而当反应液中存在超氧阴离子自由基抑制剂时,O2-将减少,溶液的吸光度将降低[8].从结果可以看出(见图3),FMSC对超氧阴离子自由基有着较强的清除作用,且同等质量浓度下FMSC清除超氧阴离子自由基的能力强于Vc,FMSC的IC50值为115.39μg·mL-1.

2.1.4FMSC对金属离子的螯合力抗氧化物质通常可以作为金属离子的螯合剂,进而防止金属离子对细胞或组织造成氧化损伤[4],螯合率愈大, 表明抗氧化剂潜在的抗氧化能力就愈强.因此,测定抗氧化剂对金属离子的螯合率就成为评价抗氧化能力常用的方法.由图4可以看出:EDTA-Na有极强的金属螯合能力,在质量浓度为168μg·mL-1时,其螯合率为98.40 % ;FMSC对Fe2+具有较高的螯合率,在其质量浓度为200μg·mL-1时,FMSC对Fe2+的螯合率为89.44 %,相当于EDTA-Na的88.16 %;且在相同质量浓度条件下,FMSC对Fe2+的螯合率始终高于Vc.
2.1.5FMSC对Fe3+的还原力还原力是评价物质抗氧化能力的重要指标之一, 抗氧化剂的供电子能力越强则还原力越强, 其抗氧化能力也越强.在实验条件下,越多的Fe3+被还原成Fe2+,溶液的吸光度将越大,则表示抗氧化剂的还原力越强.根据实验结果可知(图5):随质量浓度的提高,FMSC和Vc对Fe3+的还原能力均逐渐增加.

2.2FMSC的体内抗氧化活性
2.2.1 最佳给药方式及MTD值2种给药方式的小鼠均未出现死亡的情况,灌胃组的小鼠在连续给药后出现身体消瘦、轻微掉毛、精神萎靡及给药部位(咽喉)炎症;而腹腔注射组的小鼠其精神与活动状态正常,解剖后其腹腔未出现异常.因此确定腹腔注射为最适宜的给药方式,且确定小鼠对注射的最大耐受值为2.24g·(kg·d)-1.
2.2.2各组小鼠体重的增长情况 采用D-半乳糖亚急性中毒法建立衰老动物模型是模仿小鼠自然衰老的方法,D-半乳糖亚急性中毒会严重干扰小鼠正常的糖代谢,进而造成其进一步的代谢紊乱,导致其代谢能力的不稳定或降低,具体表现为生长速度减缓[9].由图6结果可以看出,在正常组中,小鼠的体重保持稳定且呈较快的增长趋势;而与正常组的小鼠比较,长期注射D-半乳糖会明显减缓各组的小鼠的体重增长,且同期体重均偏小;在给予药物处理后,实验组小鼠的生长速度开始恢复(最高达到日增重0.625g),并逐渐接近正常组水平(最大日增重0.650g).这表明一定剂量的FMSC能改善致衰老小鼠的生长状况.
2.2.3FMSC对小鼠各脏器系数的影响 肝脏是体内主要的代谢器官,过量的活性氧会造成肝脏细胞的氧化损伤,改变细胞的通透性,从而造成肝细胞肿胀.肾脏则具有过滤体内无用或有害代谢产物的功能,血液中过量的活性氧会造成肾细胞的损伤,改变组织结构的通透性[10-11].由结果可知(见图7),与正常组相比, 模型对照组小鼠的肝脏、肾脏系数升高(P<0 .05);而胸腺、脾脏系数降低(P<0 .05).与模型组比较,FMSC药物组小鼠的肝脏、肾脏系数升高(P<0 .05);而胸腺、脾脏系数变化不明显,无统计学意义(P>0 .05),这表明FMSC能够降低D-半乳糖的不完全代谢对肝、肾器官的损伤程度,而与免疫调节无关.

2.2.4FMSC对小鼠血清T-AOC活性及BUN含量的影响血清中总抗氧化能力(T-AOC)可以反映机体非酶抗氧化剂的活性.本实验中,FMSC各剂量组均可提高血清T-AOC的活性,其中,高剂量组[(15.87±3.02)U·mL-1]显示较高水平[正常组水平为(14.21±2.87)U·mL-1],这表明FMSC能够直接清除体内的ROS,且其抗氧化能力与剂量呈正相关.BUN是蛋白、脂类的代谢产物,与正常组[(167.25±30.82)mg·L-1]比较,模型组小鼠血清中的BUN[(208.85±39.48)mg·L-1]含量明显升高,这表明大剂量的D-半乳糖加剧了模型小鼠体内的脂质过氧化水平;在FMSC中剂量组(155.14mg·L-1)、高剂量组(146.96mg·L-1)中小鼠血清中的BUN含量降低,这表明一定剂量的FMSC可减少脂质过氧化产物的生成,其作用与抗脂质过氧化有关.

2.2.5FMSC对小鼠肝脏中清除氧化自由基的抗氧化酶系的影响T-SOD,GSH-Px,CAT是机体自我产生的重要内源性抗氧化剂,又称细胞抗氧化剂[12].T-SOD能特异性地清除O2-,而GSH-Px和CAT则能够特异性地清除OH·[13],它们代表了机体中酶抗氧化剂的活性.由图9可知:与正常组比较[每毫克Prot的活性为(127.32±5.17),(68.73±8.50),(41.49±6.91)U],在模型对照组中,小鼠肝脏组织中的T-SOD[每毫克Prot的活性为(84.54±6.70)U]、GSH-Px[每毫克Prot的活性为(43.84±5.83)U]及CAT[每毫克Prot的活性为(33.52±12.31)U)]活性均明显降低(P<0.05),这表明致衰老小鼠的抗氧化能力被抑制.治疗后,阳性对照组和FMSC各剂量组中小鼠肝脏组织中的T-SOD、GSH-Px及CAT活性均有所升高(P<0.05),表明FMSC能够通过增强内源性抗氧化酶的活性来增强机体整体的抗氧化能力.

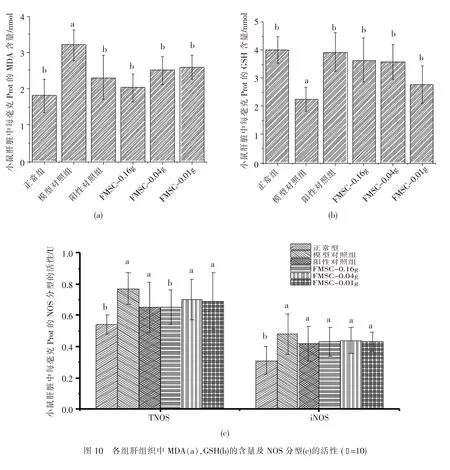
2.2.6FMSC对小鼠肝组织中的MDA,GSH含量及NOS分型活性的影响MDA是体内脂质过氧化的代谢产物,是评定机体自身脂质过氧化程度的重要指标之一;GSH是GSH-Px酶特异性清除OH·自由基的底物,组织中的GSH含量既反映了机体的健康状态,又反映了清除OH·自由基的能力[14];NOS是调控机体内NO合成的关键酶,NO是一种具有气体分子信使功能的气体自由基,近年来的研究表明,NO具有生物效应双相性,即既具有抗氧化作用,又具有促氧化作用,NO不足或过量均可引起组织损伤[15].由结果可知(图10):与模型组比较,FMSC各剂量组均使MDA降低36.53%(P<0.05);使GSH含量升高62.17%(P<0.05),恢复到正常水平的90.78%;而对NOS分型的活性则无明显改变(P>0.05).MDA降低和GSH恢复到正常水平证实了致衰老小鼠体内的抗氧化能力得到增强,这又进一步证实了FMSC具有显著的抗氧化活性.
3讨论
本实验采取低温提取、析出重结晶、全程无强氧化物质参与的方法,以期提取到更多抗氧化物质,并保证提取物化学性质的稳定,经芦丁标定测得总黄酮样品的纯度大于81.24 %.生物体内的抗氧化作用主要是通过2条途径实现,一是抗氧化物质直接清除自由基;另一个是提高机体内源性抗氧化酶(如T-SOD,GSH-Px,CAT等)的活性[16-17].目前,关于天然提取物抗氧化能力的研究也主要针对这两个方面进行.对DPPH,OH·,O2-自由基的清除和对金属离子的螯合以及还原能力的测定主要是利用了黄酮类物质本身的化学结构(如共轭双键体系,邻苯二酚结构)[18]和特殊的化学基团(如酚羟基)[19]所表现出化学性质,直接通过氧化还原、合成、催化等反应的方式来改变自由基、金属离子的电化学性质,从而起到转化或减弱自由基氧化能力的目的.在本研究中,FMSC对DPPH,OH·,O2-自由基的清除能力、对铁离子的还原力以及对金属离子的螯合能力均表现出较好的抗氧化活性(见图1—5).
将黄酮类化合物作为天然的抗氧化活性成分进行研究,不仅要研究它的体外抗氧化能力,更重要的是要研究其在进入体内后是如何参与抗氧化调节和代谢的,它对机体的抗氧化作用能否起到积极作用.本研究在体外部分的结果表明:牛大力总黄酮在整体上具有强的抗氧化活性,而从体内抗氧化部分的结果也发现,FMSC在血清中提升T-AOC的(58.89%)活性要高于阳性对照组(56.67%),这证实了体外抗氧化的结果;牛大力总黄酮对致衰老小鼠的生长情况虽有一定的积极作用,但均弱于阳性对照组;在升高肝组织中T-SOD(43.99%),CAT(47.33%),GSH-Px(40.76%)的酶活性及GSH(62.17%)的含量(P<0.05)和降低MDA(36.53%)的含量(P<0.05)方面,与阳性对照组基本相当,并未表现出在体外实验中的明显抗氧化活性.有文章报道过,一些黄酮类化合物在体外实验中表现出强抗氧化活性,而在体内的抗氧化作用却有所减弱,研究人员推测这可能与黄酮类化合物的体内代谢和作用途径有关[20]而它是否在进入体循环后与结合物和代谢物的性质等影响因素有关,尚无法确定,这尚有待于进一步的研究.
参考文献:
[1] 郑元升.牛大力多糖的提取及其药理活性研究[D].广州:暨南大学,2009.
[2] 宗鑫凯, 赖富丽, 王祝年, 等.牛大力化学成分研究[J].中药材,2009,32(4):520-521.
[3]ZhangQB,YuPZ,ZhouGF,etal.StudiesonantioxidantoffucoidanfromLanminarikjaponica[J].ChinTroditHerbDrugs,2003,34:824-826.
[4]DeckerEA,WelchB.Roleofferritinasalipidoxidationcatalystinmusclefood[J].JournalofAgriculturalandFoodChemistry,1990,38(3):674-677.
[5]QinCG,HuangKX,XuaHB.Protectiveeffectofpolysaccharidefromtheloachontheinvitroandinvivoper-oxidativedamageofhepatocyte[J].JournalofNutritionalBiochemistry,2002,13(10):592-593.
[6]AmarowiczR,PeggRB,RahimiMoghaddamP,etal.Free-radicalscavengingcapacityandantioxidantactivityofselectedplantspeciesfromtheCanadianprairies[J].FoodChemistry,2004,84(4):551-562.
[7] 辛波,陈卫军,夏秋瑜,等.金属离子对椰花汁清除超氧阴离子能力的影响[J]. 热带作物学报,2009,8:1069-1074.
[8] 朱亚珍,朱虹光.D-半乳糖致衰老动物模型的建立及其检测方法[J].复旦学报:医学版,2007,4:617-619.
[9]WinterbournCC,HamptonMB.Thiolchemistryandspecificityinredoxsignaling[J].FreeRadicBiolMed,2008,45(5):549-561.
[10]AssimopoulouAN,PapageorgiouVP.RadicalscavengingactivityofAlkannatinctoriarootextractsandtheirmainconstituents,hydroxylnaphthoquinones[J] .PhysiotherRes,2005,19(2):141-147.
[11] 陈 兵,贺娟,张春斌.氧化应激的原理及作用[J]. 黑龙江医药科学,2014,6:2-3.
[12] 方允中, 郑荣梁.自由基生物学的理论与应用[M].北京:科学出版社,2002.
[13] 马 森.谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J]. 动物医学进展,2008,10:53-56.
[14] 孙华斌,于秀欣.自由基和抗氧化剂生物效应的双相性理论模型及核化生损伤医学防护的应用研究[J]. 数理医药学杂志,2014,1:1-5.
[15]GronebergDA,Grosse-SiestrupC,FischerA.Invitromodelstostudyhepatotoxicity[J].ToxicolPalhol,2002,30:394-399.
[16]ToyokuniS,TanakaT,KawaguchjNR,etal.EffectsofthephenoliccontentsofMauritianendemicplantextractsonpromoteractivitiesofantioxidantenzymes[J].FreeRadicRes,2003,37:1215-1224.
[17] 钟建青,李波,贾琦,等.天然黄酮类化合物及其衍生物的构效关系研究进展[J]. 药学学报,2011,6:622-630.
[18] 刘永芹,高洪伟,卫涛,等.酚羟基取代异黄酮类化合物的抗氧化活性理论筛选[J]. 计算机与应用化学,2013,5:531-536.
[19] 吕娜.黄酮类化合物的抗氧化性与其化学结构的关系[J]. 现代养生,2014,22:31.
[20] 高永贵, 王岳飞, 杨贤强, 等.脂溶性茶多酚抗油脂氧化及其增效剂的研究[J].中国粮油学报,2000,15(3):54-58.
收稿日期:2015-11-27
基金项目:中西部计划中的学科重点领域的建设项目(ZXBJH-XK002)
作者简介:曹志方(1989-),男,安徽安庆人,海南大学农学院2013级硕士研究生,E-mail:990038104@qq.com 通信作者: 杨雨辉(1971-),男,黑龙江绥化人,教授,研究方向:兽医药理与毒理研究,E-mail:yanguniverse@sina.com
文章编号:1004-1729(2016)02-0161-09
中图分类号:R 285.5
文献标志码:ADOl:10.15886/j.cnki.hdxbzkb.2016.0025
Antioxidant Activity of Flavonoids from Millettia specisoa Champ
Cao Zhifang1, Yang Yuhui2, Hao Hexuan1, Jiang Yalei1, Yao Qian1, Chen Tao1
(1.AgriculturalCollege,HainanUniversity,Haikou570228,China;2.HainanKeyLabofReproductionandEpidemicDiseaseResearch,Haikou570228,China)
Abstract:In the study, to analyze the antioxidant activity of the flavonoids from Millettia specisoa Champ (FMSC), the flavonoids from M. specisoa were prepared and its antioxidant activity was determined in vitro and in vivo. The results indicated that FMSC has strong scavenging activity on DPPH·, OH·, O2·free radicals, the value of IC50was 31.50 μg·mL-1, 225.04 μg·mL-1, and 115.39 μg·mL-1, respectively; FMSC has the strong ability of chelating and reduction; FMSC reduce BUN concentration (29.63%) in serum and elevate the activity of T-AOC (58.89%) (P<0.05), improve total superoxide dismutase (T-SOD) (43.99%), the activity of catalase (CAT) (47.33%) and GSH-Px (40.76%) and the content of GSH (62.17%) (P<0.05). FMSC reduce the content of MDA (36.53%) (P<0.01). In summary, the antioxidant activity of FMSC are different in vitro and in vivo, however, the FMSC has strong antioxidant activity, and involve antioxidant process in different pathways.
Keywords:Millettia specisoa Champ; Flavonoids; Anti-oxidation; ROS

