斜带石斑鱼Frizzled 4基因的克隆及表达分析
陈华谱,洪 广,邓思平,朱春华,李广丽,陈 燕,黄 海,李水生
(1.广东海洋大学 水产学院,海洋生态与养殖环境湛江市重点实验室,广东 湛江 524088;2.海南热带海洋学院,海南 三亚 572022; 3.中山大学 生命科学学院,广东 广州 510275)
斜带石斑鱼Frizzled4基因的克隆及表达分析
陈华谱1,洪广1,邓思平1,朱春华1,李广丽1,陈燕2,黄海2,李水生3
(1.广东海洋大学 水产学院,海洋生态与养殖环境湛江市重点实验室,广东 湛江 524088;2.海南热带海洋学院,海南 三亚 572022; 3.中山大学 生命科学学院,广东 广州 510275)
摘要:利用同源克隆和RACE的方法,从斜带石斑鱼(Epinephelus coioides)卵巢中克隆了Frizzled4(gFZD4)的全长cDNA序列.gFZD4 的cDNA序列全长2 033bp,其中开放阅读框1 596bp、编码531个氨基酸.氨基酸序列比对和系统树分析显示,gFZD4的结构十分保守,斜带石斑鱼与鲈形目罗非鱼的亲缘关系最近.RT-PCR分析表明,gFZD4基因在斜带石斑鱼组织中广泛表达,其中脑、肾脏、心脏和腮组织的表达量较高.荧光定量PCR检测结果显示,gFZD4基因的表达水平在胚胎发育的早期较低、在桑葚期显著升高、在囊胚期最高,其后除了肌节形成期外均基本与桑葚期的表达水平相似;gFZD4基因在卵巢发育过程中表达水平较低,而在性逆转的精巢发育过程中表达水平显著升高,表明gFZD4介导的Wnt信号通路在石斑鱼的性逆转过程中可能发挥了重要作用.
关键词:斜带石斑鱼; 卷轴受体4; 性腺发育; 性逆转
Wnt信号转导通路是机体重要的信号通路之一,参与生长发育、免疫和生殖等重要生命活动[1],需要细胞表面的Frizzled(FZD)介导[2].FZD基因最早是从果蝇的突变体中被发现和鉴定出来的,其突变会破坏成年果蝇表皮细胞的极性[3],后来在许多动物中均发现了FZD基因.FZD是多亚型基因家族,在果蝇中已经发现了4种亚型,在秀丽隐杆线虫中已经发现了3种,在人类中已经克隆鉴定了10种,通过基因比对预测斑马鱼中可能存在9种FZD基因亚型.FZD基因的生理功能目前尚不十分清楚[4].
FZD4 是FZD家族中最受关注的成员之一.早期的研究已经证实FZD4在眼睛和血管系统发育过程中发挥十分重要的作用[5],其突变会引起家族性渗出性玻璃体视网膜病变(familialexudativevitreoretinopathy,FEVR)[6].随着生理功能研究的不断深入,更多的关注集中于FZD4在生殖调控中的作用.研究发现,FZD4mRNA在人卵巢的粒层细胞中大量表达[7];FZD4在啮齿动物卵巢中的表达受雌激素调控,并广泛存在于怀孕和产后的老鼠、兔子的粒层细胞、成长中的卵泡以及黄体细胞中,缺失FZD4基因的小鼠丧失了生育功能,具体表现为黄体形成和功能上的不正常,表明了FZD4基因在生殖发育中的关键性作用[8].因此,FZD4基因被认为是高等脊椎动物中介导Wnt信号在生殖调控中的主导受体亚型[9],但是,尚无研究表明其在鱼类生殖调控中起着类似的生理功能.
本研究以我国南方重要的海水养殖鱼类斜带石斑鱼(Epinepheluscoioides)为研究对象,利用Smart-RACE方法克隆鉴定斜带石斑鱼Frizzled4(gFZD4)基因的cDNA全长序列,进行序列比对分析,并检测gFZD4在斜带石斑鱼的组织器官、不同发育时期的胚胎以及正常卵巢和性逆转过程中卵巢的表达水平,为后续的FZD4介导Wnt信号通路在石斑鱼生殖发育过程中的生理功能及其信号转导机制的研究奠定初步基础.
1材料与方法
1.1材料
1.1.1实验鱼分子克隆及组织表达分析用的斜带石斑鱼取自广东海洋大学东海岛养殖基地.实验鱼被深度麻醉后,将其全脑、垂体、肝脏、卵巢、心脏、肾脏、脾脏、胃、肠、鳃和肌肉等组织器官取出,立即置于液氮保存.不同发育时期的性腺和不同发育时期的胚胎样本取自海南省陵水养殖基地,液氮保存.
1.1.2试剂总RNA提取试剂使用的TrizolReagent购于Life公司(USA),DNaseⅠ和theReverTraAce-αfirst-strandcDNASynthesisKit试剂盒购于TOYOBO公司,Smart-RACE试剂盒购自TakaraClontech公司(Japan),Taq酶和载体pTZ7R/T购于MBIFermentas公司,质粒提取和胶回收试剂盒购自东盛公司, 其余化学试剂均为国产分析纯.
1.2方法
1.2.1引物根据NCBIGenBank中其他物种FZD4基因的cDNA序列的保守序列设计克隆斜带石斑鱼FZD4基因保守部分的简并引物,扩增中间片段序列,进而根据测序后的序列设计用于RACE扩增、开放阅读框扩增、荧光定量PCR等的引物(表l).

表1 斜带石斑鱼gFZD4基因克隆与定量分析所用引物
1.2.2总RNA提取利用注射器抽提或研磨等方法进行组织匀浆,总RNA的提取根据Trizol®reagent试剂盒说明书操作.总RNA的浓度和纯度用紫外分光光度计进行检测,并用0.8%的琼脂糖凝胶电泳检测RNA的完整性.
1.2.3分子克隆与序列分析用卵巢的总RNA作为模板,根据Smart-RCAE试剂盒说明书逆转录合成FZD4基因5’端和3’端的第一链cDNA.克隆获得部分序列后进行3’-RACE和5’-RACE,进而通过拼接得到全长;然后设计开放阅读框全长验证特异引物扩增,最终获得验证的FZD4基因cDNA全长序列.利用DNAtools6.0 软件预测斜带石斑鱼gFZD4基因的开放阅读框(ORF)和相应的氨基酸序列,用DNASTAR软件对不同生物的FZD4序列进行同源性分析.用SignalP3.0 在线分析gFZD4基因的信号肽,用TMHMMServerv. 2.0分析蛋白的跨膜区,并用Mega4.0的邻位相邻法构建蛋白的系统进化树[10-11].
1.2.4组织分布取待测组织器官的总RNA各1μg,分别经DNaseⅠ去除基因组DNA后,按照FirstStrandcDNASynthesisKitReverTraAce-α(TOYOBO,Japan)的说明书进行cDNA的合成;然后用斜带石斑鱼FZD4的特异检测引物(gFZD4-QF和gFZD4-QR)进行FZD4基因在各组织中的半定量检测,以18srRNA基因作为内参,反应体系为20μL;循环反应条件为:94 ℃预变性2min,94 ℃变性20s,55 ℃退火20s,72 ℃延伸20s,40个循环,72 ℃延伸1min.取5μL的PCR产物琼脂糖凝胶电泳,天能Tanon2500R全自动数码凝胶成像分析系统进行拍照与半定量表达分析.
1.2.5性腺组织学分析在取样的过程中,除了液氮保存的样本之外,还取一部分性腺组织于波恩氏液中固定过夜,经脱水、透明和石蜡包埋之后,进行组织超薄切片及苏木素-伊红染色.普通光学显微镜进行观察和拍照.
1.2.6荧光定量PCR构建斜带石斑鱼gFZD4和18srRNA基因的质粒标准样品,将质粒按10倍的梯队逐级稀释,建立质粒标准曲线.按照SYBR®GreenRealtimePCRMasterMix(TOYOBO,Japan)试剂盒说明书反应体系、用RocheLightCycler480realtimePCRsystem进行荧光定量PCR;循环程序为,95 ℃预变性1min, 95 ℃变性5s,55 ℃退火10s,72 ℃延伸20s,84 ℃收集荧光10s,40个循环.每个样品3个重复,根据标准曲线相对应的域值(Cp)获得cDNA拷贝数.数据采用SPSS1.8进行统计分析.
2结果
2.1斜带石斑鱼FZD4 基因的全长cDNA序列斜带石斑鱼gFZD4的cDNA序列全长2 053bp,开放阅读框(ORF)编码多肽有531个氨基酸,其中5’端的26个氨基酸为信号肽(图1).经Expasytools预测,gFZD4基因编码的前体蛋白分子量约为59.1kDa.用InterProScan对斜带石斑鱼gFZD4氨基酸序列进行分析结果显示,gFZD4属于G蛋白偶联型受体蛋白家族,该基因的几个关键的蛋白功能结构域在不同物种中具有高度的保守性:1)细胞外部分有一个富含半胱氨酸的N-末端(cysteinyl-richDomain,CRD),半胱氨酸分别位于FZD4成熟肽的第10、18、55、64、71、82、86、93、110、123、146、165、169位;其后有8个跨膜螺旋的疏水部分.2)细胞内部分包括由八次跨膜而形成的4个环(Loop1、Loop2、Loop3和Loop4),保守的K-T-X-X-W结构域和一个C-末端.

信号肽用下划线标示,N-糖基化位点用“★”标示,富集区的13个半胱氨酸用圆圈标示,八个跨膜
斜带石斑鱼gFZD4氨基酸序列与已知的其他生物的FZD4序列进行同源性分析显示(图2),斜带石斑鱼gFZD4与罗非鱼FZD4的氨基酸同源性最高、为95%,与斑马鱼FZD4的氨基酸同源性也高达80.8%,与其他哺乳类的FZD4的氨基酸序列同源性相对较低.

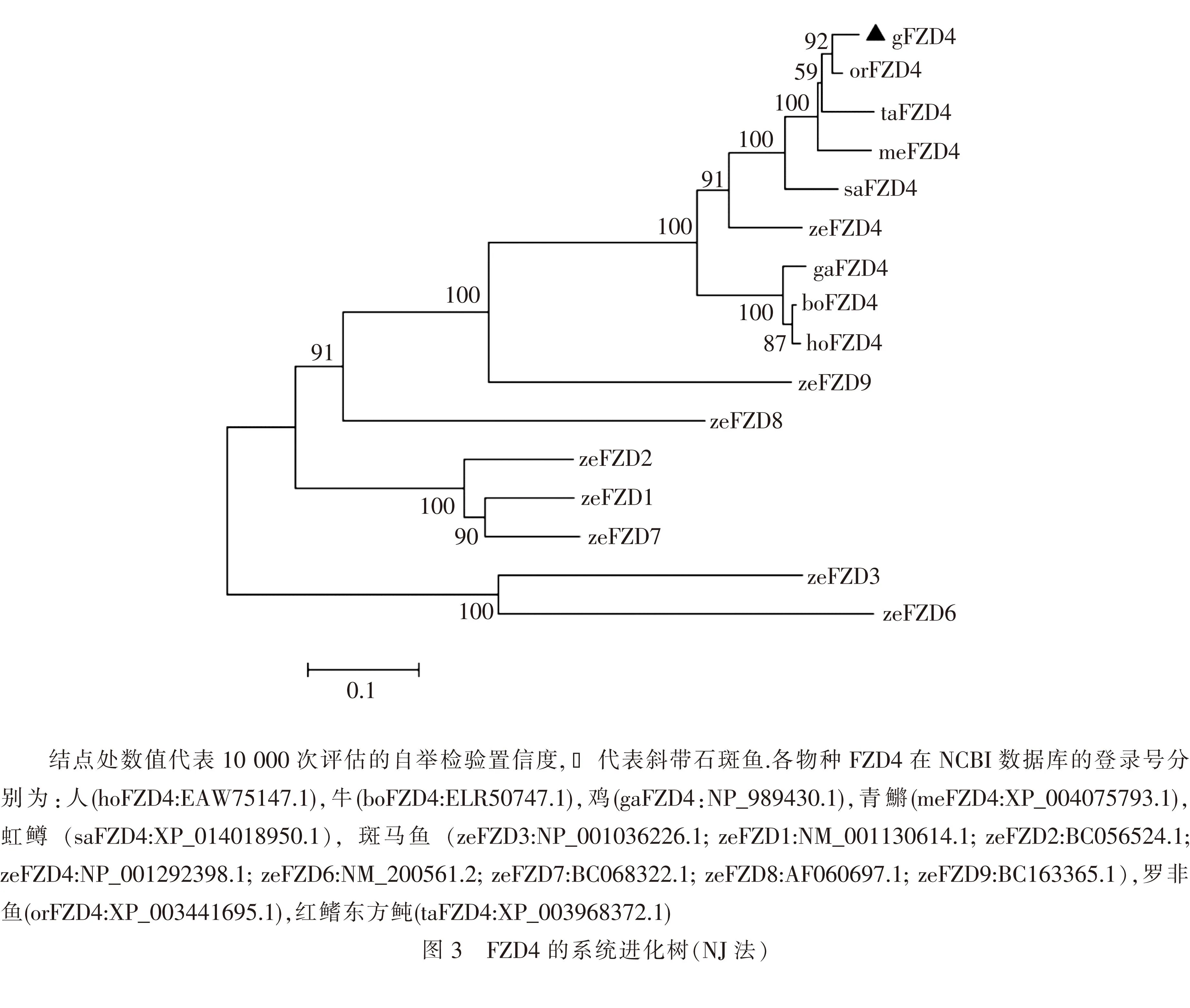
2.2斜带石斑鱼gFZD4的系统进化树分析利用MEGA4.0 的邻位相连算法(neighbor-joiningmethod)构建斜带石斑鱼等动物FZD基因的系统进化树结果(图3)显示:鱼类的FZD4基因聚类为独立的分支,其中石斑鱼的gFZD4基因与同为鲈型目的罗非鱼的亲缘关系最近,与牛和人类等哺乳动物的进化关系较远.以斑马鱼的FZD亚型为参照分析表明FZD4与FZD9的进化关系最近,而与FZD6 和FZD3的关系最远.FZD4前体氨基酸的系统发育关系与传统的动物分类基本一致.
2.3斜带石斑鱼FZD4基因的组织表达差异性RT-PCR半定量的方法分析gFZD4在斜带石斑鱼全脑与外周组织(垂体、肝脏、卵巢、心脏、肾脏、脾脏、胃、肠、鳃和肌肉)的表达结果显(图4)示,gFZD4在脑、心脏、肾脏和鳃中mRNA的表达量很高,在垂体、卵巢、肝脏和脾脏中也有较高的表达水平,而在胃、肠和肌肉中没有检测到FZD4mRNA.

2.4斜带石斑鱼胚胎发育过程中gFZD4基因的表达模式荧光定量PCR分析斜带石斑鱼FZD4基因在胚胎发育不同时期的相对表达量结果(图5)显示,FZD4的mRNA含量在不同的胚胎发育时期呈现显著的差异性.从未受精卵开始,到受精卵、2-细胞期、4-细胞期、8-细胞期、多细胞期,FZD4基因的表达量相近、且表达水平相对很低;gFZD4在囊胚期和肌节形成期表达水平很高,在其他发育时期维持在较高的表达水平.

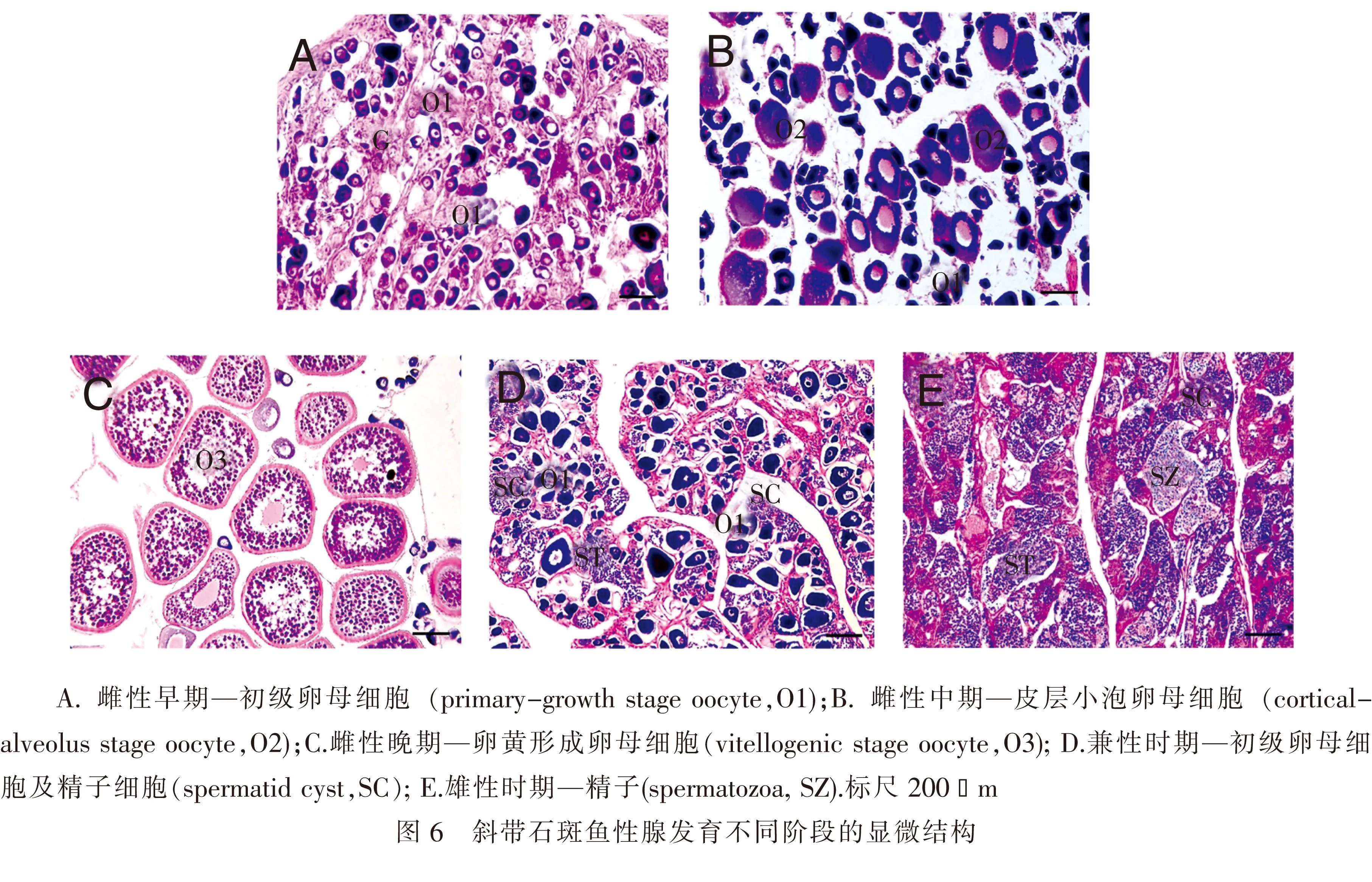
2.5斜带石斑鱼性腺发育过程中gFZD4基因的表达根据石斑鱼雌雄同体、先雌后雄的性腺发育特征, 结合本次样本的性腺切片的组织学分析,可以将斜带石斑鱼卵巢发育时期及天然性逆转时期分别表示为雌性早期、雌性中期、雌性晚期、兼性时期及雄性时期共5个代表性发育时期(图6):1)雌性早期——初级卵母细胞(primary-growthstageoocyte,O1)的卵巢时期,约为1龄;2)雌性中期——皮层小泡卵母细胞(cortical-alveolusstageoocyte,O2)的卵巢时期,约为2龄;3)雌性晚期——卵黄形成卵母细胞(vitellogenicstageoocyte,O3)的成熟卵巢时期,约为3龄;4)兼性时期——初级卵母细胞及精子细胞(spermatidcyst,SC)的性腺时期;5)雄性时期—精子(spermatozoa,SZ).
荧光定量PCR检测这5个斜带石斑鱼性腺发育时期gFZD4基因的表达结果显示,斜带石斑鱼gFZD4基因的mRNA在卵巢发育时期(即雌性早期至雌性晚期)的表达水平相对较低,在随后的雌性向雄性变化的性逆转过程中,表达水平显著升高,而且雄性时期性腺中gFZD4基因的mRNA的水平也显著高于兼性时期(图7).

3讨论
氨基酸序列比对分析表明,斜带石斑鱼gFZD4基因具有Frizzled家族成员保守的分子结构和功能区[4], 显示出较高的保守性.斜带石斑鱼gFZD4属于G蛋白偶联型受体蛋白家族,但具有8个疏水性的跨膜区,区别于传统的7个跨膜区的膜蛋白.斜带石斑鱼gFZD4基因的胞内部分均含有K-T-X-X-W和S/T-X-V结构域[12],其中K-T-X-X-W结构域是FZD蛋白参与Wnt/β-Catenin经典信号通路的特异结构域[13],而S/T-X-V结构域能则与带有PDZ结构域的蛋白质相互作用,介导Wnt非经典信号通路[14].因此,斜带石斑鱼gFZD4基因同时具有介导Wnt信号通路的经典与非经典途径,暗示其具有更广泛的介导功能.
斜带石斑鱼gFZD4基因的mRNA在脑、肾脏、心脏和腮中的表达水平很高,在垂体、肝脏、卵巢和脾脏中也有较高水平的表达,但是在胃、肠和肌肉中没有被检测到,这与FZD4基因的mRNA在人类组织中的表达特征相类似[15].斜带石斑鱼gFZD4在与生殖调控相关组织中的高表达,表明FZD4基因在生殖调控中的保守功能[7-9].
斜带石斑鱼gFZD4基因mRNA的表达水平在胚胎发育的不同时期存在显著的差异性,在胚胎发育的早期表达量均较低,在囊胚期的表达量最高,这表明该基因参与了胚胎早期的发育,FZD具有调节细胞的不对称分布和参与原肠胚形成的功能[16].斜带石斑鱼gFZD4在囊胚期之后均维持较高的表达水平,表明斜带石斑鱼gFZD4在此后的胚胎发育过程中持续发挥作用,但是其具体的功能目前尚不清楚.
斜带石斑鱼是雌雄同体、先雌后雄的重要经济海水鱼类,其鲜明的性别转换特性使其成为了研究性别调控机制的重要生物模型.哺乳类动物的研究结果显示,敲除FZD4基因时会导致严重的生殖缺陷和不育,表明FZD4在哺乳动物的生殖调控中扮演了十分重要的角色.gFZD4在斜带石斑鱼性别转换的过程中和雄性性腺中表达量很高,而在雌性性腺中表达量显著较低,因而FZD4可能与雄性性腺的发育形成有关.本研究的结果丰富了鱼类Frizzled基因的相关知识,有助于后续阐明Wnt信号通路在鱼类性别调控中的分子机理.
参考文献:
[1]CadiganKM,NusseR.Wntsignaling:acommonthemeinanimaldevelopment[J].GenesDev,1997,11(24):3 286-3 305.
[2]NusseR.Wntsignalingindiseaseandindevelopment[J].CellRes,2005,15(1):28-32.
[3]KatohM.Wntsignalingpathwayandstemcellsignalingnetwork[J].ClinCancerRes,2007,13(13):4 042-4 045.
[4]DijksterhuisJP,PetersenJ,SchulteG.WNT/Frizzledsignaling:receptor-ligandselectivitywithfocusonFZD-Gproteinsignalinganditsphysiologicalrelevance:IUPHARReview3[J].BrJPharmacol,2014,171(5):1 195-1 209.
[5]Biason-LauberA,KonradD,NavratilF,etal.AWNT4mutationassociatedwithMullerian-ductregressionandvirilizationina46XXwoman[J].NEnglJMed,2004,351(8):792-798.
[6]VainioS,HeikkilaM,KispertA,etal.FemaledevelopmentinmammalsisregulatedbyWnt-4signaling[J].Nature,1999,397(6 718):405-409.
[7]ShiOY,YangHY,ShenYM,etal.PolymorphismsinFZD3andFZD6genesandriskofneuraltubedefectsinanorthernHanChinesepopulation[J].NeurolSci,2014,35(11):1 701-1 706.
[8]ChangCH,TsaiRK,TsaiMH,etal.TherolesofFrizzled-3andWnt3aonmelanocytedevelopment:invitrostudiesonneuralcrestcellsandmelanocyteprecursorcelllines[J].JDermatolSci,2014,75(2):100-108.
[9]KishimotoM,UjikeH,OkahisaY,etal.TheFrizzled3geneisassociatedwithmethamphetaminepsychosisintheJapanesepopulation[J].BehavBrainFunct,2008,4(1):1-7.
[10]HofmeisterW,DevineCA,RothnagelJA,etal.Frizzled-3aandslit2geneticallyinteracttomodulatemidlineaxoncrossinginthetelencephalon[J].MechDev,2012,129(5/8):109-124.
[11]AdlerP.PlanarsignalingandmorphogenesisinDrosophila[J].DevCell,2002,2(5):525-553.
[12]WangY,MackeJP,AbellaBS,etal.AlargefamilyofputativetransmembranereceptorshomologoustotheproductoftheDrosophilatissuepolaritygenefrizzled[J].JBiolChem,1996,271(8):4 468-4 476.
[13]ThompsonJD,HigginsDG,GibsonTJ,etal.CLUSTALW:improvingthesensitivityofprogressivemultiplesequencealignmentthroughsequenceweighting,positionspecificgappenaltiesandweightmatrixchoice[J].NucleicAcidsRes,1994,22(22):4 673-4 680.
[14]KumarS,TamuraK,NeiM,etal.MEGA3:integratedsoftwareformolecularevolutionarygeneticsanalysisandsequencealignment[J].BriefBioinform,2004,5(2):150-163.
[15]MoonRT,BowermanB,BoutrosM,etal.ThepromiseandperilsofWntsignalingthroughβ-catenin[J].Science,2002,296(5 573):1 644-1 646.
[16]KohnAD,MoonRT.Wntandcalciumsignaling:β-catenin-independentpathways[J].CellCalcium,2005,38(3/4):439-446.
收稿日期:2016-02-17
基金项目:广东省海洋渔业科技推广专项(A201408A06);海南省科技合作专项(KJHZ2015-08); 海南省大学生创新创业训练计划项目(20130119);广东省自然科学基金(2015A030313069)
作者简介:陈华谱(1983-),男,广东湛江人,讲师,研究方向:鱼类生理与繁殖,E-mail:chpjwx@163.com 通信作者: 黄海(1974-),男,海南三亚人,博士,研究员,研究方向:水产养殖,E-mail:huanghai74@126.com; 李广丽(1967-),女,吉林延边人,博士,教授,研究方向:鱼类生理,E-mail:guangli211@163.com
文章编号:1004-1729(2016)02-0177-08
中图分类号:S 917.4
文献标志码:ADOl:10.15886/j.cnki.hdxbzkb.2016.0027
Molecular Cloning and Expression Analysis of Frizzled 4 inOrange-spottedGrouper, Epinephelus coioides
Chen Huapu1,Hong Guang1,Deng Siping1,Zhu Chunhua1,Li Guangli1,Chen Yan2,Huang Hai2,Li Shuisheng3
(1.ZhanjiangCityStateKeyLaboratoryofMarineEcologyandEnvironment,FisheriesCollege,GuangdongOceanUniversity,Zhanjiang524088,China; 2.HainanTropicalOceanUniversity,Sanya572022,China; 3.SchoolofLifeSciences,SunYat-SenUniversity,Guangzhou510275,China)
Abstract:In the study, the rapid-amplification of cDNA ends (RACE) was used to isolate the cDNA sequences of Frizzled 4 (gFZD4) of orange-spotted grouper(Epinephelus coioides). The full length gFZD4 cDNA sequence is 2 033 bp. There are 1 596 bp nucleotides in the open reading frame (ORF), and which encodes a putative protein of 531 amino acids. Amino acid alignment analyses results showed that the gFZD4 amino acid sequence was relatively conserved in different vertebrates; according to the phylogenetic analysis, gFZD4 of E. coioides was more closely related to that of Tilapia nilotica L. The tissue distribution analysis by RT-PCR showed that the high expression of gFZD4 was observed in brain, kidney, heart and gill. The expression levels of the gFZD4 during the embryonic development were detected by quantitative real-time PCR analysis. The results showed that gFZD4 were lowly expressed during the early stage of embryonic development, reached the peak during blastula stage, and kept the moderate mRNA level during the subsequent embryonic stages. The expression of gFZD4 during the ovarian and natural sexual change processes were analyzed, the results indicated that the expression level of gFZD4 was low during the ovarian stages, and kept high transcription during the sex change process, which suggested that gFZD4 mediated Wnt pathway play the important roles in sex change of orange-spotted grouper.
Keywords:Epinephelus coioides; Frizzled 4; embryonic development; ovarian development; sex change

