草苁蓉多糖对HepG2细胞氧化应激的抑制作用
全吉淑,王玉娇,尹基峰,高峰,尹学哲,*(.延边大学医学院,吉林延吉3300;.延边大学附属医院,吉林延吉33000)
草苁蓉多糖对HepG2细胞氧化应激的抑制作用
全吉淑1,王玉娇1,尹基峰2,高峰1,尹学哲2,*
(1.延边大学医学院,吉林延吉133002;2.延边大学附属医院,吉林延吉133000)
摘要:研究草苁蓉多糖(BRPS)对过氧化氢(H2O2)所致HepG2细胞氧化应激的抑制作用。以HepG2细胞为研究对象,通过H2O2诱导细胞氧化应激损伤模型,采用四甲基偶氮唑盐比色(MTT)法检测细胞存活率;比色法检测培养液中乳酸脱氢酶(LDH)、谷草转氨酶(AST)、谷丙转氨酶(ALT)活性以及细胞中超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)及丙二醛(MDA)水平;蛋白印迹法测定细胞外信号调节蛋白激酶(ERK)、c-Jun氨基末端激酶(JNK)、p38丝裂原活化蛋白激酶(p38)活化水平。结果表明,BRPS在质量浓度12.5 mg/L~50 mg/L范围内对HepG2细胞存活率无显著影响,对细胞安全。而H2O2诱导使HepG2细胞存活率和抗氧化能力下降,细胞内ERK和JNK磷酸化水平升高。与H2O2模型组相比,BRPS预处理可提高细胞存活率;降低培养液中LDH、AST和ALT活性;降低细胞内MDA含量,升高细胞中SOD活性和GSH含量,降低细胞内ERK和JNK磷酸化水平。提示,BRPS对H2O2所致HepG2细胞氧化应激具有抑制作用,减轻其细胞损伤。
关键词:草苁蓉;多糖;H2O2;氧化应激;HepG2
细胞氧化应激水平的提高能够损伤细胞甚至导致细胞死亡,因此,自由基与多种疾病的关系已越来越引起人们的重视[1-2]。草苁蓉(BoschniakiarossicaFedtsch. et Flerov),俗称不老草,为列当科草苁蓉属多年生寄生性草本植物,具有补肾壮阳、滋补强身、润肠止血、延年益寿的功效;用于治疗肾虚阳痿、腰膝冷痛、膀胱炎、功能性子宫出血、肾炎以及肾脏和膀胱出血等疾病[3]。草苁蓉作为传统中药,其保肝作用研究已有一定积累[3-5],但将其有效成分作用于肝细胞的研究鲜见报道。草苁蓉多糖是其重要活性成分,它无毒,具有免疫增强和抗氧化等功能[5-6]。因此,本试验选人HepG2细胞为研究对象,利用H2O2诱导HepG2细胞氧化应激,研究草苁蓉多糖对肝细胞氧化应激的抑制作用,为阐明草苁蓉多糖保肝机制提供参考。
1 材料与方法
1.1材料
人HepG2细胞:南京凯基生物有限公司;DMEM培养基及胎牛血清(FBS):Gibco公司;四甲基偶氮唑盐比色(MTT):Sigma公司;乳酸脱氢酶(lactate dehydrogenase,LDH)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(reduced glutathione,GSH)、丙二醛(malondialdelyde,MDA)试剂盒:南京建成科技有限公司;小鼠细胞外信号调节蛋白激酶(extracellular signal-regulated kinase,ERK)多克隆抗体、兔c-Jun N-末端激酶(c-Jun N-terminal kinase,JNK)多克隆抗体、兔p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38)多克隆抗体、兔p-ERK多克隆抗体、兔p-JNK多克隆抗体、兔p-p38多克隆抗体:美国Abcam公司。
1.2仪器
D1320型超净工作台:北京东联哈尔仪器制造有限公司;3-30K型离心机:Sigma公司;RT-2100型酶标仪:深圳雷杜公司;DYY-12型电泳仪、DYCP-31D型电泳槽、DYCZ-24DN型电泳仪:北京六一仪器厂;Trans-Blot转印槽:美国Bio-Rad公司;UVP凝胶成像分析仪:美国UVP公司。
1.3方法
1.3.1草苁蓉多糖(Boschniakia rossica polysaccharides,BRPS)的制备[5]
采用醇沉法提取BRPS,用Sevag法除蛋白质,最终得率为4.4%,多糖含量为67.3%。
1.3.2细胞培养及传代[7]
细胞用含10%FBS的DMEM培养液,于37℃、5% CO2、饱和湿度条件下,在细胞培养箱中常规培养。取对数生长期增殖活跃的细胞进行传代并分组。
1.3.3MTT法检测细胞存活率[8]
取对数生长期细胞接种于96孔培养板中,继续培养24 h。加入BRPS溶液使其质量终浓度分别为200、100、50、25、12.5 mg/L。继续培养24 h,吸净培养液,加入5 g/L MTT溶液,MTT法测定细胞存活率。以细胞存活率≥90%为标准确定BRPS对细胞的安全浓度[8]。
细胞存活率/%=实验组/对照组×100
另取一批细胞接种于96孔培养板中,培养24 h后进行分组。对照组、H2O2组(模型组)及BRPS高、低剂量组(质量浓度分别为50、25mg/L)。对照组换入正常培养液;H2O2组加入H2O2使其质量浓度为300 μmol/L;BRPS干预组中加入BRPS使其质量浓度达到相应值,2 h后再加入300 μmol/L H2O2诱导细胞氧化应激损伤。损伤12 h后,每孔加入5 g/L MTT溶液,MTT法测定细胞存活率。
1.3.4细胞培养液中LDH、ALT、AST活性的检测[9]
对数生长期细胞按上述方法分组并诱导氧化应激。收集培养液,按照试剂盒说明书检测培养液中LDH、ALT、AST活性。
1.3.5细胞MDA、GSH含量和SOD活性的测定
细胞在6孔板中进行分组并诱导氧化应激损伤。用胰蛋白酶消化,收集和破碎细胞,离心取上清。按照试剂盒说明书检测细胞内MDA、GSH、SOD水平[9]。
1.3.6蛋白印迹法检测细胞ERK、JNK、p38活化水平[9]
收集、破碎细胞,并提取总蛋白。以20 μg为上样量,进行聚丙烯酰胺凝胶电泳分离蛋白,电转移至PVDF膜上。封闭后,一抗孵育过夜,加相应二抗再反应1 h,加发光底物显迹,采集图像并进行灰度分析。
1.3.7统计学处理
数据以x±s表示,采用SPSS16.5统计软件进行数据处理,组间比较采用单因素方差分析。
2 结果与分析
2.1BRPS对HepG2细胞的安全浓度范围
MTT分析法是检测细胞活性的常用方法。如图1所示。

图1 BRPS对HepG2细胞存活率的影响Fig.1 Effect of BRPS on cell viability of HepG2 cells
质量浓度在12.5 mg/L~50 mg/L范围时,BRPS不显示细胞毒作用,细胞存活率≥90%。质量浓度高于100 mg/L时,BRPS具有一定的细胞毒作用。因此,本研究选25 mg/L和50 mg/L为干预计量研究BRPS对H2O2诱导细胞氧化应激的抑制作用。
2.2BRPS对氧化应激细胞存活率的影响
H2O2为一种活性氧,可引发脂质过氧化,增高氧化应激,最终导致细胞损伤甚至死亡[9]。如图2所示。
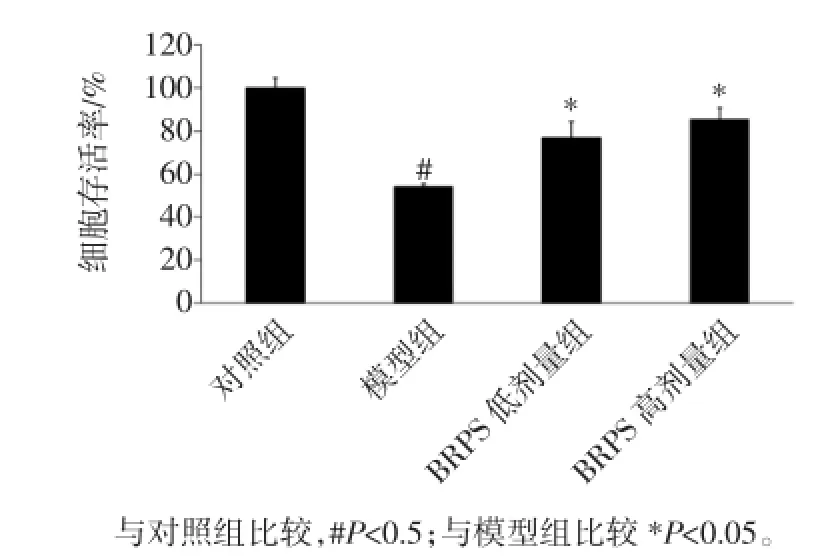
图2 BRPS对氧化应激细胞存活率的影响Fig.2 Effect of BRPS on cell viabilities of cells with oxidative stress
与对照组比较,H2O2组细胞存活率明显降低(P<0.05),经BRPS干预后细胞存活率与H2O2组比较增高(P<0.05)。表明,BRPS干预降低了H2O2所致的细胞损伤,提高细胞活力。
2.3BRPS对培养液中ALT、AST、LDH释放的影响
肝细胞发生损伤时胞内酶如LDH、ALT、AST等释放到细胞外,使培养液中胞内酶活性增高,其活性可反映细胞损伤的程度[9]。如表1所示。

表1 BRPS对培养液中ALT、AST、LDH释放的影响(x±s,n=6)Table 1 Effect of BRPS on releases of ALT,AST and LDH to culture fluid(x±s,n=6)
对照组培养液中LDH、ALT、AST活性较低;与对照组比较,H2O2组培养液LDH、AST、ALT活性显著升高(P<0.05);与H2O2组比较,BRPS组培养液LDH、ALT、AST活性显著降低(P<0.05)。
2.4BRPS对细胞SOD、GSH、MDA水平的影响
细胞MDA可反映脂质过氧化程度,而SOD和GSH是细胞内抗氧化酶和抗氧化剂[9]。如表2所示。

表2 BRPS对细胞MDA、SOD、GSH水平的影响(x±s,n=6)Table 2 Effect of BRPS on levels of MDA,SOD and GSH (x±s,n=6)
与对照组比较,H2O2组细胞MDA含量显著升高(P<0.05),SOD活性与GSH含量显著降低(P<0.05);与H2O2组比较,BRPS组细胞内MDA含量显著降低(P<0.05),50 mg/L BRPS组(高剂量组)细胞SOD活性与GSH含量显著升高(P<0.05)。25 mg/L BRPS组(低剂量组)SOD活性与GSH含量有增高趋势,但与对照组比较无显著性差异(P>0.05)。
2.5BRPS对细胞MAPK蛋白激活的影响
MAPK是细胞内的一类丝氨酸/苏氨酸蛋白激酶,主要有ERK、JNK及p38 MAPK[9]。如图3所示。

图3 BRPS对细胞MAPK蛋白激活的影响Fig.3 Effect of BRPS on activation of MAPKs of cells
蛋白印迹结果显示,H2O2虽不影响ERK和JNK总蛋白的表达,但诱导细胞p-ERK和p-JNK的表达(P<0.05)。与H2O2组比较,50 mg/L BRPS组p-ERK 和p-JNK的表达水平显著降低(P<0.05)。H2O2损伤2 h时,H2O2组p38蛋白激活并不显著(P>0.05),50 mg/L BRPS对p38蛋白活化水平也无显著影响(P>0.05)。
3 讨论
氧化应激损伤是机体遭受各种有害刺激时,氧化与抗氧化体系的平衡状态被打破所导致的组织、器官等的损伤[10]。氧化应激是各种肝脏疾病发生发展过程中共同的病理生理基础,因此,抗氧化剂作为肝脏疾病的防治措施是可行的[11]。在H2O2诱导的细胞损伤中,氧化应激是重要环节和机制。当机体受到氧化应激时,胞内生成大量氧自由基,引发细胞膜的脂质过氧化,引起一系列的自由基链反应;并大量损耗内源性抗氧化体系,造成GSH含量和SOD活性的降低[1-2,10-11]。此外,受到各种因素的损害时,细胞不能维持其结构的完整性,膜通透性增强,细胞内ALT、AST、LDH等大量释放到胞外[8,11]。因此,当细胞受到H2O2损伤时,细胞存活率下降、转氨酶外释、MDA生成和细胞内抗氧化活力下降等可综合反映细胞损害的程度[10-11]。本结果表明,BRPS能降低H2O2所致细胞损伤,提高细胞存活率;降低培养液中LDH、ALT和AST活性;降低细胞MDA水平,升高细胞SOD活性和GSH含量;降低ERK和JNK蛋白的活化水平。表明,BRPS对H2O2所致HepG2细胞氧化应激具有抑制作用,可减轻其细胞损伤。
参考文献:
[1]张慧芸,庄军辉.丁香提取物对人肝细胞H2O2氧化损伤的保护作用及其机制[J].食品与生物技术学报,2013,32(9):1003-1007
[2]刘红亮,胡磊,王靖凯,等.槲皮素对H2O2损伤PC12细胞的保护效果与机制[J].中国药理学通报,2014,30(3):373-377
[3]汪霞,周微,李天,等.草苁蓉环烯醚萜对肝癌前病变大鼠血清标志酶及抗氧化活性的影响[J].食品科技,2010,35(7):242-245
[4]杨振凯,杨阳,张亚男,等.草苁蓉正丁醇及水萃取物对小鼠急性肝损伤的保护作用[J].延边大学医学学报,2011,34(2):105-107
[5] QUAN JS,LI T,ZHAO WX,et al.Hepatoprotective effect of polysaccharides from Boschniakia rossica on carbon tetrachlorideinduced toxicity[J].J Clin Biochem Nutr,2013,52(3):244-252
[6]WANG ZH,WU BJ,ZHANG XH,et al.Purification of a polysaccharide from Boschniakia rossica and its synergistic antitumor effect combined with 5-Fluorouracil[J].Carbohyd Polym,2012,89(1):31-35
[7]韩飞,周孟良.过氧化氢诱导HepG2细胞产生氧化应激细胞模型的建立[J].食品科学,2011,32(5):55-57
[8]韩林,李健,林欣,等.黄芪甲苷对Chang Liver细胞酒精性和非酒精性氧化损伤的保护作用[J].中国中药杂志,2014,39(22):4430-4435
[9]王玉娇.草苁蓉多糖对肝细胞氧化损伤的保护作用[D].延吉:延边大学,2014
[10]李健,韩林,马玉芳,等.黄芪3种成分对Chang Liver细胞氧化应激的抑制作用[J].中国中药杂志,2015,40(2):318-323
[11]李振,玄红专,张丽,等.蜂胶对大鼠BRL肝细胞损伤的保护作用[J].食品研究与开发,2013,34(15):5-8
DOI:10.3969/j.issn.1005-6521.2016.11.002
基金项目:国家自然科学基金资助项目(81160539;81360651)
作者简介:全吉淑(1968—),女(朝鲜),教授,博士,研究方向:天然产物的活性研究。
*通信作者
收稿日期:2015-04-07
Inhibitory Effect of Polysaccharides from Boschniakia Rossica on Oxidative Stress in HepG2 Cells
QUAN Ji-shu1,WANG Yu-jiao1,YIN Ji-feng2,GAO Feng1,YIN Xue-zhe2,*
(1.Medical College of Yanbian University,Yanji 133002,Jilin,China;2.Affiliated Hospital of Yanbian University,Yanji 133000,Jilin,China)
Abstract:Inhibitory effect of polysaccharides from Boschniakia rossica(BRPS)on cellular oxidative stress induced by hydrogen peroxide(H2O2)in HepG2 cell line was investigated.The cellular oxidative stress model was established in HepG2 cells with H2O2,and then the cell viabilities were detected with MTT assay.Lactate dehydrogenase(LDH),alanine aminotransferase(ALT),aspartate aminotransferase(AST),malondialdelyde (MDA),superoxide dismutase(SOD)and reduced glutathione(GSH)were measured by the spectrophotometric method.The activation of extracellular signal-regulated kinase(ERK),c-Jun N-terminal kinase (JNK),p38 mitogen-activated protein kinase(p38)were determined with the western blotting method.Results showed that BRPS had no toxic effect on cultured HepG2 cells at the concentrations of 12.5 mg/L-50 mg/L. However,H2O2decreased the cell viability and antioxidant activities,and increased activation of ERK and JNK.In HepG2 cells with H2O2-induced oxidative stress,the administration of BRPS increased the cell viability,reduced LDH,ALT and AST leakage,reduced the MDA formation,increased the SOD and GSH levels,and suppressed the activation of ERK and JNK.Taken together,BRPS had the inhibitory effect on oxidative stress induced by H2O2in HepG2 cells,and could relieve the oxidative damage of HepG2 cells.
Key words:Boschniakia rossica;polysaccharides;H2O2;oxidative stress;HepG2

