重组铜绿假单胞菌外毒素A的原核表达和多克隆抗体制备及免疫保护功能分析
刘祥
(陕西理工学院生物科学与工程学院,陕西 汉中723001)
重组铜绿假单胞菌外毒素A的原核表达和多克隆抗体制备及免疫保护功能分析
刘祥
(陕西理工学院生物科学与工程学院,陕西 汉中723001)
摘 要:为探索铜绿假单胞菌ETA蛋白的免疫保护功能,采用分子克隆方法获得铜绿假单胞菌ETA表达菌株;利用切胶纯化获得ETA蛋白并免疫小鼠,制备ETA蛋白多克隆抗体;用ELISA方法,检测出ETA抗血清滴度达1∶8 000;蛋白质印迹分析结果表明,抗血清具有很好的特异性;小鼠免疫保护试验结果表明,ETA对铜绿假单胞菌感染的保护率达50%,显著高于对照组的免疫保护率。用DNAman软件对ETA序列同源性进行分析,发现革兰氏阴性菌的同源性高于革兰氏阳性菌,铜绿假单胞菌种间的同源性高于其他种类细菌的同源性;用MEGA软件对ETA的进化分析结果表明,不同血清型铜绿假单胞菌的亲缘关系高于其他细菌,据此可推测ETA免疫动物产生的特异性抗体可能为不同种类铜绿假单胞菌的感染提供交叉免疫保护。
关 键 词:铜绿假单胞菌;外毒素A;原核表达;多克隆抗体;酶联免疫法;免疫保护
投稿网址:http://xb.ijournal.cn
铜绿假单胞菌(Pseudomonas aeruginosa)又名绿脓杆菌,为一种人兽共患病原菌,也是医院感染的常见致病菌[1],当身体烧伤、重大疾病创伤以及免疫缺陷时易诱发该菌的感染[2-3]。目前,抗生素滥用使铜绿假单胞菌的耐药性不断提高,给临床治疗带来较大难度[4-5],所以,有必要开发新型的蛋白疫苗。该菌感染的毒力因子主要有 ETA蛋白、菌毛、内毒素、荚膜、胞外酶S等。ETA蛋白与该
1 材料与方法
1.1 材料
1.1.1 材料
P. aeruginosa PAO1菌株和pET-28a质粒由陕西理工学院生物化学与分子生物学实验室保存;昆明鼠由西安交通大学动物实验中心提供。
1.1.2 主要试剂
蛋白胨、酵母粉、IPTG、胶回收试剂盒和基因组提取试剂盒购于上海生工生物工程技术服务有限公司;限制性内切酶EcoR I和Hind III、Taq酶、T4-DNA连接酶、蛋白 marker,以及核酸 marker均为宝生物工程(大连)有限公司出品;山羊抗小鼠IgG二抗与琼脂糖购于美国Sigma公司;质粒提取试剂盒购于博日公司。
1.2 方法
1.2.1 ETA重组菌株的构建
根据NCBI公布的铜绿假单胞菌基因序列,设计ETA蛋白基因引物 Primer 1(5'-ACGGAATTC ATG CACCTGACACCCCA-3')和Primer 2(5'-GCTAAGC TTTTACTTCAGGTCCTCGC-3'),下划线分别为限制性内酶位点EcoR I和Hind Ⅲ。下同。PCR反应体系与条件以及载体构建方法见文献[11]。将获得的重组载体转化大肠杆菌DH5a后提取质粒,双酶切检测构建的准确性,并由北京鼎国生物技术公司测序,鉴定ETA重组基因序列,最后将重组质粒转化大肠杆菌BL21表达菌株[12]。
1.2.2 ETA重组蛋白的表达检测与蛋白纯化
将ETA重组菌株过夜培养,转接入新的LB培养基中,摇床培养约2.5 h后,加入终浓度0.5 mmol/L 的IPTG诱导5 h,通过SDS-PAGE蛋白电泳检测ETA蛋白表达情况。待检测到ETA正确表达后,大量培养菌株,采用文献[13]中的方法对ETA蛋白进行切胶纯化与蛋白复性。
1.2.3 ETA重组蛋白多克隆抗体的制备
选取4周龄的雄性昆明鼠5只,按照文献[14]中的方法对小鼠进行OprH蛋白免疫[14]。每只小鼠免疫ETA蛋白3次,每次免疫50 μg蛋白,最后,从小鼠眼部取血获得ETA抗血清。
1.2.4 ETA抗体效价与特异性检测
通过ELISA酶联法检测抗血清效价[15],其主要步骤为:将纯化的ETA蛋白加入到96孔板中,用封闭液200 μL于37 ℃孵育2 h,然后加入不同稀释度的ETA小鼠抗血清,再加入二抗溶液,用显色液显色,加入终止液后于酶标仪450 nm处读数。
通过蛋白印迹法检测小鼠ETA抗血清特异性[16]。收集铜绿假单胞菌进行SDS-PAGE蛋白电泳,转NC膜后,与不同稀释度的ETA小鼠抗血清作用,再加入二抗,DAB显色后检测ETA抗血清的特异性。
1.2.5 ETA免疫保护作用验证
试验组和对照组各选用20只昆明鼠,按照文献[17]中的方法进行免疫。第3次ETA蛋白免疫后,用铜绿假单胞菌进行小鼠腹腔攻毒试验,记录小鼠的死亡情况,并计算ETA蛋白的免疫保护率[18]。采用SPSS 13.0软件对试验结果进行卡方检验,验证ETA的免疫保护性。
1.2.6 ETA蛋白序列的系统发生分析
从NCBI 数据库中收集已经公布的细菌ETA蛋白氨基酸序列信息,采用DNAman 和 MEGA5.02软件,分别进行ETA氨基酸序列的同源性与系统发生分析[11-13]。
2 结果与分析
2.1 ETA重组菌株构建结果
采用 PCR方法从铜绿假单胞菌基因组中扩增基因,获得约1 917 bp的片段(图1-A)。该片段大小与目的基因大小一致。将PCR获得的ETA蛋白基因连接入pET-28a质粒,转化大肠杆菌DH5a菌株;提取质粒,用EcoR I和Hind III双酶切重组质粒,获得1 917 bp片段(图1-B)。该片段大小与ETA蛋白基因大小一致。测序结果显示,重组基因的基因序列与NCBI公布的基因序列相同。
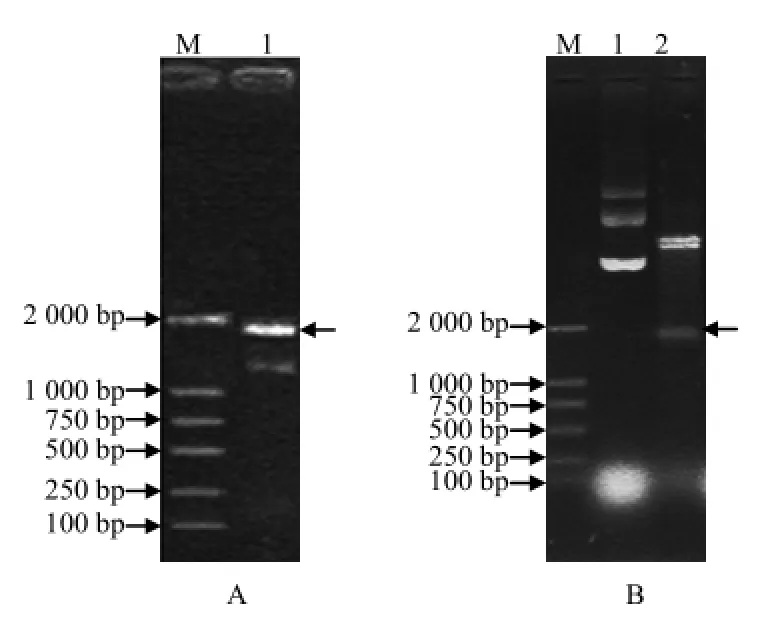
图1 铜绿假单胞菌ETA蛋白重组质粒载体构建检测结果Fig.1 Recombinant plasmid construction test chart for ETA protein gene of P. aeruginosa
2.2 ETA重组蛋白的表达检测与蛋白纯化
从图2可看出,重组表达菌株经IPTG诱导后,获得相对分子质量69 000的条带,ETA蛋白的表达与预期相同;采用蛋白电泳切胶纯化、尿素梯度复性获得ETA重组蛋白,表明铜绿假单胞菌ETA蛋白被成功表达和纯化。
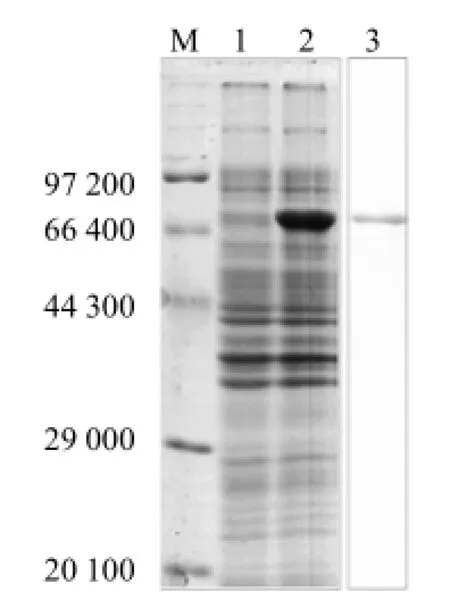
图2 铜绿假单胞菌ETA蛋白的表达与纯化电泳检测结果Fig.2 Expression and purification electrophoresis for ETA protein of P. aeruginosa
2.3 ETA的小鼠抗血清效价与特异性检测结果
ELISA法检测结果显示,ETA抗血清效价为1∶8 000(图3)。利用蛋白质印迹法,发现不同稀释度ETA抗血清有相应的条带出现,而对照无条带显现,表明重组蛋白抗血清与ETA蛋白特异性的结合,获得了ETA多克隆抗血清。
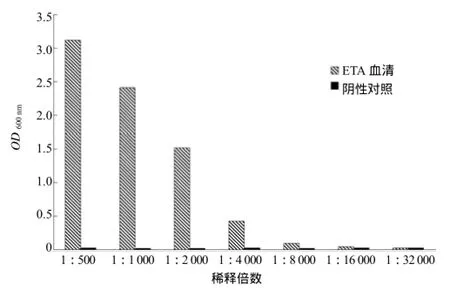
图3 铜绿假单胞菌ETA多克隆抗体效价的检测结果Fig. 3 Detection for ETA polyclonal antibody titer of the P. aeruginosa
2.4 ETA蛋白的免疫保护作用
小鼠免疫ETA蛋白,攻毒铜绿假单胞菌,发现攻毒致病菌5 d后,小鼠死亡率得到控制。试验结果显示,对照组死亡率为80%,试验组死亡率为40%;ETA免疫小鼠激活的特异性免疫对小鼠铜绿假单胞菌感染的保护率达50%,相对于对照组具有显著性差异(表1)。
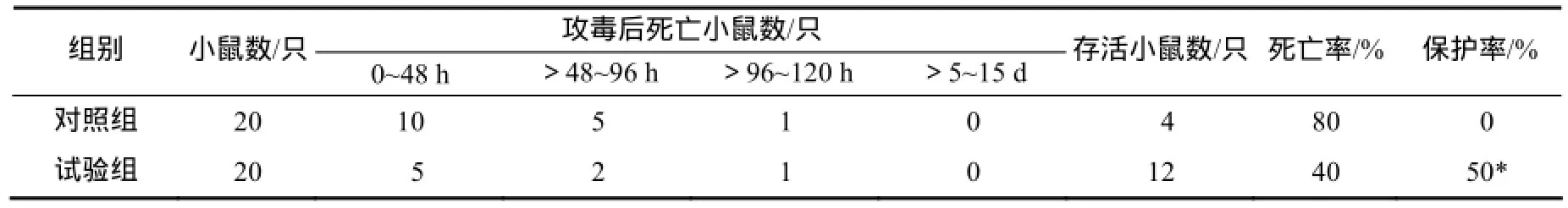
表1 小鼠免疫ETA及攻毒铜绿假单胞菌试验结果Table 1 Results of immunity of ETA and challenging P. aeruginosa
2.5 ETA蛋白序列系统发生分析
采用DNAman软件对NCBI公布的12种细菌的 ETA氨基酸序列进行同源性分析,结果显示:不同细菌间 ETA蛋白Ⅲ区的同源性比Ⅰ区、Ⅱ区的高,这可能与Ⅲ区发挥细胞毒性作用有关;不同种类铜绿假单胞菌的同源性接近100%(图4)。采用MEGA软件构建ETA系统进化树,发现革兰氏阴性菌的亲缘关系高于革兰氏阳性菌(金黄色葡萄球菌),不同种类铜绿假单胞菌的亲缘关系更近(图5)。据此可推测,ETA蛋白可能为不同种类铜绿假单胞菌的感染提供交叉免疫保护作用。

图4 ETA蛋白氨基酸序列的多重比对结果Fig.4 Multiple alignment of amino acid sequences of ETA protein
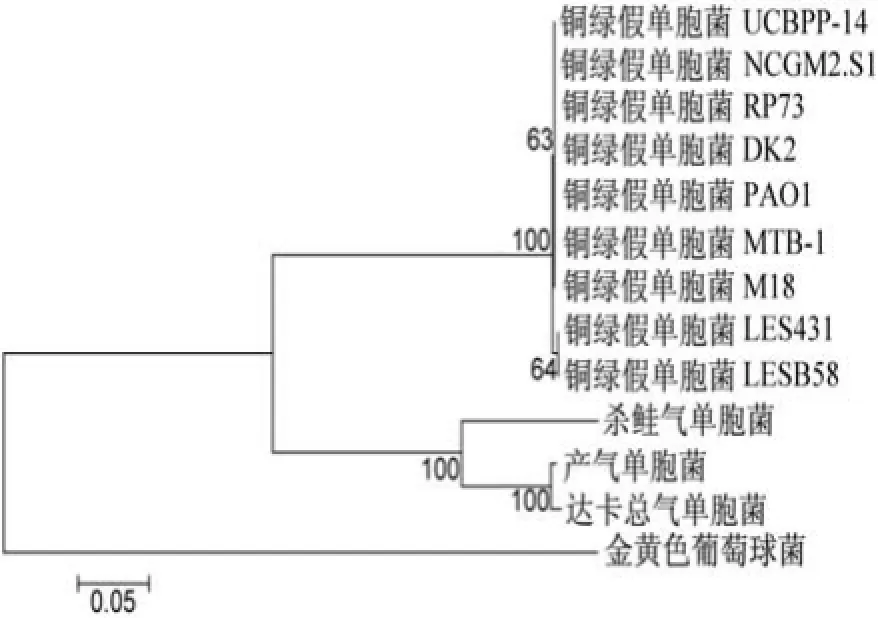
图5 MEGA软件构建的ETA氨基酸序列系统进化树Fig.5 Phylogenetic tree from ETA amino acid sequences using MEGA
3 结论与讨论
ETA蛋白是铜绿假单胞菌感染最主要的毒力因子,可激活机体强烈的免疫反应,具有很强的免疫原性[19]。由血管内皮F3肽与ETA制备的融合蛋白可抑制人癌细胞的生长[8];将病毒M2蛋白、分泌蛋白PcrV与ETA制备成联合疫苗,可提高小鼠抵御病菌感染的能力[9-10]。ETA在蛋白疫苗和联合佐剂制备方面具有广泛的应用前景[20]。有人利用分子克隆获得了高表达ETA的菌株[21],纯化获得了大量的ETA蛋白,并对ETA的功能进行了初步研究[22]。本研究中发现ETA激活的小鼠特异性免疫反应对铜绿假单胞菌感染的保护率达50%,显著高于对照组。
获得 ETA蛋白抗血清是免疫学功能研究的基础。Soldatenkova等[23]通过免疫方法成功制备了ETA小鼠单克隆抗体,研究了ETA的细胞毒性。单克隆抗体制备技术复杂,而多克隆抗体成本低,周期短,效果好,是免疫学研究常使用的抗体[24]。本试验中将ETA蛋白免疫小鼠,成功制备并鉴定了ETA多克隆抗体。获得的ETA抗血清的效价较低可能是由鼠抗[13-14]导致。本试验中通过增加小鼠免疫数获得更多的抗血清,以弥补低鼠抗效价的不足。
ETA蛋白具有很强的细胞毒性作用,在遗传进化上具有保守性[6, 25]。本研究结果表明:不同细菌的 ETA氨基酸序列具有很高的同源性,且革兰氏阴性菌的同源性高于革兰氏阳性菌;不同种类铜绿假单胞菌的亲缘关系更近。这些发现可为 ETA蛋白的交叉免疫保护研究提供参考依据。
参考文献:
[1] 姚立红,徐一,陈爱珺,等.铜绿假单胞菌外毒素 A 基因突变体的构建及其在大肠埃希菌中的表达[J].中国生物制品学杂志,2014,27(1):23-27.
[2] Zhu X,Ma Z,Wang J,et al.Importance of tryptophan in transforming an amphipathic peptide into a Pseudomonas aeruginosa targeted antimicrobial peptide [J].PLoS One,2014,9(12):e114605.
[3] Tanideh N,Rokhsari P,Mehrabani D,et al.The healing effect of licorice on Pseudomonas aeruginosa infected burn wounds in experimental rat model[J].World J Plast Surg,2014,3(2):99-106.
[4] 胡凯.铜绿假单胞菌的分布及耐药性分析[J].现代预防医学,2014,41(21):3999-4001.
[5] 刘祥.铜绿假单胞菌外膜蛋白的H原核表达、多克隆抗体制备及免疫保护作用[J].第二军医大学学报,2015,36(10):1092-1096.
[6] 夏海华,于冲,曲晓军,等.绿脓杆菌外毒素 A 的最新研究进展[J].生物技术,2012,22(2):81-85.
[7] Schäuble N,CavaliÉ A,Zimmermann R,et al.Interaction of Pseudomonas aeruginosa exotoxin A with the human Sec61 complex suppresses passive calcium efflux from the endoplasmic reticulum[J].Channels,2014,8(1):76-83.
[8] 郭凯,陈泉,周红姿,等.重组血管内皮受体 F3 肽-铜绿假单胞菌外毒素A蛋白抑制肿瘤生长的实验研究[J].科学技术与工程,2014,14(11):127-130.
[9] 徐一,姚立红,陈爱珺,等.流感病毒M2蛋白胞外区与铜绿假单胞菌外毒素A融合蛋白的表达及其免疫原性研究[J].病毒学报,2010,26(3):189-194.
[10] 姜明子,冯旰珠.重组铜绿假单胞菌外毒素 A 和 pcrV基因质粒的构建及真核表达[J].医学研究生学报,2014,27(7):694-697.
[11] 刘祥,陈春琳,牟欢,等.重组人骨硬化蛋白的表达、纯化及多克隆抗体制备[J].生物技术,2014,24(6):68-72.
[12] 刘祥,陈春琳,王杨科,等.小鼠骨桥蛋白的原核表达及多克隆抗体的制备与鉴定[J].中国畜牧兽医,2015,42(5):1069-1075.
[13] 刘祥.小鼠骨形成蛋白BMP3的原核表达及多克隆抗体制备与鉴定[J].华北农学报,2015,30(3):8-13.
[14] 刘祥,俱雄,陈春琳.重组大肠埃希菌外膜蛋白OmpT的载体构建和表达条件优化及多克隆抗体制备[J].湖南农业大学学报(自然科学版),2015,41(4):350-355.
[15] 刘祥.溶藻弧菌附着定植因子ACFA原核载体构建、表达条件优化及多克隆抗体制备[J].华北农学报,2015,30(1):35-41.
[16] 刘祥.福氏志贺菌2型外膜蛋白A的原核表达及多克隆抗体的制备[J].动物医学进展,2015,36(5):6-10.
[17] 刘祥.铜绿假单胞菌外膜蛋白 F 原核载体构建、表达条件优化及免疫保护作用研究[J].中国现代医学杂志,2015,25(11):12-16.
[18] 俱雄,陈春琳,刘祥,等.大肠埃希菌外膜蛋白 OmpC的原核表达与免疫保护作用研究[J].生命科学研究,2015,19(2):131-136.
[19] Tafesse F G,Guimaraes C P,Maruyama T,et al. GPR107,a G-protein-coupled receptor essential for intoxication by Pseudomonas aeruginosa exotoxin A,localizes to the Golgi and is cleaved by furin[J].J Biol Chem,2014,289(35):24005-24018.
[20] Farajnia S,Peerayeh S N,TANOMAND A,et al. Protective efficacy of recombinant exotoxin A-flagellin fusion protein against Pseudomonas aeruginosa infection[J]. Can J Microbiol,2015,61(1):60-64.
[21] 佟伟,董颖,李会.铜绿假单胞菌外毒素 A 原核表达载体的构建及表达[J].中国现代医学杂志,2008,18(19):2772-2774.
[22] Wang X,Li X,Zhang Z,et al.Codon optimization enhances secretory expression of Pseudomonas aeruginosa exotoxin A in E.coli[J].Protein Expr Purif,2010,72(1):101-106.
[23] Soldatenkova A V,Iakovleva I V,Gavrilova N V,et al. Production and properties evaluation of monoclonal antibodies against Pseudomonas aeruginosa exotoxin A[J].Zh Mikrobiol Epidemiol Immunobiol,2014(1):30-35.
[24] 王羽,廖翔,岳俊杰,等.福氏志贺菌5a型M90T株GAPDH蛋白多克隆抗体的制备和鉴定[J].细胞与分子免疫学杂志,2014,30(4):407-410.
[25] Boland E L,Van Dyken C M,Duckett R M,et al. Structural complementation of the catalytic domain of Pseudomonas exotoxin A[J].J Mol Biol,2014,426(3):645-655.
责任编辑:王赛群
英文编辑:王 库
中图分类号:Q789
文献标志码:A
文章编号:1007-1032(2016)01-0033-06
收稿日期:2015-01-22 修回日期:2015-11-22
基金项目:国家大学生创新创业训练计划项目(201510720556);陕西省大学生创新创业训练计划项目(1949);陕西理工学院大学生创新创业训练计划项目(UIRP15006)
作者简介:刘祥(1983—),男,安徽合肥人,博士,讲师,主要从事蛋白质组学与免疫学研究,liuxiang888525@163.com菌的感染密切相关,由toxA基因编码,具有3个结构功能域,I区与靶细胞表面受体蛋白的结合有关,Ⅱ区实现毒素的跨膜转运,Ⅲ区发挥细胞毒性作用[6-7]。ETA具有极强的细胞毒性,常被用作分子佐剂与其他抗原融合表达,以提高小分子抗原的免疫应答能力[8-9],在联合蛋白佐剂疫苗上具有应用价值[10]。本试验中原核表达、纯化铜绿假单胞菌ETA蛋白,制备和鉴定ETA蛋白多克隆抗体,检测ETA的免疫保护功能,并对ETA进行系统进化分析。现将结果报道如下。
Prokaryotic expression, polyclonal antibody preparation and immunoprotection potential of exotoxin A from recombinant Pseudomonas aeruginosa
Liu Xiang
(College of Biological Sciences and Engineering, Shaanxi University of Technology, Hanzhong, Shaanxi 723001, China)
Abstract:To explore the immunoprotection function of Pseudomonas aeruginosa (P. aeruginosa) exotoxin A (ETA)protein, its strain was obtained by approach of molecular clone; ETA was purified by the way of gel slices, and immunized mice was employed to prepare the polyclonal antibody. Antibody titer was 1∶8 000 detected by enzyme-linked immuno sorbent assay(ELISA), and results of western blotting proved that the antiserum had a good specificity; mice specific immune was activated by ETA, and immune protection ratio for mice against P. aeruginosa infection was significant higher than the control group, reached to 50%. Results from ETA homology analysis showed that the homology of gram-negative bacteria was higher than gram-positive bacteria, and P. aeruginosa homology was higher than that of other species analyzed from software of DNAman. Results of phylogenetic analysis showed that the genetic relationship among various P. aeruginosa were higher than that of other bacteria. The specific antibodies produced by ETA immune animals might provide cross protection from the infection of different kinds of P. aeruginosa. Keywords: Pseudomonas aeruginosa; exotoxin A; prokaryotic expression; polyclonal antibody; enzyme-linked immuno sorbent assay(ELISA); immunoprotection

