急性期川崎病γ干扰素组蛋白乙酰化改变及意义初探
梅洁花 崔 冬 王 勤 温鹏强 徐明国 唐 根 刘 琮 李成荣 王国兵
·论著·
急性期川崎病γ干扰素组蛋白乙酰化改变及意义初探
梅洁花1,3崔 冬1,3王 勤2温鹏强1徐明国1唐 根1刘 琮1李成荣1王国兵1
目的 探讨急性期川崎病(KD)患儿IFN-γ组蛋白乙酰化改变及其在KD免疫发病机制中的作用。方法 以2015年2月至2016年6月深圳市儿童医院诊断并住院治疗的KD患儿为KD组,经IVIG治疗后为KD-IVIG组,KD组依冠状动脉有无损伤分为冠状动脉损伤(KD-CAL+)亚组和无冠状动脉损伤(KD-CAL-)亚组,于IVIG治疗前、后取血备检;同期体检的健康儿童为对照组。采用染色质免疫共沉淀法检测外周血CD4+T细胞IFN-γ组蛋白H3乙酰化水平及组蛋白乙酰化酶p300和去乙酰化酶HDAC1/2结合水平;流式细胞术检测外周血CD4+IFN-γ+细胞(Th1)比例及IFN-γ、pSTAT4、pSTAT5和T-bet蛋白表达水平;实时荧光定量PCR检测CD4+T细胞IFN-γ、IL-2Rα/β、IL-12Rβ1/2、IL-18Rα/β和ITLR4 mRNA表达;ELISA检测外周血浆中IL-12、IL-2和IL-18浓度。结果 ①KD患儿38例(男20例),年龄1~5.2岁;KD-CAL+亚组16例,KD-CAL-亚组22例。对照组32例(男17例),年龄1.2~4.9岁。KD组和对照组年龄、性别差异无统计学意义。②急性期KD患儿Th1细胞比例、IFN-γmRNA和蛋白表达及其组蛋白乙酰化水平显著高于对照组(P<0.05),且KD-CAL+亚组高于KD-CAL-亚组(P<0.05),经IVIG治疗后明显恢复(P<0.05)。③急性期KD患儿CD4+T细胞IFN-γ组蛋白乙酰化酶p300结合水平显著增加(P<0.05),HDAC1/2结合水平明显降低(P<0.05),p300/HDAC1/2明显高于对照组且与IFN-γ组蛋白H3乙酰化水平呈正相关 (r=0.52;P<0.05),经IVIG治疗后均有所恢复(P<0.05)。其中KD-CAL+亚组p300结合水平及p300/HDAC1/2比值均高于KD-CAL-亚组 (P<0.05),而HDAC1/2结合水平则低于后者(P<0.05)。④急性期KD患儿血浆IL-2、IL-12和IL-18浓度显著增高(P<0.05),CD4+T细胞表面受体IL-2Rα/β、IL-12Rβ1/2、IL-18Rα/β和TLR4及其下游信号分子pSTAT5、pSTAT4、T-bet和MyD88表达明显上调(P<0.05),且KD-CAL+亚组前述各项均高于KD-CAL-亚组(P<0.05),经IVIG治疗后均有不同程度恢复(P<0.05)。结论 IFN-γ组蛋白过度乙酰化可能是导致急性期KD患儿免疫功能紊乱的重要因素之一。
川崎病; IFN-γ; 组蛋白乙酰化; Th1细胞; 免疫
川崎病(KD)是一种急性免疫功能紊乱所致的全身血管炎综合征,其病因及发病机制迄今仍未完全阐明[1-3]。Ⅰ型辅助性T细胞(Th1)是一类介导机体细胞免疫功能的T细胞亚群,其数量或功能异常可导致自身免疫性疾病的发生[4-6]。IFN-γ是Th1细胞分泌的标志性细胞因子,在其分化、成熟及免疫功能中发挥着重要作用。研究已证实外界刺激或细胞微环境改变可导致Th1细胞IFN-γ蛋白表达及功能异常[7-9],但调节IFN-γ表达的分子机制尚不完全清楚。组蛋白乙酰化是一种常见的表观遗传学修饰,通过改变染色质的空间结构而调节相关基因的转录活性[10,11]。本文通过观察KD患儿IFN-γ基因组蛋白乙酰化修饰及相关信号的改变,探讨导致急性期KD患儿Th1细胞异常活化的可能分子机制,从而进一步阐明KD及其血管损伤的免疫发病机制。
1 方法
1.1 研究设计 以病例对照研究设计。收集入住遵义医学院深圳市儿童医院(我院)的KD患儿,以急性期KD患儿为KD组、同期我院体检的健康儿童为对照组,观察KD组及其IVIG治疗后IFN-γ组蛋白乙酰化和相关信号分子的表达变化。
1.2 伦理和知情同意 本研究经我院伦理委员会审核同意。KD组患儿分别于急性期及IVIG治疗有效后4~5 d取血备检,对照组于体检当日取血备检 ;两组受试儿童及其父母或监护人了解本研究的目的,自愿参与本研究。
1.3 KD的诊断标准[12]日本川崎病研究会制定的标准:①体温39~40℃﹥5 d;②急性期手脚末梢出现红肿,第2~4周时可能在手脚掌或指尖及肛门周围产生脱皮现象;③多形性红斑;④两侧性结膜炎,结膜充血、发红,通常无分泌物;⑤口腔黏膜变化,如草莓舌、口腔咽喉黏膜充血,嘴唇红肿、干裂甚至流血;⑥急性非化脓性颈部淋巴结肿大,单侧或双侧,直径﹥1.5 cm。除符合第①项之外,还需要满足②~⑥中的4项,并且排除其他可以引起类似症状的疾病。病程10 d以内且未使用IVIG治疗,视为急性期KD患儿 。
1.4 KD冠状动脉损伤诊断指标 KD患儿均分别于急性期及IVIG治疗后行心脏彩色多普勒检查。①冠状动脉扩张:<3岁冠状动脉内径﹥2.5 mm,~5岁冠状动脉内径﹥3.0 mm,≥5岁冠状动脉内径﹥4.0 mm;②冠状动脉瘤诊断标准:①冠状动脉内径>4 mm, ≤8 mm;≥ 5岁年长儿冠状动脉扩张的内径为正常的 1.5~4倍, 诊断为冠脉瘤;②巨大冠脉瘤:冠状动脉内径>8 mm; ≥ 5岁年长儿冠状动脉扩张的内径大于正常4倍,诊断为巨大冠脉瘤。
1.5 分组 KD患儿依据IVIG使用前后分为KD组和KD-IVIG组,KD组依据有无冠状动脉损伤分为冠状动脉损伤(KD-CAL+)亚组和无冠状动脉损伤(KD-CAL-)亚组,健康儿童为对照组。
1.6 KD组纳入标准 2015年2月至2016年6月来我院就诊并被诊断为KD急性期的住院患儿。
1.7 对照组纳入和排除标准 同期我院保键科体检的、年龄与KD组尽量匹配的健康儿童,排除先天性心脏病、遗传性疾病等。
1.8 观察指标及检测方法
1.8.1IL-2Rα/β、IL-12Rβ1/2、IL-18Rα/β、TLR4和MyD88基因转录水平检测 采用实时荧光定量PCR方法,① 无菌采集乙二胺四乙酸二钠盐(EDTA·Na2)抗凝静脉血3 mL,采用免疫磁珠(美国LifeTec公司, 111.45 D)分离CD4+T细胞,并抽提总RNA。② 按试剂盒(美国Thermo公司,K1632)说明, 将总RNA逆转录合成cDNA。③ 根据Genebank中IL-2Rα/β、IL-12Rβ1/2、IL-18Rα/β、TLR4、MyD88和β-actinmRNA序列设计引物(表1 ),分别进行PCR扩增并送交上海英骏生物技术有限公司测序。测序结果与目标序列完全一致。④ 参照SYBR Green试剂盒(德国Qiagen公司,204143)说明定量分析,结果以目的基因/β-actin的比值表示。

表1 实时荧光定量PCR引物
1.8.2IFN-γ基因组蛋白H3乙酰化及乙酰化酶p300和去乙酰化酶HDAC1/2结合水平检测 采用染色质免疫共沉淀(ChIP),① 用含1%甲醛的PBS重悬部分已分离的CD4+T细胞, 37℃交联10 min。经含1mM PMSF, 1μg·mL-1aprotinin 和1μg·mL-1pepstatin A的冷PBS洗涤2次后,重悬于200 μL SDS裂解液,冰上孵育10 min;。② 采用超声法打断基因组DNA,经琼脂糖凝胶电泳确定片段长度为400~600 bp后,参照染色质免疫共沉淀试剂盒(美国Upstate公司,17-295)说明, 分别加入抗Acetyl-H3、p300和HDAC1/2抗体,分离input DNA和抗体特异性结合DNA。 ③ 根据IFN-γ基因序列设计引物,参照SYBR Green试剂盒(德国Qiagen,204143)说明进行定量分析,分别计算抗Acetyl-H3、p300和HDAC1/2抗体特异性结合DNA与input DNA比值。
1.8.3 血浆IL-2、IL-12和IL-18浓度检测 采用酶联免疫吸附试验(ELISA)。KD患儿及对照组儿童空腹6 h后,取外周血2 mL以肝素抗凝,500 g离心10 min,分离上层血浆;参照试剂盒(美国eBioscience公司,BMS221HS*、BMS238HS*和BMS267/2*)说明,检测血浆IL-2、IL-12和IL-18浓度。
1.8.4 Th1细胞比例及IFN-γ、pSTAT4、pSTAT5和T-bet蛋白水平检测 采用流式细胞术检测,① 采用密度梯度离心法分离外周血PBMC,重悬于含10%胎牛血清的RPMI 1640培养基中,加入20 ng·mL-1PMA、1 μg·mL-1Ionomycin和2 μmol·L-1Monensin刺激6小时;以CD4-eFluro450设门,固定、破膜,经IFN-γ-FITC抗体胞内染色30 min,检测CD4+IFN-γ+(Th1)细胞比例及IFN-γ蛋白表达水平;② 以CD4-eFluro450设门,固定、破膜,经pSTAT4-PE、pSTAT5-Alexa647和T-bet-PE-Cy7抗体核内染色30 min,检测CD4+T细胞pSTAT4、pSTAT5和T-bet蛋白表达水平。所有数据经Diva软件获取分析,蛋白表达水平以平均荧光强度(MFI)表示。
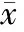
2 结果
2.1 一般情况 符合本文纳入和排除标准的KD患儿38例进入本文分析,其中男20例、女18例,年龄1~5.2岁,平均年龄(2.9±1.3)岁;KD-CAL+亚组16例,KD-CAL-亚组22例。对照组32例,其中男17例,女15例,年龄1.2~4.9岁,平均年龄(2.8±1.3)岁。KD组和对照组年龄(t=0.32,P=0.97) 、性别(χ2=0.002,P=0.97) 差异无统计学意义。
2.2 Th1细胞比例、IFN-γ表达及组蛋白乙酰化检测结果 表2和图1、2显示,经流式细胞术和real-time PCR观察到急性期KD患儿Th1细胞比例及IFN-γ蛋白水平显著增高(P<0.05),其中KD-CAL+亚组前述二项均高于KD-CAL-亚组(P<0.05),经IVIG治疗后明显恢复(P<0.05);进一步分析IFN-γ基因组蛋白H3乙酰化及mRNA水平,发现急性期KD患儿CD4+T细胞IFN-γ组蛋白H3乙酰化及mRNA水平显著增加(P<0.05),且KD-CAL+亚组IFN-γ组蛋白H3乙酰化及mRNA水平明显高于KD-CAL-亚组 (P<0.05),经IVIG治疗后均明显恢复(P<0.05)。

表2 KD患儿外周血Th1细胞比例及IFN-γ组蛋白乙酰化相关因子流式细胞检测结果( ±s)
注 1)与对照组比较,P<0.05;2)与KD-CAL-亚组比较P<0.05;3) 与KD组比较,P<0.05

图1 KD患儿Th1细胞及相关分子流式细胞检测结果
注 A:Th1细胞检测结果;B:IFN-γ及其组蛋白乙酰化相关分子检测结果
2.3IFN-γ组蛋白乙酰化/去乙酰化酶检测结果 图2显示,经ChIP检测组蛋白乙酰化酶p300、去乙酰化酶HDAC1/2与IFN-γ基因的结合水平,结果发现,急性期KD患儿CD4+T细胞IFN-γ基因p300结合水平显著增加(P<0.05),而HDAC1/2结合水平明显降低(P<0.05),导致p300/HDAC1/2明显高于对照组且与IFN-γ组蛋白H3乙酰化水平呈正相关关系(r=0.52;P<0.05),经IVIG治疗后均有所恢复(P<0.05)。进一步比较KD-CAL+和KD-CAL-亚组上述各项表达,发现KD-CAL+亚组IFN-γ基因p300结合水平及p300/HDAC1/2比值均高于KD-CAL-亚组 (P<0.05),而HDAC1/2结合水平则低于后者(P<0.05)。
2.4IFN-γ组蛋白乙酰化相关因子检测结果 表2、3和图1、3显示,急性期KD患儿血浆IL-2、IL-12和IL-18浓度显著增加(P<0.05),且KD-CAL+亚组IL-2、IL-12和IL-18浓度均高于KD-CAL-亚组(P<0.05),经IVIG治疗后均有所恢复(P<0.05)。进一步分析炎症因子受体及TLR下游信号分子,发现急性期KD患儿CD4+T细胞表面受体IL-12Rβ1/2、IL-2Rα/β、IL-18Rα/β和TLR4及其下游信号分子pSTAT4、T-bet、pSTAT5和MyD88表达显著上调,且KD-CAL+亚组上述各项均高于KD-CAL-亚组(P<0.05),经IVIG治疗后均有不同程度恢复(P<0.05)。
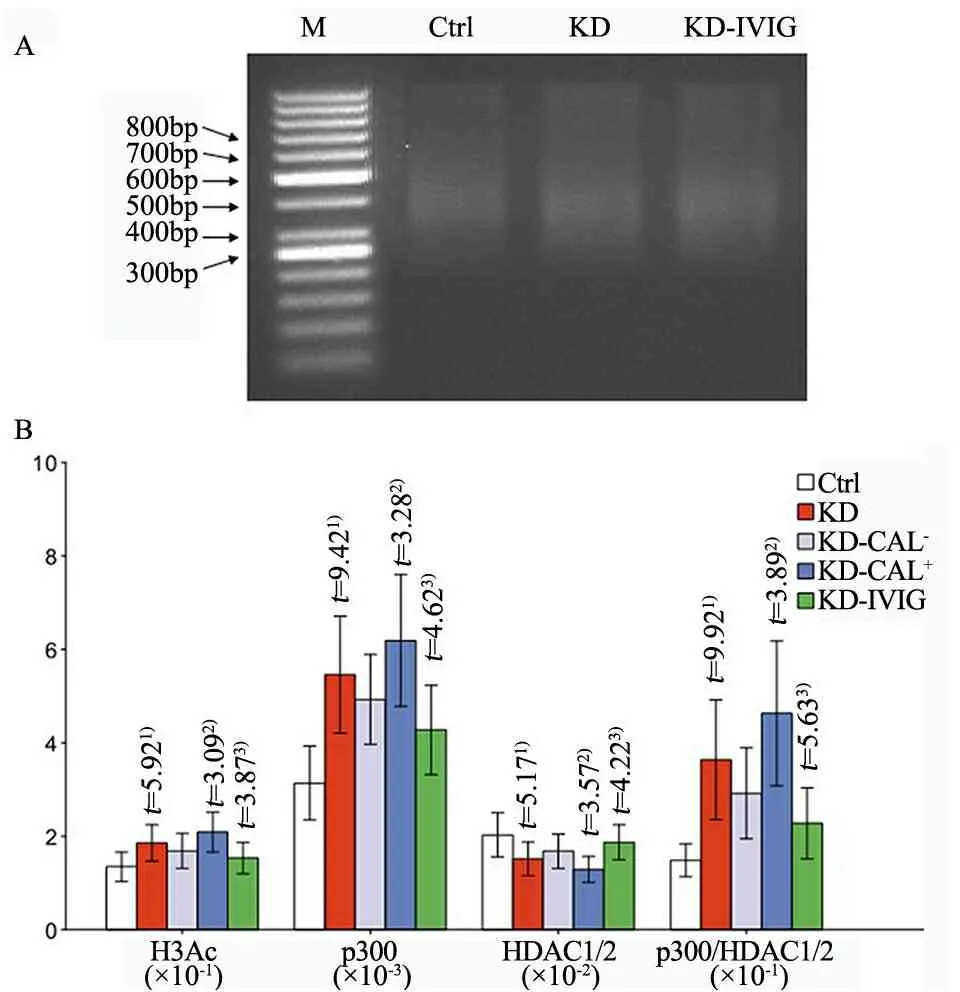
图2 KD患儿IFN-γ组蛋白H3乙酰化及p300、HDAC1/2结合水平检测结果
注 A:CD4+T细胞基因组DNA超声破碎琼脂糖凝胶电泳图;B:IFN-γ基因组蛋白乙酰化H3Ac水平及p300、HDAC1/2结合水平检测结果,各组结果经汇总后以直方图形式表示;1)与对照组比较,P<0.05;2)与KD-CAL-亚组比较P<0.05;3) 与KD组比较,P<0.05

表3 KD患儿血浆IFN-γ组蛋白乙酰化相关因子ELISA
注 1)与对照组比较,P<0.05;2)与KD-CAL-亚组比较P<0.05;3) 与KD组比较,P<0.05
3 讨论
KD病因及发病机制仍未完全清楚,大量的临床、流行病学资料和免疫学观察指标提示,KD可能是感染引起急性自身免疫功能紊乱所致[1-3],但导致KD自身免疫功能异常活化的机制仍有待阐明。Th1是一类介导细胞免疫功能的T细胞亚群,可通过表达FasL直接介导细胞毒作用或分泌细胞因子(IFN-γ、TNF-α、IL-2等)活化免疫活性细胞而促进机体免疫反应,其数量异常或功能障碍可导致免疫功能紊乱[4-6]。国外报道及本研究显示,急性期KD患儿Th1细胞比例及IFN-γ蛋白表达异常增加,其中KD-CAL+亚组前述二项均明显高于KD-CAL-亚组,经IVIG治疗后明显恢复,提示KD及血管损伤的发病机制可能与Th1细胞数量及功能异常有关,但导致KD患儿Th1细胞数量及功能异常的分子机制仍不完全清楚。
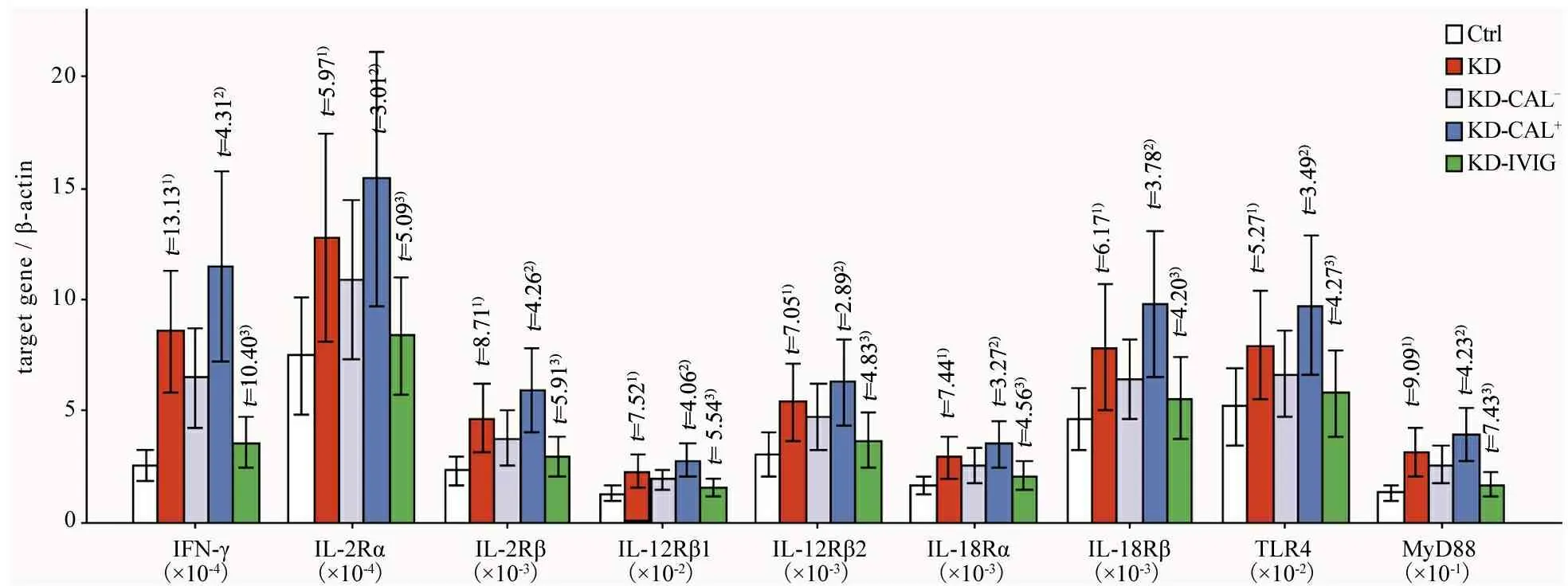
图3 KD患儿IFN-γ组蛋白H3乙酰化相关分子检测结果
注 1)与对照组比较P<0.05,2)与KD-CAL-组比较P<0.05,3)与KD组比较P<0.05
IFN-γ是Th1细胞分泌的标志性分子,在Th1细胞分化、成熟及免疫功能中发挥着至关重要的作用,其表达受细胞因子信号、表观遗传学修饰等多种因素调节[7-9]。组蛋白乙酰化是一种常见的表观遗传学修饰,可将乙酰基转移至组蛋白而使包绕在核小体外围的染色质形成松散、开放的空间结构,从而有利于转录因子的结合并启动基因表达[10,11]。本研究发现急性期KD患儿CD4+T细胞IFN-γ基因组蛋白H3乙酰化及mRNA表达水平显著增加,且KD-CAL+亚组IFN-γ基因组蛋白H3乙酰化及mRNA水平均高于KD-CAL-亚组,经IVIG治疗后均明显恢复,提示IFN-γ基因组蛋白过度乙酰化可能是导致急性期KD患儿Th1细胞数量及功能异常的重要因素之一。
调节IFN-γ基因组蛋白乙酰化的分子机制仍未完全阐明。p300是一种组蛋白乙酰化酶,可在辅因子CBP协助下,催化IFN-γ基因组蛋白发生乙酰化[8,13-15]。而去乙酰化酶HDAC1/2与Sin3A等蛋白形成免疫复合物Sin3A-HDAC1/2,后者结合至IFN-γ基因序列并促使组蛋白发生去乙酰化,从而参与调节IFN-γ基因组蛋白乙酰化水平[16]。本研究发现急性期KD患儿CD4+T细胞IFN-γ基因p300结合水平显著增加,而HDAC1/2结合水平明显降低,导致p300/HDAC1/2比值明显高于对照组且与IFN-γ组蛋白H3乙酰化水平呈正相关关系,经IVIG治疗后均有所恢复。进一步比较发现KD-CAL+亚组IFN-γ基因p300结合水平及p300/HDAC1/2比值均高于KD-CAL-亚组,而HDAC1/2结合水平则低于后者,提示IFN-γ基因组蛋白过度乙酰化可能与p300和HDAC1/2的结合水平异常有关。既往的研究已证实IL-12可与靶细胞表面受体结合,诱导下游信号分子STAT4发生磷酸化并募集T-bet、p300/CBP共同结合至IFN-γ基因序列,促使与IFN-γ基因结合的Sin3A-HDAC1/2发生解离,从而催化相关的组蛋白发生乙酰化[8,13-15]。与此相类似的是,IL-2亦可通过下游信号分子STAT5募集p300/CBP而介导IFN-γ基因组蛋白乙酰化[17,18]。另有研究表明IL-18刺激或TLR4信号可通过其共同的下游信号促进p300的表达及乙酰化酶活性并抑制HDAC1/2去乙酰化酶活性,从而增强IFN-γ基因组蛋白乙酰化水平[8,19-21]。而静脉注射IVIG经Fc段与细胞表面受体结合,可通过抑制DC成熟和炎症细胞因子的产生、下调TLR受体表达等机制介导抗炎作用,从而维持免疫系统动态平衡[22,23]。为探讨导致KD患儿IFN-γ基因p300和HDAC1/2结合水平异常的可能分子机制及IVIG的药物动力学影响,本研究比较了各组血浆IL-12、IL-2和IL-18浓度,发现急性期KD患儿IL-12、IL-2和IL-18浓度显著增高,且KD-CAL+亚组IL-12、IL-2和IL-18浓度均高于KD-CAL-亚组,经IVIG治疗后均有所恢复。进一步分析炎症因子受体及TLR下游信号分子的表达,发现急性期KD患CD4+T细胞表面受体IL-12Rβ1/2、IL-2Rα/β、IL-18Rα/β和TLR4及其下游信号分子pSTAT4、T-bet、pSTAT5和 MyD88表达显著上调,且KD-CAL+亚组前述各项均高于KD-CAL-亚组,经IVIG治疗后均有不同程度恢复,提示炎症因子及TLR信号过度活化可能是导致急性期KD患儿IFN-γ基因p300和HDAC1/2结合水平异常的关键因素,而IVIG或可通过抑制炎症因子及TLR4信号而调节p300、HDAC1/2结合水平。
基于上述结果,推测感染因素触发了KD患儿细胞因子级联反应,导致IL-12、IL-2和IL-18等炎症因子的大量产生,造成组织损伤并释放内源性配体。在炎症因子及内、外源性配体诱导的TLR4信号的共同作用下IFN-γ基因组蛋白乙酰化酶p300结合水平明显增加,而去乙酰化酶HDAC1/2结合水平显著降低,从而促使IFN-γ基因组蛋白过度乙酰化而上调其表达,最终导致Th1细胞数量及功能异常。而IVIG可通过抑制炎症因子及TLR4信号调节IFN-γ基因组蛋白乙酰化酶p300、HDAC1/2结合水平,进而促进IFN-γ表达及Th1细胞恢复。但组蛋白乙酰化是一种较为复杂的酶促动力学过程,是否存在其他因素参与调节IFN-γ基因组蛋白乙酰化仍有等进一步研究。
[1]Sundel RP. Kawasaki disease. Rheum Dis Clin North Am, 2015, 41(1): 63-73
[2]Takahashi K, Oharaseki T, Yokouchi Y, et al. Kawasaki disease: basic and pathological findings. Clin Exp Nephrol, 2013, 17(5): 690-693
[3]Yim D, Curtis N, Cheung M, et al. Update on Kawasaki disease: epidemiology, aetiology and pathogenesis. J Paediatr Child Health, 2013, 49(9): 704-708
[4]Hirahara K, Nakayama T. CD4+T-cell subsets in inflammatory diseases: beyond the Th1/Th2 paradigm. Int Immunol, 2016, 28(4): 163-171
[5]Zhang Y, Zhang Y, Gu W, et al. Th1/Th2 cell's function in immune system. Adv Exp Med Biol, 2014, 841: 45-65
[6]Zhang HL, Zheng XY, Zhu J. Th1/Th2/Th17/Treg cytokines in Guillain-Barre syndrome and experimental autoimmune neuritis. Cytokine Growth Factor Rev, 2013, 24(5): 443-453
[7]Schmitt N, Ueno H. Regulation of human helper T cell subset differentiation by cytokines. Curr Opin Immunol, 2015, 34: 130-136
[8]Morinobu A, Kanno Y, O'Shea JJ. Discrete roles for histone acetylation in human T helper 1 cell-specific gene expression. J Biol Chem, 2004, 279(39): 40640-40646
[9]Fields PE, Kim ST, Flavell RA. Cutting edge: changes in histone acetylation at the IL-4 and IFN-gamma loci accompany Th1/Th2 differentiation. J Immunol, 2002, 169(2): 647-650
[10]Selvi BR, Chatterjee S, Modak R, et al. Histone acetylation as a therapeutic target. Subcell Biochem, 2013, 61: 567-596
[11]Chen HP, Zhao YT, Zhao TC. Histone deacetylases and mechanisms of regulation of gene expression. Crit Rev Oncog, 2015, 20(1-2): 35-47
[12]Ayusawa M, Sonobe T, Uemura S, et al. Revision of diagnostic guidelines for Kawasaki disease (the 5th revised edition). Pediatr Int, 2005, 47(2):232-234
[13]Balasubramani A, Winstead CJ, Turner H, et al. Deletion of a conserved cis-element in the Ifng locus highlights the role of acute histone acetylation in modulating inducible gene transcription. PLoS Genet, 2014, 10(1): e1003969
[14]Pham D, Yu Q, Walline CC, et al. Opposing roles of STAT4 and Dnmt3a in Th1 gene regulation. J Immunol, 2013, 191(2): 902-911
[15]Mullen AC, High FA, Hutchins AS, et al. Role of T-bet in commitment of TH1 cells before IL-12-dependent selection. Science, 2001, 292(5523): 1907-1910
[16]Chang S, Collins PL, Aune TM. T-bet dependent removal of Sin3A-histone deacetylase complexes at the Ifng locus drives Th1 differentiation. J Immunol, 2008, 181(12): 8372-8381
[17]Shi M, Lin TH, Appell KC, et al. Janus-kinase-3-dependent signals induce chromatin remodeling at the Ifng locus during T helper 1 cell differentiation. Immunity, 2008, 28(6): 763-773
[18]Hedrich CM, Rauen T, Apostolidis SA, et al. Stat3 promotes IL-10 expression in lupus T cells through trans-activation and chromatin remodeling. Proc Natl Acad Sci U S A, 2014, 111(37): 13457-13462
[19]Ni W, Lin N, He H, et al. Lipopolysaccharide induces up-regulation of TGF-alpha through HDAC2 in a rat model of bronchopulmonary dysplasia. PLoS One, 2014, 9(3): e91083
[20]Lee IT, Shih RH, Lin CC, et al. Role of TLR4/NADPH oxidase/ROS-activated p38 MAPK in VCAM-1 expression induced by lipopolysaccharide in human renal mesangial cells. Cell Commun Signal, 2012, 10(1): 33
[21]Cohen P. The TLR and IL-1 signalling network at a glance. J Cell Sci, 2014, 127(Pt 11): 2383-2390
[22]Nimmerjahn F, Ravetch JV. Fcgamma receptors as regulators of immune responses. Nat Rev Immunol, 2008, 8(1): 34-47
[23]Zhang Y, Liu S, Liu J, et al. Immune complex/Ig negatively regulate TLR4-triggered inflammatory response in macrophages through Fc gamma RIIb-dependent PGE2 production. J Immunol, 2009, 182(1): 554-562
(本文编辑:张崇凡,孙晋枫)
Changesandsignificancesofhistone3acetylationofIFN-γgeneduringacutephaseofKawasakidisease
MEIJie-hua1,3,CUIDong1,3,WANGQin2,WENPeng-qiang1,XUMing-guo1,TANGGen1,LIUCong1,LICheng-rong1,WANGGuo-bing1
(1ShenzhenInstituteofPediatrics,ShenzhenChildren'sHospital,ZunyiMedicalCollege,Shenzhen518038,China; 2LabCentre,ShenzhenMaternity&ChildHealthcareHospital,SouthernMedicalUniversity,Shenzhen518028,China; 3hasequalcontribution)
Corresponding Author:WANG Guo-bing, E-mail: rogasan@163.com
ObjectiveTo investigate the changes and significances of histone 3 acetylation ofIFN-γgene in patients with acute Kawasaki disease(KD). MethodsChildren with KD were enrolled in Shenzhen Children's Hospital from February 2015 to June 2016, and sub-grouped as with or without coronary artery lesions (CAL). Age-matched healthy children attending routine physical examination were recruited as controls during the same period. Chromatin immunoprecipitation was performed to determine acetylation level of histone 3 ofIFN-γgene, and binding level of histone acetyltransferase p300 and deacetylase HDAC1/2 withIFN-γgene. The proportion of CD4+IFN-γ+ cells (Th1) and protein levels of IFN-γ, pSTAT4, pSTAT5 and T-bet were analyzed by flow cytometry. Quantitative real-time PCR was used to evaluate the levels ofIFN-γ,IL-2Rα/β,IL-12Rβ1/2,IL-18Rα/βandITLR4 mRNA in CD4+T cells. Plasma concentrations of IL-12, IL-2 and IL-18 were measured by enzyme-linked immunosorbent assay. Results① Thirty-eight children with KD, including 16 children with CAL (KD-CAL+) and 22 children without CAL(KD-CAL-), aged from 1 to 5.2 years with a mean of 2.9 years were recruited. The KD group consisted 20 males and 18 females, and 32 age-matched healthy children with 17 males were recruited as controls. No difference of age or sex was found between the two groups(P>0.05). ② The proportion of Th1, expression levels of IFN-γ protein and mRNA, and acetylation levels of histone 3 ofIFN-γgene increased remarkably during acute KD(P<0.05), and restored after IVIG therapy(P<0.05). Meanwhile, all the four items aforementioned in KD-CAL+ subgroup were higher than those in KD-CAL- subgroup (P<0.05). ③ During acute KD, binding level of p300 withIFN-γgene was up-regulated significantly whereas binding level of HDAC1/2 withIFN-γgene was down-regulated(P<0.05), resulting in the higher ratio of p300/HDAC1/2 that was positive correlated with the acetylation level ofIFN-γgene in patients in acute KD(r=0.52,P<0.05). Moreover, binding level of p300 withIFN-γgene and the ratio of p300/HDAC1/2 in KD-CAL+ subgroup were higher than those in KD-CAL- subgroup (P<0.05), while a lower binding level of HDAC1/2 withIFN-γgene was found in KD-CAL+ subgroup (P<0.05). All the three items mentioned above restored remarkably after IVIG treatment(P<0.05). ④ In comparison with healthy controls, plasma concentration of inflammatory cytokines (IL-2, IL-12 and IL-18), expression levels of their receptors(IL-2Rα/β, IL-12Rβ1/2, IL-18Rα/β and TLR4) and downstream molecules (pSTAT5, pSTAT4, T-bet and MyD88) were elevated pronouncedly during acute KD(P<0.05), and restored to some extent after IVIG treatment (P<0.05). Simultaneously, all the items mentioned before in KD-CAL+ subgroup were higher than those in KD-CAL- subgroup (P<0.05). ConclusionHyper-acetylation of histone ofIFN-γgene might be one of the important factors contributing to immune dysfunction of KD.
Kawasaki disease; IFN-γ; Histone acetylation; T helper cell 1 type; Immune
国家自然科学基金:81102227,81300124;深圳市科技计划项目:JCYJ20140416141331464, JCYJ20140416141331478,JCYJ20150403100317055;深圳市卫生计生系统科研项目:201401053,201402042,201501032资助
1 遵义医学院深圳市儿童医院儿科研究所 深圳,518038;2 南方医科大学附属深圳市妇幼保健院中心实验室 深圳,518028;3 并列第一作者
王国兵,E-mail: rogasan@163.com
10.3969/j.issn.1673-5501.2016.06.002
2016-10-12
2016-12-18)

