介入栓塞技术在儿童咯血中的应用
赵趣鸣 刘 芳
·综述·
介入栓塞技术在儿童咯血中的应用
赵趣鸣 刘 芳
咯血是指喉及喉以下呼吸道任何部位的出血经口排出的一种临床症状,可表现为痰中带血或咯鲜血。咯鲜血是儿童急重症之一 。年幼儿多不会主动排痰,因此常在出血量较大时才有咯血表现。由于咯血量无法做到精确估测,而且用统一咯血绝对值标准,评价不同体型人群也不恰当,因此目前并无咯血严重程度分级的金标准。成人常用的大咯血定义为24 h咯血量≥500 mL或每小时咯血量≥100 mL[1]。有文献[2]认为儿童大咯血较合理的定义为24 h咯血量>8 mL·kg-1。轻、中度咯血通过保守治疗大多有效,如控制原发病,静脉应用止血药物,支气管镜注入血管收缩剂或灼烧、电刀止血和气囊导管止血等。间断大咯血的病死率7%~18%,单纯保守治疗大咯血的病死率50%~100%,患儿多死于窒息而非失血本身[3]。20世纪90年代以前,外科手术是大咯血的主要治疗方案,但急诊术中因出血、窒息、支气管胸膜瘘或呼吸衰竭的病死率37%~42%。目前,对于栓塞治疗无效的曲霉菌病、创伤性肺血管损伤和支气管腺瘤,外科手术仍为首选[4]。成人中介入栓塞治疗咯血的技术已十分成熟,尤其是支气管动脉栓塞(BAE),已成为大咯血和反复咯血最有效和安全的一线治疗方案[5]。然而,国内外只有少数医疗机构开展儿童咯血的栓塞治疗[6-8]。本文对儿童咯血的病因机制、介入栓塞所要求的解剖基础和技术要点做一综述,以提高儿科工作者对儿童大咯血的认识和救治水平。
1 儿童咯血的病因和机制
1.1 咯血病因 成人最常见的咯血病因为支气管扩张、慢性阻塞性肺病、结核和肿瘤。儿童咯血病因更为复杂,而且病因分布受患儿年龄、国家和当地结核发病率的影响 。国外资料[5,8-11]显示,儿童咯血最常见的病因是急性下呼吸道感染、支气管扩张[继发于囊性纤维化(CF)、纤毛运动障碍、感染]、先天性心脏病和气管异物,其中下呼吸道感染占40%。国内资料[7,12,13]显示,儿童咯血常见病因依次为特发性肺含铁血黄素沉着症(IPH)、肺部感染、肺血管畸形、先天性心脏病和肿瘤。换个角度来划分病因,结核和其他慢性肺部感染是发展中国家儿童最常见的咯血病因,CF是欧洲发达国家儿童最常见的咯血病因。Sim等[8]研究了年龄和咯血病因的关系:婴幼儿以感染和牛奶蛋白过敏为主,青春期儿童 则以血管炎、气管肿瘤和支气管扩张为主。先天性心脏病相关的咯血在婴儿期与青春期均多见[5]。若找不到病因即归类为特发性或隐源性。
1.2 咯血机制 肺脏具有肺动脉(占99%)与支气管动脉(占1%)的双重供血,前者主要参与气体交换,后者主要滋养气道的支撑结构、肺实质内的支气管小分支、肺动静脉壁、主动脉壁、横膈、脏层胸膜、中央食管以及隆突下淋巴结[14]。由于体动脉压力高于肺动脉6倍左右,体动脉一旦破裂,出血明显。因此90%的大咯血来自支气管动脉和异常情况下供血肺部的非支气管性体动脉(NBSA),10%来自肺动脉[15]。许多急慢性肺病存在低氧性血管收缩、血管内血栓形成或血管炎,此时肺泡水平的肺动脉血流减少,刺激血管生长因子分泌,使支气管动脉及其与肺动脉间的吻合血管代偿性增生扩张,或形成NBSA供血病变区域肺组织,在体循环压力下,薄而脆的血管壁易破裂至肺泡或支气管,导致咯血[15,16]。肺动脉源性咯血主要见于肺动静脉瘘(PAVF),由于动静脉瘘管腔大壁薄,易形成动脉瘤并自发破裂引起咯血[17]。
2 介入栓塞治疗的应用解剖
2.1 支气管动脉和脊髓分支 熟悉支气管动脉的起源位置是介入栓塞治疗的第一步。Cauldwell等[18]基于150例成人尸体解剖发现了几种支气管动脉分布模式(图1),其中40.6%为 1型,表现为1支右支气管动脉(RBA)发自于肋间动脉的共干(ICBT)+2支左支气管动脉(LBA)发自主动脉;21.3%为2型,表现为1支 RBA发自ICBT+1支LBA发自主动脉;20.6%为3型,表现为2支RBA分别发自ICBT和主动脉+2支LBA分别发自主动脉;9.7%为4型,表现为2支RBA分别发自ICBT和主动脉+1支LBA发自主动脉。正常位支气管动脉起源于胸主动脉T5上缘和T6下缘之间(约70%),大致位于正对左主支气管后方的主动脉水平,在入肺门前常走行于气管和主支气管后方[19]。其他部位起源的支气管动脉称为异位支气管动脉(8.3%~35%),可能发自主动脉弓、乳内动脉、甲状颈干、椎动脉、锁骨下动脉、肋颈干、头臂动脉、心包膈动脉、膈下动脉或腹主动脉。异常的支气管动脉同样沿着主支气管走行[20]。生理情况下,支气管动脉与肺动脉在支气管和肺叶水平存在许多交通支(最大内径达325 μm),形成生理性右向左分流,占心输出量的5%[21]。支气管静脉通常经奇静脉、半奇静脉和上腔静脉回流,也可通过支气管静脉肺静脉间的交通支回流[22]。大多数情况(>80%)右支气管动脉和右肋间动脉共干(RICBT),而5%~10%的RICBT发出脊髓分支(根动脉),在栓塞前通过造影识别并避开脊髓分支十分重要[23]。正常情况下,肋间动脉发出根动脉,后者通过椎间孔进入脊髓,根动脉的分支前根髓动脉向上走行,并在正中矢状位突然下降形成特征性的“发夹征”和脊髓前动脉相连(图2)[24]。其中Adamkiewicz动脉是最大的前根髓动脉,多发自T9~12水平(74%),但有时也发自T5~8水平(15%),且多为左侧起源(80%),是胸腰段脊髓(下2/3)的主要供应血管,一旦误栓塞易发生脊髓梗死和截瘫等严重并发症[25]。因此,造影识别“发夹征”是鉴别脊髓分支的关键。
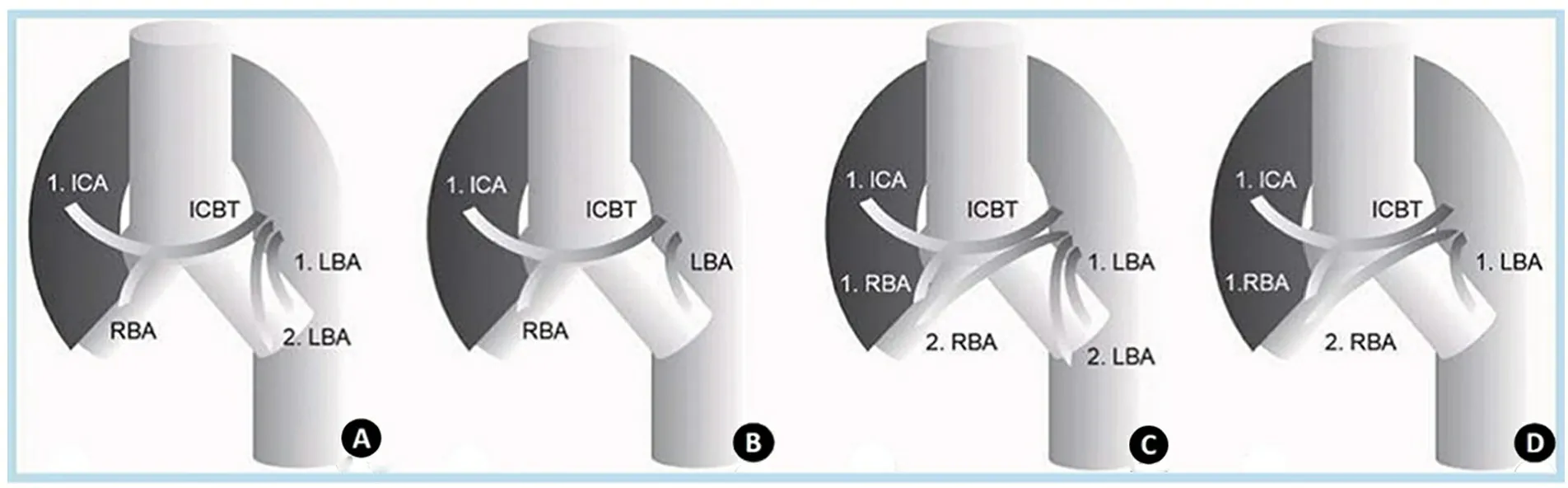
图1 4种主要的支气管动脉解剖[26]
注 ICA:肋间动脉;RBA:右支气管动脉;LBA:左支气管动脉;ICBT:支气管动脉肋间动脉共干

图2 右支气管动脉造影显示“发夹征”[24]
注 箭头所指纤细垂直走行的血管为脊髓前动脉
2.2 NBSA 增粗扭曲,通过壁层胸膜或肺韧带供血肺实质,其走行与支气管不平行[27]。当存在合并胸膜黏连的慢性肺病时,应考虑NBSA导致病变区域血管过度增生和咯血的可能。研究发现NBSA破裂是大咯血最主要的原因(41%~88%)[28],若CT增强血管成像(CTA)发现病变区域胸膜厚度>3mm,且胸膜外脂肪层可见体动脉血管,则更加确定NBSA为咯血责任血管[24]。这些动脉多起源于主动脉弓上血管分支(头臂动脉、锁骨下动脉、甲状颈干和肋颈干)、腋动脉、肋间动脉、乳内动脉、膈下动脉、胃动脉或腹腔干[27]。此外,病变肺实质和受累胸膜增厚黏连的部位对NBSA的起源有一定提示作用,肺后部病变的NBSA可能来源于肋间动脉,肺尖部病变可能来源于锁骨下动脉分支,肺前上部病变可能来源于乳内动脉,肺基底部病变可能来源于膈下动脉[29]。从颈部到上腹部的胸部CTA三维重建能很好显示异位支气管动脉和NBSA,遗漏了异位支气管动脉和NBSA往往是栓塞失败或复发咯血的重要原因[30,31]。此外,在支气管动脉和NBSA之间可能存在许多交通支[24],栓塞时要注意避免栓塞剂通过侧枝进入正常体动脉发生异位栓塞(如锁骨下动脉及其分支),而且任何体动脉都有可能发出脊髓分支,仍强调通过造影的“发夹征”识别。
2.3 肺动脉 引起咯血少见,当支气管动脉和NBSA栓塞无效时应怀疑肺动脉源咯血可能性。有研究显示,肺动脉来源咯血的CT影像表现为肺动脉瘤或假性动脉瘤,瘤内气泡影,以及肺动脉位于出血区域的腔内[32,33]。肺动脉出血的可能病因为肺动脉坏死(活动性结核、肺脓肿、曲霉菌病、肺癌坏死腔)、血管炎、Swan-Ganz留置导管损伤和PAVF。PAVF患者血栓和细菌不通过肺毛细血管床,直接进入肺静脉,可导致一过性脑缺血和脑脓肿,该病占遗传性出血性毛细血管扩张症(HHT)患者的15%~50%,在孕中、晚期破裂出血的概率大[34]。研究显示10%~14%PAVF可发生咯血,PAVF合并HHT的人群中8%有大咯血或血胸[35]。
3 咯血的介入栓塞治疗
3.1 适应证 药物治疗无效的中或重度咯血是介入栓塞治疗的适应证。慢性和反复咯血若符合以下情况之一也可行栓塞治疗[36]:①发生过大咯血;②病因治疗疗程结束2周内复发;③药物治疗无效;④肺移植前缓解症状。
3.2 术前准备 除了常规的血细胞,肝、肾和凝血功能检查,介入栓塞治疗前最重要的是明确病变部位和定位责任血管。X线胸片和支气管镜分别能发现17%~80%和10%~91%患者的出血部位,但若出血量大或弥漫时易影响支气管镜的视野[24]。CTA则更加敏感,有助于判断肺实质或纵隔病变,定位出血部位(肺泡或气道)。最有价值的是能通过三维重建明确病变的支气管动脉或NBSA部位以指导介入栓塞治疗,甚至可显示脊髓动脉,极大缩短手术时间,减少造影次数和漏栓现象[37]。但仍可能有20%~30%患者通过上述检查无法定位出血部位[38]。
3.3 术中操作
3.3.1 麻醉 儿童介入栓塞治疗建议在全麻呼吸机辅助通气下进行,以便于获得更好的数字减影图像并减少患儿痛苦[39]。对于能配合术中屏气的较大年龄儿童(如青春期) ,虽可考虑局部麻醉,但术中咳嗽可能使导管移位或影响图像质量,甚至可能发生大咯血窒息。但也有报道CF患者由于麻醉诱导和正压通气出现致命性大咯血而死亡[40]。
3.3.2 造影 可选择的造影导管包括Cobra、Simmon、RLG、RH、Mik和Headhunter导管。由于支气管动脉最常起源于T5~6水平,因此先行胸主动脉造影寻找支气管动脉和可能存在的NBSA。但即便造影未见明显异常,也应该选择性支气管动脉造影,因为内径正常也不能除外责任血管[41]。若支气管动脉确认无异常,再根据已知的出血部位仔细寻找NBSA,包括肋间、锁骨下和膈下动脉[42]。若怀疑肺下叶出血,应行低位胸部或上腹部主动脉造影明确是否膈动脉来源。若均未发现体动脉来源责任血管,应行肺动脉造影除外肺动脉瘤和肺动静脉畸形。也有学者建议[43]先行锁骨下动脉或其分支造影,这有助于发现这些血管与支气管动脉间可能存在的侧枝并先进行栓塞,因为若先行支气管动脉栓塞,一旦栓塞剂堵塞支气管动脉末梢后就会通过侧枝反流入锁骨下动脉,导致异位栓塞。最后再行胸主动脉造影(造影剂总量≤5~7 mL·kg-1)以寻找之前造影未发现的支气管动脉或侧枝(部分侧枝在支气管动脉栓塞后才显影明显)。责任血管的造影表现为[22,44,45]支气管动脉增粗扭曲(>2 mm)、局部血管丰富和许多新生血管、支气管动脉血流直接进入肺动脉或肺静脉和支气管动脉瘤。而作为活动性咯血的特异性征象的对比剂外渗则比较少见(3.6%~10.7%)[14]。
3.3.3 栓塞 在确认责任血管后,进一步判断能否进行栓塞。前提是责任血管与脊髓分支无沟通,以及选择的栓塞剂不会通过异常的支气管动脉-肺循环分流或侧枝血管发生体循环误栓塞。但因为支气管动脉较长且变异大,脊髓分支的开口位置因人而异,其显影常在支气管动脉栓塞过程中血流重新分布之后才变得明显[23]。若常规导管无法进入支气管动脉的安全栓塞部位(跨过脊髓分支),可使用同轴微导管技术进行超选择性栓塞[42,46,47]。将4~5F导引导管置于支气管动脉开口后,送入2~3F的同轴微导管至责任血管的最远端。然后在连续透视下通过微导管间断控制性注入栓塞剂,以避免栓塞剂反流入主动脉或脊髓分支。但也有学者认为[15]微导管导致支气管动脉痉挛、穿孔和夹层的可能性更高,因此若在支气管动脉开口就能进行安全栓塞的话,更推荐使用4F或5F导管。手推对比剂造影的速度与剂量取决于对应支气管动脉的大小和图像清晰程度,推注造影剂时要及时、反复确认有无栓塞剂反流和危险的交通支,后者在过度增生的血管被栓塞后变得明显。当推注的造影剂逐渐停滞或超过95%的异常外周血管分支被栓塞即为栓塞成功[36]。PAVF的栓塞应先识别滋养动脉,导管尽可能靠近瘘管或囊腔,根据瘘管或囊腔的大小粗细选择合适的栓塞材料,如弹簧圈、动脉导管未闭封堵器、血管塞和可脱落球囊[48,49]。对于肺动脉假性动脉瘤需要在瘤体的近端和远端分别栓塞[50,51],但对于癌症只需近端栓塞[52]。
3.3.4 栓塞剂的选择 目前一线的栓塞材料为颗粒或微球,大小的选择取决于血管过度增生化程度、体肺分流和导管大小[36]。栓塞剂应该与对比剂混合,有助于在整个透视过程中观察栓塞效果。理想情况下,导管需避开所有侧枝和脊髓分支开口送至责任血管的最远端,然后选择尽量小的颗粒栓塞,这样栓塞效果好,发生血管再通和咯血复发的可能性小。但颗粒过小可能会进入支气管动脉的正常小分支,导致其供血的组织(如食管壁或主动脉壁)坏死,也可能通过异常的支气管动脉-肺循环吻合口,导致肺梗死或体循环栓塞[39]。由于支气管动脉-肺循环吻合口可达325 μm,因此一般情况选择直径>300 μm的颗粒较合理,而且能减少脊髓缺血和支气管坏死等并发症。研究发现355~500 μm与500~710 μm两种颗粒栓塞效果无明显差异[53]。每种栓塞剂都有各自的优缺点,不同医院和医生有不同的选择习惯。下面对常用的几种栓塞剂做一介绍。
3.3.4.1 聚乙烯醇(PVA) 是最常用的栓塞剂,可选的颗粒直径范围广(150~1 400 μm),常用的直径为355~500 μm[54]。不可吸收的PVA颗粒通过颗粒间隙中血栓物质机化达到血管内永久栓塞效果。PVA颗粒透光,需要与对比剂混合使成均匀的混悬液,但因其为大小不一的不规则多孔海绵颗粒状物,此过程中颗粒可能聚集,导致注射时造成导管堵塞,或在达到责任血管末梢之前就已堵塞血管,甚至造成非责任血管栓塞[55]。此外,虽然PVA栓塞理论上应该是永久性的,但由于有时并不能达到末梢栓塞,导致栓塞不完全,发生血管再通现象[36,46,56,57]。因此越来越多的医学中心更倾向选择其他栓塞材料[55,58-60]。
3.3.4.2 微球(Microsphere) 微球的直径等级在40~1 200 μm,每200~300 μm增加一等级。微球在血管内通过引起局部炎症和纤维化以阻塞血流[54]。与PVA不同的是,其为球形结构,大小一致,且表面光滑,亲水性好,并具有20%~30%弹性以适应微导管大小,不发生颗粒聚集。最重要的是,微球能更好到达预期的栓塞部位,而不会在之前发生血管内聚集,因此也为可能需要的再栓塞提供条件。相比PVA,应该选择直径偏大的微球进行栓塞(>500 μm)[61]。复旦大学附属儿科医院心血管中心使用的是预装注射器包装的Embosphere微球(三丙烯胶原包裹微球),微球直径500~700 μm; 每个注射器内为无菌无热原生理盐水,含有1或2 mL微球; Embosphere微球也不透X光,需与注射器中总体积相同的造影剂,配制出1∶1微球/生理盐水+造影剂的溶液; 将20 mL注射器轻轻颠倒几次,使微球造影剂溶液悬浮均匀,连接到三通活塞的一端; 在活塞另一端连接一个1 mL或 3 mL注射器; 等待3~5 min,让微球在溶液中充分悬浮后缓慢、轻轻地抽取到注射器中; 在透视下采用缓慢搏动性注射将注射器中的微球/生理盐水+造影剂溶液注入,同时观察造影剂的流速; 如果流速没有变化,则再次注射微球/生理盐水+造影剂溶液重复输送操作; 如果首次注射后造影剂流速无变化,可考虑换用更大尺寸的微球。
3.3.4.3 α-氰基丙烯酸丁酯(NBCA) 是永久液体栓塞剂,其优势为栓塞快速完全、可通过调整聚合速率控制栓塞、手术时间短[55]。NBCA一旦接触到血液或其他离子液体就迅速聚合,并通过发热反应破坏血管壁。由于其快速聚合特性,需要用同轴导管技术精确定位到病变部位进行栓塞。但NBCA的主要缺点是作为异物产生的炎症反应[54]。NBCA可改变聚合化速度以调整血管穿透的程度,使术者更容易控制责任血管的栓塞。有学者[55]根据责任血管的特征选择合适的NBCA浓度,对于血流快的大血管和伴有明显支气管动-脉肺动脉分流者,用低浓度NBCA加入碘化油(1∶2至1∶3)以达到快速聚合,血流慢的小血管则用1:4混合,在随访中未发现肺实质梗死和气道异常的并发症。该研究同时显示相比PVA颗粒,NBCA栓塞患者的治愈率更高,并发症发生率并不增加,尤其是对于支气管扩张患者。即便有凝血障碍,NBCA的成功率也很高[62]。
3.3.4.4 明胶海绵颗粒 为多孔海绵颗粒状物,不溶于水,但在体内可降解,是中期栓塞物质,完全降解需要14~90 d。组织反应小,但复发率高,可能与明胶海绵逐渐吸收过程中病变血管部分血运重建或病变侧枝循环的形成有关[62]。因此明胶海绵应尽可能与其他长效栓塞剂联合使用以提高疗效。
3.3.4.5 弹簧圈 具有高度血栓形成性、不透射线和高生物相容性。弹簧圈一般不作为首选单独使用[54],且应避免在责任血管主干近端栓塞(纵隔和近肺门处),因为该部位处会产生大量的血管交通支,形成丰富的纵膈与支气管动脉侧枝供血栓塞远端,除了影响栓塞效果,近端栓塞彻底阻断了最直接的血管通路,给咯血复发后的二次栓塞增加了难度。因此,仅在以下情况可考虑使用弹簧圈[15,23,27,42]:①栓塞肺动脉瘤和肺动静脉畸形;②导管能到达病变最远端行末梢栓塞;③无法避开脊髓动脉,颗粒/微球反流时发生误栓塞的风险极大时;④支气管动脉与体动脉间有重要侧枝沟通,且导管无法避开侧枝开口进行超选择性栓塞,可先用弹簧圈保护性栓塞侧枝;⑤需要紧急处理正在进行的大咯血,而来不及用其他栓塞剂时。
4 介入栓塞的疗效和并发症
4.1 疗效 介入栓塞治疗的主要目的是快速控制出血,手术成功率73%~99%[22]。但作为姑息治疗手段无法根除咯血病因,术后46个月的咯血复发率10%~55%[22]。早期咯血复发率10%~29%(栓塞后数周和数月),主要原因为责任血管栓塞不完全;远期咯血复发率10%~60%,多见于曲霉菌病和肺癌,主要原因为栓塞血管再通或原发病进展形成侧枝循环,其中侧枝循环的建立在咯血复发中占70%,此时再次介入栓塞有助于缓解出血[27,39,42]。介入栓塞治疗的预后受原发病严重程度的影响,原发病不解除,2~5年咯血复发率较高[42]。如BAE联合抗结核治疗对肺结核大咯血的预后较好,而曲霉菌病和肺癌预后较差,CF患者总体咯血复发率60%。Amplazter血管塞栓塞PAVF的成功率为97%,再通率7%[63]。凝血功能异常是预后不良的独立危险因素,BAE常难控制出血[62]。
4.2 并发症 最常见的BAE并发症为胸痛和吞咽困难,发生率分别为24%~91%和1%~18%。这些症状多是一过性的,可能与肋间动脉和食管动脉的误栓塞有关[24]。最严重的BAE并发症为术中死亡,虽然罕见,但报道多与气管插管和正压通气并发症有关[64]。其次为脊髓缺血和截瘫,前者表现为横贯性脊髓炎,发生率1.4%~6.5%[65],多为自限性。动物实验表明≥100 μm的颗粒不会进入脊髓分支[66]。超选择性栓塞以及>350 μm栓塞剂的应用可减少脊髓前动脉损伤的发生率。其他并发症包括:支气管坏死,非靶器官误栓塞(如缺血性结肠炎、肺梗死),支气管食管瘘,心肌梗死(可能与冠状动脉侧枝有关),膈神经麻痹,主动脉夹层(最多6.3%),一过性皮质性失明[67,68]。
5 总结
咯血是儿童少见但严重的症状。随着近年来导管和栓塞材料的改进,栓塞成功率的提高,介入栓塞治疗也已成为儿童大咯血和反复咯血的一线治疗,极大提高了大咯血住院患儿的生存率,并为明确诊断或手术治疗争取宝贵时间。但栓塞治疗只能缓解咯血症状而无法消除原发病,病因治疗仍是预防远期咯血复发的关键。
[1]Rali P, Gandhi V, Tariq C. Massive Hemoptysis. Critical care nursing quarterly, 2016, 39(2): 139-147
[2]Batra PS, Holinger LD. Etiology and management of pediatric hemoptysis. Arch Otolaryngol Head Neck Surg, 2001, 127(4): 377-382
[3]Bhatia P, O'Reilly JF, Karthik S, et al. Massive haemoptysis: causes and management. Ir Med J, 2004, 97(2): 52-53
[4]Velly JF, Jougon J, Laurent FS, et al. Massive haemoptysis: management and treatment. What is the role of surgery?. Rev Mal Respir, 2005, 22(5 Pt 1): 777-784
[5]Simon DR, Aronoff SC, Del Vecchio MT. Etiologies of hemoptysis in children: A systematic review of 171 patients. Pediatric pulmonology, 2016
[6]Abu-Kishk I, Klin B, Eshel G. Hemoptysis in children: a single institutional experience. Pediatric emergency care, 2012, 28(11): 1206-1210
[7]陈和斌, 陆小霞, 蒋鲲. 儿童反复咯血的病因及临床诊治分析. 中国当代儿科杂志, 2014, (3): 281-284
[8]Sim J, Kim H, Lee H, et al. Etiology of hemoptysis in children: a single institutional series of 40 cases. Allergy Asthma Immunol Res, 2009, 1(1): 41-44
[9]Singh D, Bhalla AS, Veedu PT, et al. Imaging evaluation of hemoptysis in children. World J Clin Pediatr, 2013, 2(4): 54-64
[10]Haura L, Warachit B, Makkoch J, et al. Hemoptysis in children with pandemic influenza H1N1 2009 infection. Southeast Asian J Trop Med Public Health, 2009, 40(6): 1259-1263
[11]Godfrey S. Hemoptysis in children. Pediatr Pulmonol Suppl, 2004, 26,177-179
[12]郦琳琳, 梁慧, 王全, 等. 纤维支气管镜在儿童咯血病因诊断和治疗中的价值. 临床儿科杂志, 2014, (3): 238-241
[13]严曼榕, 符州, 田代印. 102例小儿咯血病因及临床诊治分析. 重庆医学, 2016,45 (9): 1192-1194
[14]Chun JY, Morgan R, Belli AM. Radiological management of hemoptysis: a comprehensive review of diagnostic imaging and bronchial arterial embolization. Cardiovasc Intervent Radiol, 2010, 33(2): 240-250
[15]Khalil A, Fedida B, Parrot A, et al. Severe hemoptysis: From diagnosis to embolization. Diagn Interv Imaging, 2015, 96(7-8): 775-788
[16]Ghanaati H, Shakouri Rad A, Firouznia K, et al. Bronchial artery embolization in life-threatening massive hemoptysis. Iran Red Crescent Med J, 2013, 15(12): e16618
[17]Majeed FA, Ghumman AQ, Chatha SS. Pulmonary arteriovenous malformation (PAVM): rare cause of hemoptysis. J Ayub Med Coll Abbottabad, 2013, 25(3-4): 100-102
[18]Cauldwell EW, Siekert RG, et al. The bronchial arteries; an anatomic study of 150 human cadavers. Surg Gynecol Obstet, 1948, 86(4): 395-412
[19]Morita Y, Takase K, Ichikawa H, et al. Bronchial artery anatomy: preoperative 3D simulation with multidetector CT. Radiology, 2010, 255(3): 934-943
[20]Pelage JP. Bronchial artery embolization: anatomy and technique. Tech Vasc Interv Radiol, 2007, 10(4): 274-275
[21]Deffebach ME, Charan NB, Lakshminarayan S, et al. The bronchial circulation. Small, but a vital attribute of the lung. Am Rev Respir Dis, 1987, 135(2): 463-481
[22]Sopko DR, Smith TP. Bronchial artery embolization for hemoptysis. S Semin Intervent Radiol, 2011, 28(1): 48-62
[23]Brown AC, Ray CE. Anterior Spinal Cord Infarction following Bronchial Artery Embolization . Semin Intervent Radiol, 2012, 29(3): 241-244
[24]Yoon W, Kim JK, Kim YH, et al. Bronchial and nonbronchial systemic artery embolization for life-threatening hemoptysis: a comprehensive review . Radiographics, 2002, 22(6): 1395-1409
[25]N'da HA, Chenin L, Capel C, et al. Microsurgical anatomy of the Adamkiewicz artery-anterior spinal artery junction . Surg Radiol Anat, 2016, 38(5): 563-567
[26]Ittrich H, Klose H, Adam G. Radiologic management of haemoptysis: diagnostic and interventional bronchial arterial embolisation . Rofo, 2015, 187(4): 248-259
[27]Cornalba GP, Vella A, Barbosa F, et al. Bronchial and nonbronchial systemic artery embolization in managing haemoptysis: 31 years of experience. Radiol Med 2013, 118(7): 1171-1183
[28]Yoo DH, Yoon CJ, Kang SG, et al. Bronchial and nonbronchial systemic artery embolization in patients with major hemoptysis: safety and efficacy of N-butyl cyanoacrylate . AJR Am J Roentgenol, 2011, 196(2): W199-204
[29]Cheng Z, Shang J, Tang J, et al. Evaluations of bronchial and nonbronchial systemic arteries in patients with hemoptysis at dual-source computed tomograph: comparison with conventional angiography. Zhonghua yi xue za zhi, 2014, 94(43): 3370-3373
[30]Davoodi M, Kordi M, Gharibvand MM, et al. Hemoptysis: comparison of diagnostic accuracy of multi detector CT scan and bronchoscopy . Glob J Health Sci, 2015, 7(3): 373-377
[31]Chalumeau-Lemoine L, Khalil A, Prigent H, et al. Impact of multidetector CT-angiography on the emergency management of severe hemoptysis . Eur J Radiol, 2013, 82(11): e742-747
[32]Vaideeswar P, Karande S, Yadav S, et al. Pulmonary Artery Pseudoaneurysm: A Rare Cause of Hemoptysis in a Child. Pediatr Dev Pathol, 2016, 19(2): 146-149
[33]Al Amri SM, Banjar AH, Cheema AI. Multiple pulmonary artery aneurysms: a rare cause of massive hemoptysis as presentation of Behcet's disease. J Coll Physicians Surg Pak, 2014, 24 (Suppl 3): S275-S277
[34]Faughnan ME, Palda VA, Garcia-Tsao G, et al. International guidelines for the diagnosis and management of hereditary haemorrhagic telangiectasia. J Med Genet, 2011, 48(2): 73-87
[35]Circo S, Gossage JR. Pulmonary vascular complications of hereditary haemorrhagic telangiectasia. Curr Opin Pulm Med, 2014, 20(5): 421-428
[36]Syha R, Benz T, Hetzel J, et al. Bronchial Artery Embolization in Hemoptysis: 10-Year Survival and Recurrence-Free Survival in Benign and Malignant Etiologies-A Retrospective Study. Rofo, 2016, 188(11): 1061-1066
[37]Hayes D Jr1, Winkler MA, Kirkby S, et al. Preprocedural planning with prospectively triggered multidetector row CT angiography prior to bronchial artery embolization in cystic fibrosis patients with massive hemoptysis. Lung, 2012, 190(2): 221-225
[38]Adachi T, Oki M, Saka H. Management Considerations for the Treatment of Idiopathic Massive Hemoptysis with Endobronchial Occlusion Combined with Bronchial Artery Embolization. Intern Med, 2016, 55(2): 173-177
[39]Roebuck DJ, Barnacle AM. Haemoptysis and bronchial artery embolization in children. Paediatr Respir Rev, 2008, 9(2): 95-104
[40]Khalil A, Fartoukh M, Tassart M, et al. Role of MDCT in identification of the bleeding site and the vessels causing hemoptysis . AJR Am J Roentgenol, 2007, 188(2): W117-215
[41]Battal B, Saglam M, Ors F, et al. Aberrant right bronchial artery originating from right coronary artery - MDCT angiography findings. Br J Radiol 2010, 83(989): e101-104
[42]Fruchter O, Schneer S, Rusanov V, et al. Bronchial artery embolization for massive hemoptysis: long-term follow-up . Asian Cardiovasc Thorac Ann, 2015, 23(1): 55-60
[43]Kalva SP. Bronchial artery embolization. Tech Vasc Interv Radiol, 2009, 12(2): 130-138
[44]Daliri A, Probst NH, Jobst B, et al. Bronchial artery embolization in patients with hemoptysis including follow-up. Acta Radiol, 2011, 52(2): 143-147
[45]Jiang S, Sun XW, Yu D, Jie B, et al. Endovascular embolization of bronchial artery originating from the upper portion of aortic arch in patients with massive hemoptysis. Cardiovasc Intervent Radiol, 2014, 37(1): 94-100
[46]Shao H, Wu J, Wu Q, et al. Bronchial artery embolization for hemoptysis: a retrospective observational study of 344 patients. Chin Med J (Engl), 2015, 128(1): 58-62
[47]Bhalla A, Kandasamy D, Veedu P, et al. A retrospective analysis of 334 cases of hemoptysis treated by bronchial artery embolization. Oman Med J, 2015, 30(2): 119-128
[48]Tau N, Atar E, Mei-Zahav M, et al. Amplatzer Vascular Plugs Versus Coils for Embolization of Pulmonary Arteriovenous Malformations in Patients with Hereditary Hemorrhagic Telangiectasia. Cardiovasc Intervent Radiol, 2016, 39(8): 1110-1114
[49]Park J, Kim HJ, Kim JM, et al. Successful Treatment of a Large Pulmonary Arteriovenous Malformation by Repeated Coil Embolization. Tuberc Respir Dis (Seoul), 2015, 78(4): 408-411
[50]Trambert JJ, Abubaker SJ, Kanner BJ. Giant mycotic pulmonary artery pseudoaneurysm treated by guide wire and coil embolization . J Vasc Interv Radiol, 2014, 25(10): 1643-1645
[51]Sridhar SK, Sadler D, McFadden SD, et al. Percutaneous embolization of an angiographically inaccessible pulmonary artery pseudoaneurysm after blunt chest trauma: a case report and review of the literature. J Trauma, 2010, 69(3): 729
[52]Zhang J, Jiang S. Massive haemoptysis from a central pulmonary arterial pseudoaneurysm secondary to advanced lung cancer: successful treatment by Guglielmi detachable coil embolization. Clin Respir J, 2015
[53]Kervancioglu S, Bayram N, Gelebek Yilmaz F, et al. Radiological findings and outcomes of bronchial artery embolization in cryptogenic hemoptysis. J Korean Med Sci, 2015, 30(5): 591-597
[54]Leyon JJ, Littlehales T, Rangarajan B, et al. Endovascular embolization: review of currently available embolization agents. Curr Probl Diagn Radiol, 2014, 43(1): 35-53
[55]Woo S, Yoon CJ, Chung JW, et al. Bronchial artery embolization to control hemoptysis: comparison of N-butyl-2-cyanoacrylate and polyvinyl alcohol particles. Radiology, 2013, 269(2): 594-602
[56]Pathak V, Stavas JM, Ford HJ, et al. Long-term outcomes of the bronchial artery embolization are diagnosis dependent. Lung India, 2016, 33(1): 3-8
[57]Mehta AS, Ahmed O, Jilani D, et al. Bronchial artery embolization for malignant hemoptysis: a single institutional experience. J Thorac Dis, 2015, 7(8): 1406-1413
[58]Hahn S, Kim YJ, Kwon W, et al. Comparison of the effectiveness of embolic agents for bronchial artery embolization: gelfoam versus polyvinyl alcohol. Korean journal of radiology, 2010, 11(5): 542-546
[59]朱兴龙, 徐高峰, 吉洪海, 等. Embosphere微球动脉内栓塞治疗大咯血临床效果研究. 实用医学影像杂志, 2013, (1): 26-28
[60]李春龙, 金泳海, 邹建伟, 等. 应用Embosphere微球栓塞治疗急性大咯血的临床研究. 当代医学, 2011, (5): 73-74
[61]Vinaya KN, White RI Jr, Sloan JM. Reassessing bronchial artery embolotherapy with newer spherical embolic materials. J Vasc Interv Radiol, 2004, 15(3): 304-305
[62]Yonemitsu T, Kawai N, Sato M, et al. Evaluation of transcatheter arterial embolization with gelatin sponge particles, microcoils, and n-butyl cyanoacrylate for acute arterial bleeding in a coagulopathic condition. J Vasc Interv Radiol, 2009, 20(9): 1176-1187
[63]Letourneau-Guillon L, Faughnan ME, Soulez G, et al. Embolization of pulmonary arteriovenous malformations with amplatzer vascular plugs: safety and midterm effectiveness . J Vasc Interv Radiol, 2010, 21(5): 649-656
[64]McDougall RJ, Sherrington CA. Fatal pulmonary haemorrhage during anaesthesia for bronchial artery embolization in cystic fibrosis. Paediatr Anaesth, 1999, 9(4): 345-348
[65]Ramírez Mejía AR, Méndez Montero JV, Vásquez-Caicedo ML, et al. Radiological Evaluation and Endovascular Treatment of Hemoptysis. Curr Probl Diagn Radiol, 2016, 45(3): 215-224
[66]Boushy SF, Helgason AH, North LB. Occlusion of the bronchial arteries by glass microspheres. Am Rev Respir Dis, 1971, 103(2): 249-263
[67]Massi F, Muretti M, Coradduzza E, et al. Myocardial infarction and rupture after bronchial artery embolization. Ann Thorac Surg, 2015, 99(3): 1051-1053
[68]van Doorn CS, De Boo DW, Weersink EJ, et al. Permanent cortical blindness after bronchial artery embolization. Cardiovasc Intervent Radiol, 2013, 36(6): 1686-1689
(本文编辑:张崇凡,孙晋枫)
10.3969/j.issn.1673-5501.2016.06.013
上海市自然科学基金:152R1404300
复旦大学附属儿科医院心内科,上海,201102
刘芳,E-mail: liufang@fudan.edu.cn
2016-11-02
2016-12-16)

