低钠血症纠正时诱发渗透性脱髓鞘综合征1例
黄祺卜瑞芳程海燕朱圣炜
低钠血症纠正时诱发渗透性脱髓鞘综合征1例
黄祺*卜瑞芳*程海燕*朱圣炜*
低钠血症渗透性脱髓鞘综合征
渗透性脱髓鞘综合征(osmotic demyelination syndrome,ODS)是一种少见的急性非炎性中枢脱髓鞘病变,根据其发生部位不同可分为脑桥中央髓鞘溶解症(central pontine myelinolysis,CPM)和脑桥外髓鞘溶解症(extrapontine myelinolysis,EPM),两者可以单独存在也可以同时发生。其主要特点是临床症状与影像学表现不同步,故易漏诊、误诊,导致患者遗留严重的永久性神经病变甚至死亡。目前国内关于长期服用利尿剂导致低钠血症在治疗过程中诱发ODS的报告尚未检索到。我科收治1例因长期服用吲达帕胺导致慢性重度低钠血症(血钠<120 mmol/L)在纠正过程中出现的ODS,现报告如下。
1 临床资料
患者男性,65岁,因“发热、咳嗽2周,纳差、呕吐、嗜睡3 d”于2015年3月9日入院。患者入院前2周因受凉后出现发热、咳嗽在当地医院就诊,予头孢类抗生素静滴治疗3 d后体温正常,当时神志清,无言语、活动障碍,饮食、二便正常。入院前3 d患者突然出现纳差,进食后易恶心、呕吐,并逐渐加重出现嗜睡,呼之能应,口齿不清,时有言语混乱,至我院急诊,查肝肾功能示:钾2.57 mmol/L(正常参考值范围3.5~5.5 mmol/L),钠102.9 mmol/L(135~155 mmol/ L),氯58.3 mmol/L(96~108 mmol/L),总胆红素42.2µmol/L (3~25µmol/L),渗透压213.9 mOsm/KgH2O(270~310 mOsm/ KgH2O),头胸全腹部CT:两侧基底节区及额顶叶腔隙灶,右肺下叶感染,小结节,右侧胸膜增厚,左肾类圆形低密度灶,左侧肾上腺稍增粗,肝右叶密度欠均匀,伪影可能。予抗感染、纠正电解质紊乱,1 d后复查电解质:钾2.68 mmol/ L,钠112.8 mmol/L,氯76.4 mmol/L,收入病房。患者10年前在外院诊断为高血压病,长期口服缬沙坦40 mg每天1次和吲达帕胺2.5 mg每天1次控制血压,从未监测电解质,平时活动强度大时稍感乏力不适,休息后可好转。既往体质良好,无营养不良,无饮酒嗜好。
入院查体:血压120/70 mmHg,神志清,嗜睡,呼之能应,精神软,答题切,口齿欠清,双侧瞳孔等大等圆,对光反射存在,颈软,两肺呼吸音粗,未及干湿啰音,心率76次/ min,律齐,腹平软,无压痛、反跳痛,肝脾肋下未及,四肢肌张力正常,肌力5级,生理反射存在,病理反射未引出。
辅助检查:血常规:白细胞11.4×109/L(4~10×109/L),中心粒细胞百分比0.92(0.50~0.75),淋巴细胞百分比0.034 (0.2~0.4),C反应蛋白21 mg/L(0~8mg/L),血细胞比容:0.35,电解质:钾2.89 mmol/L,钠122.5 mmol/L,氯87.8 mmol/L,钙1.93 mmol/L(2.0~2.8 mmol/L),血尿素氮:3.6 mmol/L(2.5~7.1 mmol/L),血肌酐:55.2µmol/L(53~135 µmol/L),白蛋白:31.1g/L(35~53 g/L),尿渗透压:220 mOsm/KgH2O(600~1000 mOsm/KgH2O),血渗透压:241.8 mOsm/KgH2O,促肾上腺皮质激素5.48 pg/mL(7.2~63.3 pg/ mL),皮质醇62.00µg/dL(上午8.7~22.4,下午<10µg/dL)[注:促肾上腺皮质激素及血皮质醇结果是使用激素后结果],24 h尿钠62.6 mmol/24 h,甲状腺功能:三碘甲状腺原氨酸1.01 nmol/L(1.34~2.73 nmol/L),游离三碘甲腺原氨酸3.10 pmol/L(3.8~6.0 pmol/L),rT3 70.25 ng/dL(20~64 ng/ dL),头颅MRI:双侧脑室旁多发腔隙性脑梗死,老年性脑改变,甲状腺相关抗体、肝功能、肿瘤四项、心脏彩超及腹部B超均正常。
根据病史及辅助检查诊断为低钠低氯血症,低钾血症,右侧肺炎,腔隙性脑梗死,高血压病3级(极高危)。
治疗经过:入院后予抗感染、改善脑供血、“氢化可的松100 mg+生理盐水100 mL,每天1次”静滴补钠及预防脱髓鞘病变、补钾,并根据患者入院时血钠情况计算补钠量,予静脉补钠治疗。第一个24 h血钠平均以0.4 mmol/L/h上升,稳定至120 mmol/L时,患者症状好转,入院第2天改予6 g/d口服补钠治疗。第3天复查血钠125.9 mmol/L,氢化可的松开始逐步减量,患者症状逐日好转。第6天再次复查血钠达135.4 mmol/L,血钾仍偏低,口服补钠减量至3 g/ d,继续补钾治疗。第8天复查血钠135.0 mmol/L、血钾3.91 mmol/L、血氯101 mmol/L均正常予停止补钠、补钾治疗。但当日患者便出现反应迟钝,表情淡漠,不愿言语,问之能应答,二便正常,肢体活动无障碍。第9天上述症状进一步加重,出现进食呛咳、双下肢肌力4-级,步行距离下降,病理征阴性,急查电解质:血钠136 mmol/L正常,血钾3.37 mmol/L偏低,予补钾,同时神经内科会诊后复查头颅MRI并予“地塞米松10 mg+生理盐水100mL,ST”静滴。第12天头颅MRI示:双侧额顶、基底节区腔隙性脑梗死,脑桥基底部对称性信号异常,T1信号偏低,T2及水抑制信号稍高,老年性脑改变再次请神经内科会诊,考虑CPM,予“甲强龙200 mg+生理盐水100 mL,每天1次”静脉滴注治疗7 d后逐步减量,并加强营养神经治疗。入院第25天患者仍不能言语,但病情稳定,予停用激素,后家属要求至康复医院进一步治疗,予以出院。出院1周后随访,患者仍存在构音障碍,因进食呛咳予置胃管鼻饲,双下肢肌力4-级,搀扶下能行走,病理征阴性,查电解质:血钠137.2 mmol/L、血钾3.33 mmol/L,予补钾治疗;出院1个月后随访复查电解质:血钠136.3 mmol/L、血钾3.77 mmol/L,患者仍不能言语,双下肢肌力4级,较前稍好转,嘱继续康复治疗。
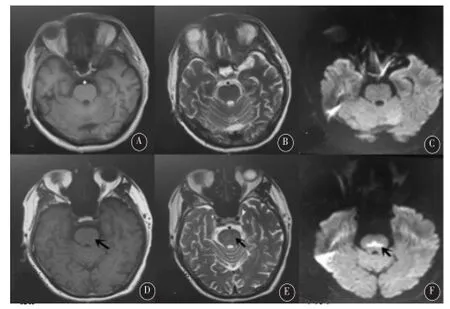
图1入院时头颅MRI T1(A)、T2(B)、DWI(C)均未见脑桥基地部异常信号影 复查头颅MRI T1(D)示脑桥基底部对称性信号偏低,T2(E)、DWI(F)示脑桥基底部对称性稍高信号。
2 讨论
1959年ADAMS等[1]首先提出CPM的概念,随着研究的进一步深入于1962年发现脱髓鞘病变也可累及脑桥外组织,如基底节、丘脑等部位,称之为EPM,约占ODS的10%[2]。目前研究发现[3]引起ODS比较肯定的病因是慢性酒精中毒、营养不良(39%),其次为低钠血症纠正过快(21.5%)。研究发现CPM有17%发生于肝移植术后,尤其是在术后30天内,其他与之相关的原因还有脑外伤、垂体瘤、产后出血导致的垂体机能不全、高渗状态、肝功能受损、肾衰竭透析及妊娠剧吐等。ODS的病理特征为对称性非炎性的少突胶质细胞凋亡及髓鞘缺失,而神经元细胞和轴突相对完整,同时有大量巨噬细胞的浸润[4]。
ODS的发病机制尚未明确,一般认为与颅内渗透压失衡导致血脑屏障破坏、脑脱水、髓鞘内水肿及少突胶质细胞减少等有关[5]。由于ODS的临床表现与影像学不同步,易误诊、漏诊,故目前在临床诊疗中更重视各种原因导致的长期低钠血症及其纠正速度对脑组织的影响。利尿剂是导致低钠血症的重要原因之一。NORENBERG[6]指出在急性低钠血症时细胞水肿,钠、钾、氯等无机离子从脑细胞内转移到细胞外间隙减轻水肿,当渗透压恢复时,这些无机离子便迅速再转移至细胞内。而在慢性低钠血症时,不仅有无机离子的缺失,同时丙氨酸、谷氨酸、牛磺酸、甘氨酸及肌醇等有机渗透物也发生了改变,在快速纠正低钠时细胞内电解质很快恢复正常,但丢失的有机渗透物却无法很快纠正(一般需5~7 d),导致细胞受损和髓鞘脱失。与此同时,血管内皮细胞发生渗透性损伤,导致血管性水肿,髓鞘脂毒因子释放,进一步加重神经髓鞘的缺失。
发生ODS时可有行为异常,认知、情感障碍,出现紧张、兴奋、妄想、缄默等临床表现,可与CPM相似首先累及皮质延髓束表现为构音障碍及吞咽困难,进一步波及皮质脊髓束及基底部出现四肢迟缓性瘫和痉挛性瘫,也可表现为眼震及凝视障碍,可呈缄默、完全或不完全闭锁综合征,也能与EPM一样表现为锥体外系症状,出现共济失调,运动及肌张力障碍等。ODS的诊断最初只能通过尸检结果,目前随着影像学的发展,头颅MRI的应用,使得临床医师能够观察到ODS的进展演变。ODS早期MRI可无异常,发病后1周左右DWI显示病变部位高信号,故DWI对早期脱髓鞘病变更敏感[7]。该患者存在严重低钠血症,在补液纠正低钠过程中出现反应迟钝,缄默,逐渐发展为吞咽困难、言语及运动障碍,符合ODS的表现,且复查头颅MRI提示脑桥基底部对称性病灶,T1呈低密度影,T2、DWI呈高密度,也符合ODS影像学表现。
本例患者因严重低钠血症入院,入院时虽然存在肺部感染,但无感染性休克的表现,肿瘤相关检查也排除肿瘤源性抗利尿激素分泌异常综合征。头颅CT及MRI提示腔梗,排除脑部病变;患者在整个病程中也没有出现剧烈呕吐、大汗等症状,未进行大量补液治疗,排除急性失钠及稀释性低钠血症的可能。患者有长期联合使用缬沙坦和吲达帕胺降压史。吲达帕胺是噻嗪类磺胺利尿剂,生物半衰期长,它主要通过抑制肾远曲小管对钠的重吸收作用导致低钠,进一步引起钠钙交换减少,钾钙交换增多导致低钾。而当噻嗪类或袢利尿剂联合保钾利尿剂时可能由于后者抑制肾远曲小管和集合管Na+-K+交换,使Na+重吸收减少,进一步增加了低钠血症发生的风险[8],本患者联合使用缬沙坦和吲达帕胺,而缬沙坦可能通过抑制醛固酮的分泌,影响肾远曲小管和集合管Na+-K+交换,起到类似保钾利尿剂作用,故更易发生低钠血症。患者入院查24 h尿钠>20 mmol/L,提示存在肾性失钠,且入院前常感乏力不适,考虑可能存在长期慢性低钠血症,综合上述分析考虑本例患者的严重低钠低钾血症与药物相关的可能性大,单纯停用吲达帕胺不能使血钠恢复正常。王文悦等[9]对几个大型数据库中关于利尿剂引起低钠血症的文章进行统计分析发现,在药理学推荐范围内服用利尿剂时有6.5%的低钠血症可因吲达帕胺引起。还有文献报告[10]长期服用吲达帕胺有引起严重低钠血症的风险,且在其纠正过程中会出现ODS。该例患者在纠正电解质紊乱的过程中病情先趋于稳定,但在血钠正常后却出现了神经症状,语言障碍等表现,复查头颅MRI示脑桥基底部对称性信号异常,T1W1信号偏低,T2W2及水抑制信号稍高,诊断ODS明确。
ODS目前尚无有效的治疗方法,主要通过激素稳定血脑屏障,减轻水肿及少突胶质细胞的凋亡,减少巨噬细胞的浸润[10]。ODS患者的预后也不尽相同,多数患者在数周内死亡,少数存活患者遗留不同程度的不可逆性神经损害。故在临床诊疗过程中应重视ODS的预防,尤其是慢性低钠血症的患者在纠正低钠的过程中必须足够谨慎,补钠的速度应缓慢,不得超过0.5 mmol/(L·h),每天不应超过8 mmol/L[11]。本例患者在纠正低钠血症过程中考虑到发生ODS的风险,预防性使用糖皮质激素,但还是不可避免的发生了CPM,这可能与患者联合服用缬沙坦及吲达帕胺降压,血钠丢失更为严重,长期处于严重低钠状态,纠钠速度可能需控制得为严格,另外激素的使用剂量、维持的时间等目前并没有统一的标准,故仍需进一步探究。
综上,ODS较为罕见,由利尿剂导致严重低钠血症在纠正过程中诱发引起ODS的相关报告更是屈指可数。吲达帕胺引起低钾血症已经众所周知,但其导致的低钠血症尚未得到足够的重视,在治疗过程中极易诱发ODS,后者会造成较高的致残、致死率,故在临床实践中应以预防为主。对于究竟如何才能有效的防治ODS需进一步的研究,明确其病因机制,为将来更好的临床诊治提供最佳方案。
[1]ADAMS RD,VICTOR M,MANCALL EL.Central pontine myelinolysis:a hitherto undescribed disease occurring in alcoholic and malnourished patients[J].AMA Arch Neurol Psychiatry,1959,81(2):154-172.
[2]MARTIN RJ.Central pontine and extrapontine myelinolysis:the osmotic demyelination syndromes[J].J Neurol Neurosurg Psychiatry,2004,75(Suppl 3):iii22-iii28.
[3]KLEINSCHMIDT-DEMASTERS BK,ROJIANI AM,FILLEY CM.Central and extrapontine myelinolysis:then...and now[J].J Neuropathol Exp Neurol,2006,65(1):1-11.
[4]CHANG Y,AN DH,XING Y,et al.Central pontine and extrapontine myelinolysis associated with acute hepatic dysfunction [J].Neurol Sci,2012,33(3):673-676.
[5]CUI R,FAYEK S,RAND EB,et al.Central pontine myelinolysis:a case report and clinical-pathological review[J].Pediatr Transplant,2012,16(6):E251-256.
[6]NORENBERG MD.Central pontine myelinolysis:historical and mechanistic considerations[J].Metab Brain Dis,2010,25(1):97-106.
[7]TAKEI Y,AKAHANE C,IKEDA S.Osmotic demyelination syndrome:reversible MRI findings in bilateral cortical lesions[J].Intern Med,2003,42(9):867-870.
[8]BYATT CM,MILLARD PH,LEVIN GE.Diuretics and electrolyte disturbances in 1000 consecutive geriatric admissions[J]. Journal of the Royal Society of Medicine,1990,83(11):704-708.
[9王文悦,杨珊,周波.利尿剂所致低钠血症:临床研究汇总分析[J].中华内分泌代谢杂志,2014,30(2):138-140.
[10]VU T,WONG R,HAMBLIN PS,et al.Patients presenting with severe hypotonic hyponatremia:etiological factors,assessment,and outcomes[J].Hosp Pract,2009,37(1):128-136.
[11]GUTENSTEIN M.Osmotic myelinolysis syndrome after treatment of severe deamino arginine vasopressin-associated hyponatraemia:pitfalls in emergency medicine[J].Emerg Med Australas,2007,19(1):68-70.
(责任编辑:李立)
10.3969/j.issn.1002-0152.2016.02.015
*南京医科大学附属无锡人民医院(无锡 214023)
(E-mail:zhusw1978@163.com)
R741
A
2015-08-03)

