分化型甲状腺癌患者术后TSH抑制治疗对骨密度影响的前瞻性研究
王玉 贺亮 蒋森 张浩 李玉姝* 单忠艳 滕卫平
1.中国医科大学附属第一医院内分泌与代谢病科 沈阳 2.中国医科大学附属第一医院甲状腺综合外科 沈阳 3.中国医科大学附属第一医院核医学科 沈阳
甲状腺癌是内分泌肿瘤中常见的肿瘤,其中分化型甲状腺癌较多见。分化型甲状腺癌术后TSH抑制治疗就是指术后应用甲状腺激素将TSH抑制低于正常低限或低限以下、甚至检测不到的程度,一方面补充DTC(differentiated thyroid carcinoma)患者所缺乏的甲状腺激素,另一方面抑制DTC细胞生长[1]。众所周知,骨的生长发育和重建受到甲状腺激素(thyroid hormone,TH)的影响。适量的甲状腺激素水平对骨形成和骨吸收的过程都非常重要。诸多研究证明甲状腺疾病是引起继发性骨质疏松的重要疾病之一。例如甲状腺机能亢进症、甲状腺功能减退症等,以上疾病干扰了骨代谢的过程,导致骨量减少、骨质疏松、甚至骨折的风险大大增加[2]。TSH抑制治疗导致患者机体内环境发生变化,保持亚临床甲亢的状态,但是这种状态对骨密度及骨代谢的影响存在着争议。
本研究首次在中国北方汉族DTC患者中,探讨了甲状腺全切或次全切术后应用L-T4行TSH抑制治疗对骨密度和骨代谢标志物的影响,为临床合理、个体化地进行甲状腺癌的术后管理提供科学依据。
1 对象和方法
1.1 对象
研究选取2013年11月至2014年8月于中国医科大学第一附属医院甲状腺综合外科行甲状腺切除手术的患者。1)入组标准:(1)分化型甲状腺癌患者,行甲状腺全切或次全切除手术术后;(2)入院期间完善甲状腺功能、甲状腺相关抗体、骨代谢标志物、骨密度等指标;(3)术后口服左旋甲状腺素钠片(L-T4)行促甲状腺素(TSH)抑制治疗,抑制目标TSH<0.5 mU/L;(4)随访半年以上。2)排除标准:(1)随访发现远处转移癌灶,或残留再发的癌灶;(2)甲状腺切除术造成甲状旁腺损伤,血清钙、磷及甲状旁腺激素因手术而降低或升高的患者;(3)TSH抑制治疗过程中,FT3及FT4明显升高,或出现甲状腺机能亢进被迫停药者;(4)应用影响骨代谢的相关药物,例如雌激素、双膦酸盐、糖皮质激素等;(5)放弃治疗的患者;(6)拒绝复查骨密度的患者;(7)随访期间因病或意外死亡的患者。
1.2 方法
纳入研究对象72例,期间发生甲状腺功能亢进者1例,术前未行骨密度检查者10例,放弃治疗者1例,拒绝复查骨密度者30例,最终入组患者30例,男性6例(20%),女性24例(80%)。根据随访时间、性别及月经情况、补钙情况分别分为随访不足1年组(12人,40%)、随访1年组(18人,60%);男性组(6人,20%)、绝经前女性组(16人,53%)、绝经后女性组(8人、27%);补钙组(8人,400-1200mg元素钙,27%)、不补钙组(22人,73%)。
所有试验对象分别于术前及随访结束后测定骨密度(双能X线骨密度仪DEXA,法国MEDI LINK公司)(注:因患者人数较少,年龄跨度大,故选择应用与正常同年龄相比较所得的Z值及BMD进行研究),空腹采血测定β-胶原特殊序列(C-terminal telopeptide of type I collagen, β-CTX,β-Cross Laps)(德国罗氏生化测定仪及配套试剂)和总I型胶原氨基酸延长肽(Procollagen I N-terminal peptide,PINP)(德国罗氏诊断公司人试剂盒及配套试剂)。
1.3 统计学处理

2 结果
2.1 入组患者基线状态分析
将入组患者根据随访时间分为随访1年组(12个月-15个月,12.42±0.996)和随访不足1年组(6个月-11个月,9.28±1.81),随访1年组共12例,年龄(36.17±10.52)岁;随访不足1年组18例,年龄(44.67±11.24)岁。对基线时两组患者的年龄、身高、体重、BMI、TSH、FT4和术前各部位(包括腰椎、股骨颈及整体髋关节)的骨密度(BMD)和Z值进行比较,结果显示随访1年组与随访不足1年组以上指标无明显差异(表1)。
2.2 入组患者TSH抑制治疗前后的比较
比较所有入组患者术前及应用L-T4治疗半年以上时骨密度及骨密度的Z值(包括腰椎、股骨颈及整体髋关节)的变化。发现在总体患者各处骨密度及Z值在治疗前后均无统计学差异。β-胶原特殊序列治疗后较治疗前明显降低,总I型胶原氨基酸延长肽治疗后较治疗前明显升高(P值分别为0.007、0.014)(表2)。
2.3 随访1年组及随访不足1年组骨密度变化的比较
经治疗后末次骨密度的结果与治疗前骨密度的结果的差值表示各部位骨密度变化程度,比较随访1年组和随访不足1年组变化程度的差异,观察TSH抑制治疗时间长短与骨密度变化的关系。腰椎L3段BMD或全部腰椎BMD在随访半年组有所下降但随访1年组却较治疗前有所增加(治疗1年组前后的比较P<0.05)。治疗不足1年组和治疗1年组前述腰椎治疗前后BMD差值具有显著差异(P值分别为0.013、0.004)。腰椎L3段和全部腰椎BMD的Z值变化在两组有同样的趋势(P值分别为0.009、0.001)。整体髋关节BMD在随访不足1年组及随访1年组均降低,但随着随访时间的延长下降的更明显(治疗1年后较术前显著下降P<0.05),随访1年组较随访不足1年组下降的差值显著增加(全髋P值为0.005)(治疗前后绝对值的变化见表2,差值的变化见表3)。两组间整体髋关节BMD的Z值变化具有同样结果平均值以降低为主,而随访不足1年组以升高为主,且较随访1年组变化幅度大(P值分别为0.004和0.000)(表3)。综上所述,随访时间越长腰椎L3段及全部腰椎骨密度反而有所升高,而随访时间越长整体髋关节骨密度降低越明显。
骨吸收指标β-Cross Laps在随访不足1年组及随访1年组均有所降低,但仅随访1年组降低,与术前相比具有显著差异(P=0.013)。代表骨形成的指标PINP在抑制治疗不足1年和1年组均有升高,但与术前比均未达到统计学差异。β-Cross Laps和PINP的差值在随访1年组与随访不足1年组无显著差异(P>0.05,表2)。
2.4 补充钙剂对骨密度的影响
因为随访患者中有应用钙剂补充的病例,故将30例患者分为钙剂补充组(每天400~1 200 mg元素钙,服用半年以上)及非钙剂补充组,其中钙剂补充组8例,钙剂不补充组22例,比较两组腰椎、股骨颈及整体髋关节的BMD及骨密度的Z值的前后差值。两组无统计学差异。钙剂补充组与非钙剂补充组治疗前后BMD及骨密度的Z值的变化程度无明显差异。β-Cross Laps治疗前后的差值, 钙剂补充组较非钙剂补充组明显降低。(表4)
2.5 性别、绝经对骨密度变化的影响
因为患者中存在着性别的差异及月经情况的不同,故将随访1年组与随访不足1年组分为男性组、绝经前女性组及绝经后女性组,应用单因素方差分析对三组进行比较,经比较无统计学差异者无需行两两组间比较。随访1年组的腰椎L3的Z值治疗前后差值三组比较的P值为0.034(P<0.05);随访不足1年组的腰椎L3的BMD及腰椎L3的Z值治疗前后的差值三组比较的P值分别为0.042及0.033(P<0.05)。对以上分别进行男性组、绝经前女性组及绝经后女性组的两两比较,经比较随访1年组腰椎L3的Z值变化男性组与绝经前女性组和绝经后女性组均有统计学意义,男性与绝经前女性比较P值为0.028,男性与绝经后女性比较P值为0.017,女性腰椎L3的 Z值治疗前后的变化程度比男性大,根据变化趋势男性与女性比较明显降低(表4)。随访不足1年组的腰椎L3的BMD治疗前后差值男性组与绝经前女性组差异有统计学意义(0.02±0.03 g/cm2、-0.04±0.04 g/cm2,P<0.05),绝经前女性与男性比较明显降低。随访不足1年组腰椎L3的Z值治疗前后的差值男性组与绝经前女性组差异有统计学意义(0.27±0.32、-0.30±0.35,P<0.05),绝经前女性变化程度较男性大,绝经前女性与男性相比明显降低。(表4)
2.6 影响TSH抑制治疗患者骨密度、骨密度Z值的多因素分析
根据以上结果,为了判断是否因TSH抑制程度及抑制时间长短而影响骨密度的变化,分别对可能影响各个部位的骨密度和骨密度的Z值的因素进行多元逐步回归分析。
首先以全部腰椎BMD治疗前后的变化值为因变量,以年龄、体重、身高、BMI、FT4、TSH、随访时间、β-Cross Laps治疗前后变化值和PINP治疗前后变化值为自变量进行多元逐步回归分析,结果显示TSH及体重是影响全部腰椎BMD治疗前后变化的相关因素,其中与TSH正相关、与体重负相关,所得回归方程为Y=0.016+0.051T-0.001G(T代表TSH,G代表体重)。其次以随访1年组的整体髋关节BMD治疗前后变化值为因变量,以年龄、体重、身高、BMI、FT4、TSH、随访时间、β-Cross Laps治疗前后变化值和PINP治疗前后变化值为自变量进行多元逐步回归分析,结果显示FT4、TSH、BMI与整体髋关节骨密度BMD的改变相关,其中整体髋关节骨密度BMD的改变与FT4及TSH为负相关,与BMI为正相关,所得回归方程为:Y=0.004-0.014F-0.073T+0.004B(F代表FT4,T代表TSH,B代表BMI)。
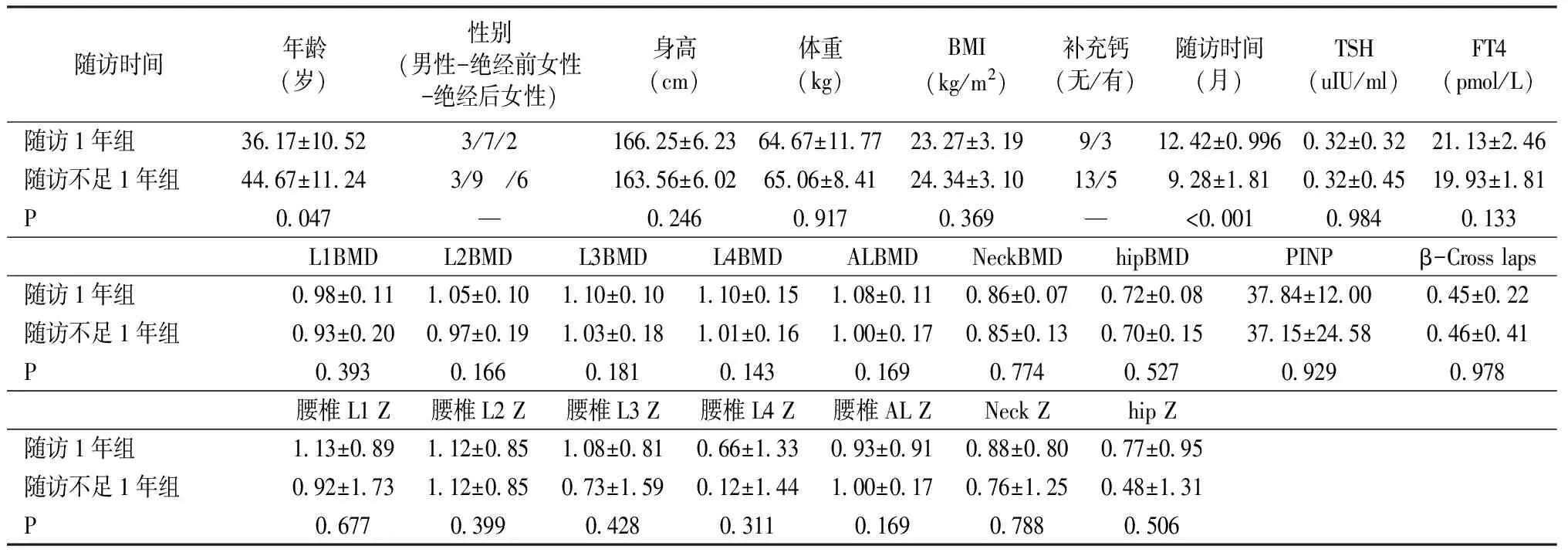
随访时间年龄(岁)性别(男性-绝经前女性-绝经后女性)身高(cm)体重(kg)BMI(kg/m2)补充钙(无/有) 随访时间(月)TSH(uIU/ml)FT4(pmol/L)随访1年组 36.17±10.523/7/2166.25±6.23 64.67±11.7723.27±3.199/312.42±0.996 0.32±0.32 21.13±2.46随访不足1年组 44.67±11.243/9 /6163.56±6.0265.06±8.4124.34±3.10 13/5 9.28±1.81 0.32±0.45 19.93±1.81P0.047 —0.2460.9170.369— <0.0010.9840.133L1BMDL2BMD L3BMDL4BMDALBMDNeckBMDhipBMD PINPβ-Cross laps随访1年组0.98±0.111.05±0.101.10±0.101.10±0.151.08±0.11 0.86±0.07 0.72±0.0837.84±12.000.45±0.22随访不足1年组0.93±0.200.97±0.191.03±0.181.01±0.16 1.00±0.17 0.85±0.13 0.70±0.1537.15±24.580.46±0.41P0.393 0.166 0.1810.1430.1690.7740.5270.929 0.978腰椎L1 Z 腰椎L2 Z腰椎L3 Z腰椎L4 Z腰椎AL ZNeck Zhip Z随访1年组1.13±0.891.12±0.851.08±0.810.66±1.330.93±0.910.88±0.800.77±0.95随访不足1年组0.92±1.73 1.12±0.850.73±1.590.12±1.441.00±0.170.76±1.250.48±1.31P0.6770.3990.4280.3110.1690.788 0.506
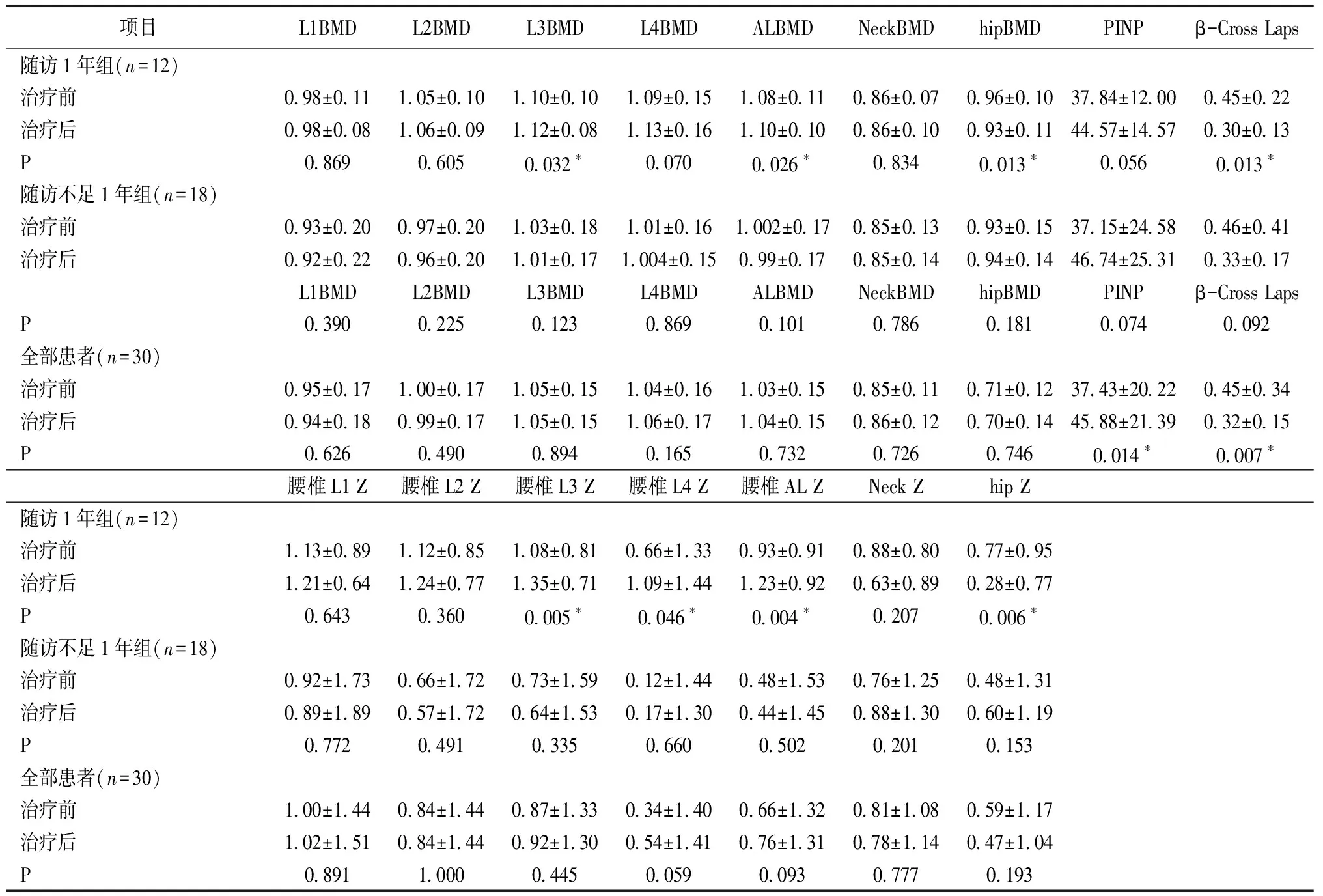
表2 不同随访时间及总体患者TSH抑制治疗前后各部位骨密度(BMD)及Z值的比较Table 2 The comparison of BMD and Z score of various location before and after TSH suppressive therapy for overall patients at different follow-up time
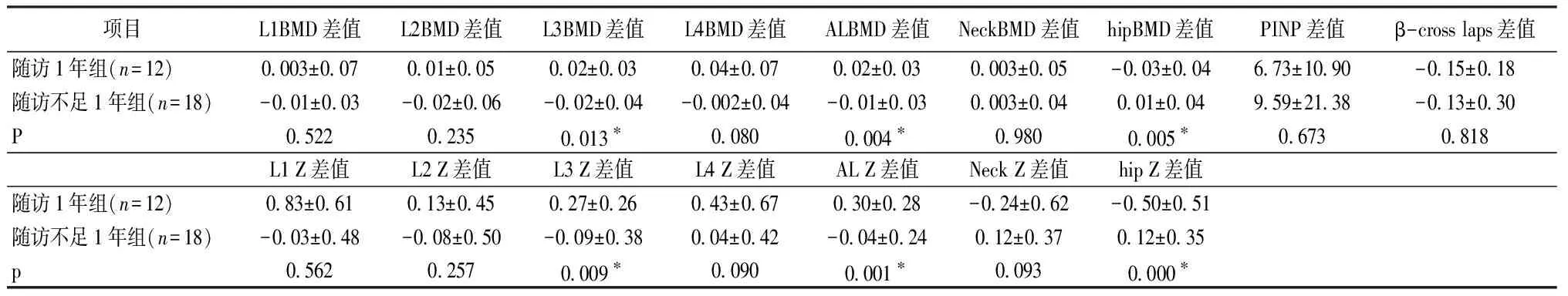
表3 不同随访时间的患者各部位治疗前后BMD、Z值及PINP、β-CrossLaps差值的比较Table 3 The comparison of BMD, Z value, and PINP and β-CrossLaps difference before and after treatment in patients at different follow-up time
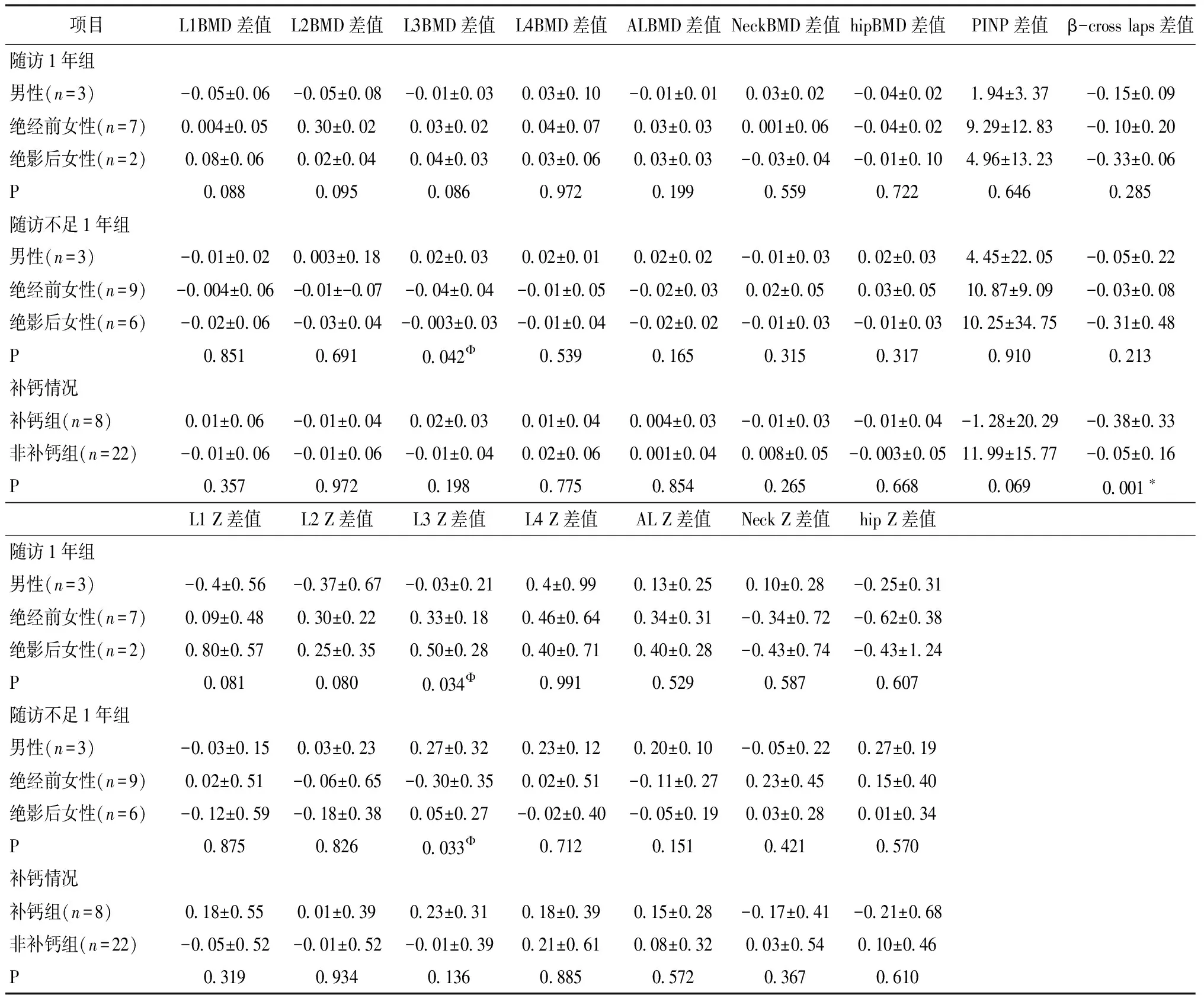
表4 在不同随访时间组中按照性别及月经情况分组全部患者按补钙情况分组各组之间治疗前后BMD、Z值及PINP、β-Cross Laps差值的比较Table 4 The comparison of BMD, Z value, and PINP and β-Cross Laps difference in patients grouped according to sex, menstruation, and calcium supplementation before and after treatment at different follow-up time
备注:“*”表示P<0.05,组间比较或组内比较有统计学差异。“Φ”表示表示P<0.05,多组间比较有统计学意义,需进一步行两两比较。BMD的单位是(g/cm2),PINP的单位是(μg/L),β-Cross Laps单位是(ng/ml)
3 讨论
有研究证明高TSH是恶性肿瘤发生危险因素,TSH抑制治疗对抑制甲状腺癌的复发或转移非常重要。TSH主要通过作用于促甲状腺激素受体(TSHR),形成配体-受体复合物,从而能激活TSHR,TSHR与G蛋白偶联后,激活细胞内cAMP信号通路,刺激癌细胞的生长[3]。在成骨细胞和破骨细胞上也存在TSHR,TSH与TSHR结合,直接影响骨的重建,并且TSH可以独立控制骨吸收和骨形成[4]。TSH可以通过RANK-L的JNK/C-jun和NF-κB信号通路抑制破骨细胞的形成和存活,从而影响破骨细胞的作用,当然TSH也可以通过抑制TNF-α应答抑制破骨细胞的形成,甚至可以通过下调Wnt(LRP-5)H和VEGF(Flk)信号抑制破骨细胞的分化。TSH也可以对成骨细胞产生作用,抑制1型胶原蛋白在Runx-2和转录因子中的表达,从而控制骨吸收及骨形成[4]。综上所述,TSH水平变化可以影响骨密度及骨代谢。
本研究发现TSH抑制治疗对髋关节的骨密度有显著的负面影响,而对腰椎骨密度未见负面作用,相反有轻度升高的趋势。国外学者的多篇报道中也发现导致TSH抑制的亚临床甲亢患者髋部及非椎体骨折风险增加。Dr.Jennifer S.Lee等对美国3567例大于65岁的老年人进行研究,发现每1000例亚临床甲亢男性患者有13.65例男性发生髋关节骨折、每1000例亚临床甲亢女性患者有8.93例女性发生髋关节骨折,提示亚临床甲亢增加了老年人髋关节骨折的风险[5]。Christina D.Wirth, MD等对8篇文献进行荟萃分析和系统性的综述,结果也显示亚临床甲亢可能增加了髋关节及非脊椎性骨折的风险[6-13]。有研究提示皮质骨的破骨细胞较松质骨的破骨细胞更活跃[14],也有文献报道在高甲状腺素状态下股骨颈比腰椎更早出现骨量的丢失[15],这可能由于股骨及髋关节处以皮质骨为主较以松质骨为主的腰椎更容易受甲状腺激素的影响。但在本研究中TSH抑制治疗的患者随着治疗时间的延长腰椎的骨密度有升高的趋势,根据上文所述皮质骨中的破骨细胞较松质骨更活跃,那么以松质骨为主的腰椎中的成骨细胞应较股骨和髋关节处活跃,有文献报道在成骨细胞中加入TSH可以使成骨细胞减少[16],那么当TSH明显降低时成骨细胞会更为活跃,因而我们推测TSH抑制治疗对腰椎成骨细胞的影响要比股骨及髋关节更为明显,由于我们的随访时间较短成骨细胞所介导的骨形成会更为突出,从而使骨密度有升高的趋势。
本研究中发现应用L-T4时间较长的患者发生髋部骨密度下降的风险增加。Mee Kyoung Kim等对初始应用L-T4治疗(早期术后时期)超过12个月的93名DTC患者进行随访。同时他们也对其他长期应用L-T4治疗(晚期术后时期)的33名DTC患者进行随访,分别对以上随访患者进行基础的和1年后的骨密度测定,结果示术后早期组比术后晚期组的骨量丢失的平均值更高即骨量丢失的更多,尤其在腰椎和股骨颈有意义(腰椎P=0.041;股骨颈P=0.010),从而得出结论左旋甲状腺激素TSH抑制治疗增加骨量丢失,主要是发生在甲状腺术后早期治疗期间的绝经后女性[17]。考虑术后晚期组行TSH抑制治疗的DTC患者TSH水平不用抑制的过低,术后早期组TSH抑制在(0.5±0.8)IU/L[17],而术后晚期组TSH则抑制在(1.3±2.1)IU/L[17],所以术后早期组骨量丢 失要比术后晚期组更加明显,也就是治疗时间长组较治疗时间短组未见骨密度明显降低的原因。
PINP被众多研究者接受的代表骨形成的标志物,它是骨基质的重要组成成分,它是I型胶原蛋白形成的产物,通过在成骨细胞中I型原骨胶原的氨基末端和羧基末端的拼接而形成[18]。相反的,β-Cross Laps被认为是骨吸收的标志物,通过破骨细胞产生的氨基末端和羧基末端的片段反映I型胶原蛋白的降解[19]。最近,PINP和β-CTX已经被国际骨质疏松基金会(IOF)及国际临床化学和医学实验联合会(IFCC)公认为骨质疏松症骨形成和骨吸收的衡量标准[20]。
本研究显示经治疗后的患者较治疗前β-胶原特殊序列降低(P<0.01),而且随着治疗延长而逐渐明显;治疗后的PINP较治疗前升高(P<0.05),但是治疗时间的延长未见明显的影响(P>0.05)。Toivonen J等对应用TSH抑制治疗的患者分化型甲状腺患者与正常对照组进行比较,TSH抑制治疗组较正常对照组PINP明显升高(P<0.001,+46%)[21];Gao YC等对50例应用L-T4治疗DTC男性患者停止用药4周与40例甲状腺功能亢进患者进行比较,β-CTX较对照组明显降低(P<0.001,-35.5%)[22]。本研究发现TSH抑制治疗对腰椎与髋关节有不同的影响趋势,而且血清学显示骨吸收标志物明显降低,同时骨形成标志物则明显升高,然而我们未测定其他部位(如桡骨远端等)的骨密度,故推测TSH抑制治疗对全身骨的影响仍倾向于使骨吸收减少并使骨形成增多。
本研究显示补钙的患者的β-Cross Laps较不补钙患者的β-Cross Laps明显降低。Cheng X等研究认为破骨细胞的形成是受钙浓度的增高而抑制的[23]。根据本研究的结果可能由于钙的补充抑制破骨细胞的形成,导致骨吸收降低。
本研究应用多元逐步回归分析显示全部腰椎及整体髋关节的BMD变化与TSH的抑制相关。其中全部腰椎BMD的变化与TSH呈正相关,那么TSH越低全部腰椎BMD的变化越小,也就是可以认为TSH抑制治疗对腰椎的影响小;整体髋关节的BMD变化与TSH呈负相关,那么TSH越低整体髋关节BMD的变化越大,说明TSH抑制治疗对髋关节影响较大。根据以上结果,TSH抑制治疗对髋关节的骨密度影响以降低为主,故可以推测TSH抑制治疗明显降低DTC患者的髋关节的骨密度。
本研究有一定局限性。首先,本研究入组病例数较少,虽然显示TSH抑制治疗时间较长与髋关节的骨密度下降风险相关,但是由于病例数较少,分析误差较大,特别是行性别差异分析及女性月经情况对骨密度及骨代谢的影响时,例数过少,影响检验效能。其次,本研究随访时间较短,不能充分反映对骨密度及骨代谢的影响。我们仍需要增加病例并延长随访时间进一步观察甲状腺素治疗对骨密度及骨代谢的影响。

