小黑杨CYCD3;3基因启动子序列分析及其在拟南芥中的表达1)
刘彩霞 郑唐春 张鑫鑫 葛晓兰 曲冠证
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
小黑杨CYCD3;3基因启动子序列分析及其在拟南芥中的表达1)
刘彩霞郑唐春张鑫鑫葛晓兰曲冠证
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
摘要通过相关网站及生物信息软件对Poptr:CYCD3;3基因启动子序列进行详细分析,从小黑杨(Populus)叶片总DNA中克隆到2 000 bp的目的片段,构建植物表达载体(pCAMBIA1301-Promoter:CYCD3;3),并利用浸花法转化野生型拟南芥(Arabidopsis thaliana);通过抗性筛选和分子检测结果显示,pCAMBIA1301-Promoter:CYCD3;3基因已经整合到拟南芥基因组中。同时对获得的转基因幼苗进行GUS染色并观察,其基因表达模式主要集中在植物分生组织中,由此表明Poptr:CYCD3;3调控CYCD3;3基因在细胞分裂中发挥作用。
关键词Poptr:CYCD3;3基因启动子;拟南芥;遗传转化;GUS检测
细胞周期有序的进行离不开细胞周期蛋白(Cyclin)。周期蛋白是指在细胞周期的不同阶段周期性出现或消失,其浓度变化在细胞周期中是浮动的,呈周期性。其作为一种调节亚基,经活化后,通过对下游调控因子的可逆磷酸化和去磷酸化作用来调控细胞分裂周期的有序进行[1-2]。Renaudinetal[3]将目前已经分离鉴定出的植物周期蛋白分成3大类即A、B、D。这3类周期蛋白在细胞周期不同阶段发挥作用,其中CYCD在G1到S期过渡中起重要作用[4],控制着细胞周期的进程。目前,许多科学家都致力于D型周期蛋白的研究:Cokcrofletal[5]用D类周期蛋白转化烟草,发现D类周期蛋白过表达会使烟草生长加快;Witteetal[6]将CYCD转入拟南芥中,发现其过量表达导致拟南芥细胞分化受抑制,导致拟南芥生长发育受到严重影响;Riouzetal[7]将CYCD3与35S启动子相连转化拟南芥中,发现无外援分裂素条件下,转基因株系仍能够维持细胞正常分裂。研究表明:CYCD作为G1期重要的调控因子,对细胞的分裂、大小、数量等方面起到了重要作用。D类周期蛋白的表达同时受细胞内信号调控和外界环境刺激,其中拟南芥周期蛋白CYCD3可受细胞分裂素的诱导表达,与此同时,CYCD3的过表达能够替代拟南芥中诱导产生愈伤的分裂素[8]。
启动子是调控基因表达的重要部分,克隆基因启动子序列是了解基因转录表达模式及其调控机制的关键。目前对杨树中的CYCD3;3基因启动子的克隆和分析报道较少。本文从小黑杨中克隆Poptr:CYCD3;3启动子基因序列,构建植物表达载体,并在拟南芥中表达,经GUS染色观察表明,该启动子作用于细胞分生旺盛的区域,同时表明Poptr:CYCD3;3调控CYCD3;3基因在细胞分裂中发挥重要作用。
1材料与方法
野生拟南芥(Arabidopsis thalianaCol-0)和小黑杨(Populus xiaohei)均为本实验室保存;DH5α感受态菌株购自天根生化科技有限公司(北京);EHA105根瘤农杆菌为本实验室保存;pMD18-T载体购自TaKaRa公司(中国大连);质粒提取、胶回收试剂盒购自OMEGA公司(美国);PCR相关试剂、DNAmarker、限制性内切酶、T4DNAligase购自TaKaRa公司(中国大连);pCAMBIA1301质粒为本实验室保存;其它实验试剂为进口或国产分析纯。
1.1Poptr:CYCD3;3基因表达载体构建及转化
Poptr:CYCD3;3基因的克隆:根据已公布的杨树基因组信息,并对杨树CYCD3;3基因位点上游的2 000bp序列进行分析,且根据分析结果设计特异性引物,上游引物命名为PD3;3-F,下游引物命名为PD3;3-R,引物序列见表1。利用CTAB法提取小黑杨叶片总基因组DNA,并根据表1中的引物进行目的基因的扩增,反应程序:94 ℃预变性4min;94 ℃变性30s;55 ℃退火30s;72 ℃延伸2min共35个循环,72 ℃再延伸7min,PCR结束后全部产物进行1%琼脂糖凝胶电泳分析。利用凝胶回收试剂盒回收目的片段,将回收后的片段根据操作手册方法连入pMD18-T载体中,转化大肠杆菌Trans1-T1感受态,对获得的单克隆进行菌落PCR验证,筛选后的阳性克隆命名为T-P-CYCD3;3,送至哈尔滨博士生物技术有限公司测序。
表1构建植物表达载体(pCAMBIA1301-Promoter:CYCD3;3)所用引物序列

引物名称引物序列PD3;3-FATCAAGCTTCATGGGTTTATCACAGTCPD3;3-RATCCCATGGCTTCCTCCAAGAAGAAGA
植物表达载体pCAMBIA1301-Promoter:D3;3的构建:通过表1引物扩增的目的片段,利用HindIII、NcoI这两种限制性内切酶分别对p1301和T-P-CYCD3;3质粒进行双酶切,并分别回收目的片段,利用T4DNAligase过夜连接转化大肠杆菌Trans1-T1感受态,对获得的单克隆进行菌落PCR验证,筛选后的阳性克隆命名为pCAMBIA1301-Promoter:CYCD3;3,送至哈尔滨博士生物技术有限公司测序。选取测序正确的质粒转化农杆菌EHA105α,提取农杆菌质粒根据表1中的引物进行PCR检测。
转基因植株获得及分子检测:通过花序浸染法进行拟南芥的遗传转化,转化过程如下:培养拟南芥野生型至1个月大小时,去除初级花序,使幼苗长出较多的二级花序分支,待长出大量的花蕾且少量开花时准备转化;农杆菌OD值1.5~2.0,浸染2~3min;共培养2d;光下培养。待转化苗的种荚变黄后,回收种子。
对获得的种子进行抗性筛选,并对获得的抗性植株进行总DNA提取,利用表1中的引物进行PCR并用1%琼脂糖凝胶检测,分析是否成功获得转基因株系。
转基因拟南芥的组织特异性观察:对转基因拟南芥进行GUS染色观察,具体步骤如下:取一周大小的转基因拟南芥幼苗放于GUS染液中,避光条件下,抽真空10min;将处理好的材料于水浴锅中37 ℃过夜温浴;将染色的材料放于固定液中4h,期间及时更换固定液;将脱色的材料放入培养皿中,滴入适量25%甘油;通过实体显微镜观察GUS染色情况,并进行朴钊分析该启动子的组织表达特异性。
2结果与分析
2.1启动子序列分析及Poptr:CYCD3;3基因的克隆
根据公布的杨树基因组信息获得杨树CYCD3;3上游的2 000bp序列,并设计引物,以小黑杨叶片总DNA为模板,进行PCR扩增,1%琼脂糖凝胶电泳检测表明,条带清晰且和预期大小一致(图1)。将目的条带切胶回收后与pMD18-T载体连接,转化大肠杆菌,并进行菌落PCR验证,对获得的阳性克隆命名为T-P-CYCD3;3。将阳性克隆送至哈尔滨博士生物技术有限公司测序。对获得的小黑杨CYCD3;3上游2000bp的序列通过生物信息学软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行功能原件分析(图2)。分析结果显示,该启动子共含有11个元件,分别包括如下:TATA-box;CAAT-box;5’UTRPy-richstretch;ATI-motif、Box4、ATCT-motif、GTI-motif、I-box、SpI、TCT-motif为参与光应答的顺式作用元件;GARE-motif、P-box赤霉素应答元件;GCN4-motif、Skn-I-motif胚乳表达顺式元件;MBS干旱胁迫MYBJ结合位点;MSA-like细胞周期调控顺式元件;OZ-site玉米素代谢调控中的顺式作用元件;TCA-element水杨酸应答元件;circadian生理调控顺式作用元件。

M.DNAmarkerDL5000;1、2.Poptr:CYCD3;3基因启动子的PCR产物。
图1Poptr:CYCD3;3基因启动子的PCR扩增
2.2植物表达载体的构建及验证
植物表达载体pCAMBIA1301含有CaMV35S::GUS融合系统(图3),本实验中将克隆得到的小黑杨CYCD3;3基因启动子取代植物表达载体pCAMBIA1301上的CaMV35S,构建表达载体pCAMBIA1301-CYCD3;3Promoter::GUS。利用HindIII、NcoI这两种限制性内切酶分别对pCAMBIA1301和T-P-CYCD3;3质粒进行双酶切(图4-A),并分别回收目的片段,利用T4DNAligase过夜连接并转化大肠杆菌Trans1-T1感受态,对获得的单克隆进行菌落PCR验证,获得2000bp左右的目的条带(图4-B),同时提取质粒,并进行酶切检测(图4-C),电泳检测结果显示切出2000bp左右的目的条带,此外将质粒送至哈尔滨博士生物技术有限公司测序,测序结果显示连接正确,且无突变发生。

图2 Poptr:CYCD3;3基因启动子的核苷酸序列
提取质粒转化农杆菌EHA105,挑取单克隆进行PCR检测,结果显示所选单菌落均为阳性克隆,该结果表明植物表达载体构建成功。
2.3转基因拟南芥的种子筛选及分子检测
将收获的转基因拟南芥种子经过若干次抗性筛选,共获得8株抗潮霉素幼苗(图5)。待幼苗长大后提取DNA,以表1中引物进行PCR检测(图6),结果显示获得的抗性苗均含目的基因,说明外源基因已整合到拟南芥基因组上。
2.4转基因拟南芥GUS活性检测
将萌发一周左右的转基因植株,经GUS染色,固定处理后,显微镜下观察GUS活性,结果如图7所示。在叶脉和胚轴中GUS活性较强。以上结果表明,Poptr:CYCD3;3基因的表达模式为,在植物分生组织中表达较强。
3结果与讨论
启动子是一段提供RNA聚合酶识别和其转录因子特异性结合,且决定基因起始转录的DNA序列,它位于基因上游[9]。高等植物启动子通常包含TATA框、CAAT框和GC框,同时该区域还存在各种控制元件[10],如:脱落酸响应元件、乙烯响应元件、低温响应元件、赤霉素应答元件、胚乳表达顺式元件、细胞周期调控顺式元件、玉米素代谢调控中的顺式作用元件等[11-13],通过与RNA聚合酶识别、结合,诱导转录过程在植物基因表达调控过程中起着重要作用[14-16]。由于启动子在调控方面起到关键性作用,决定基因表达的时空特异性,为分析基因调控提供了重要信息[17]。由此可以通过研究启动子的特性,用于分析其下游的基因表达特异性,有助于了解植物生长发育的过程及对外界环境的适应情况,从而能够更好的控制外源基因高效、稳定、长期的在目的部位表达情况[18-19]。
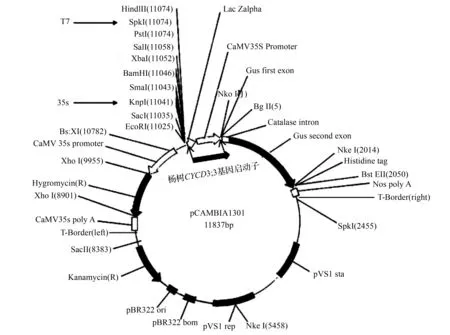
图3 植物表达载体pCAMBIA1301-Promoter:CYCD3;3的构建图谱
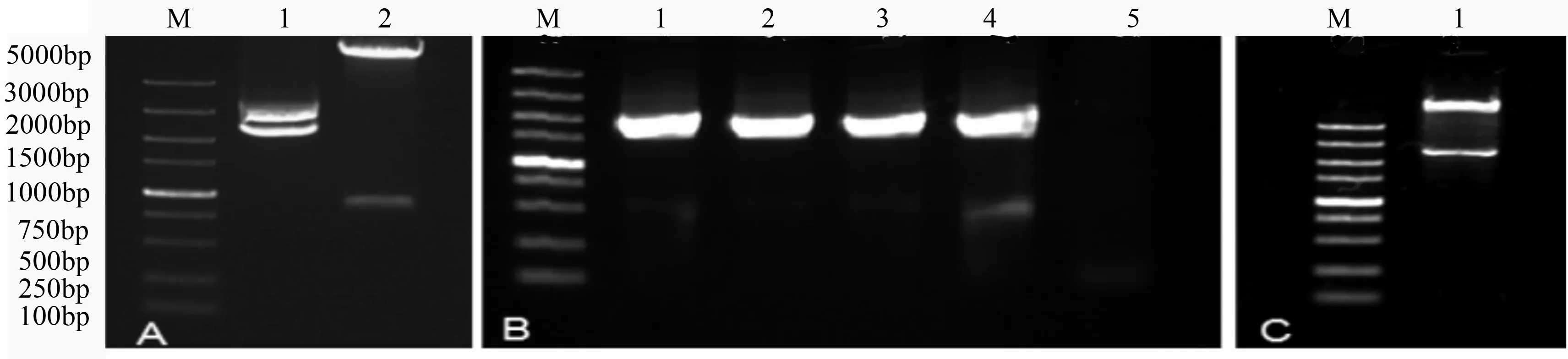
M为DNAmarkerDL5000;A.1~2分别为T-P-CYCD3;3质粒及pCAMBIA1301质粒双酶切;B.1~4分别为pCAMBIA1301-Promoter:CYCD3;3重组子检测;5为阴性对照;C.1为重组子p1301-P-CYCD3;3的酶切检测。
图4植物表达载体pCAMBIA1301-Promoter:CYCD3;3的构建及验证
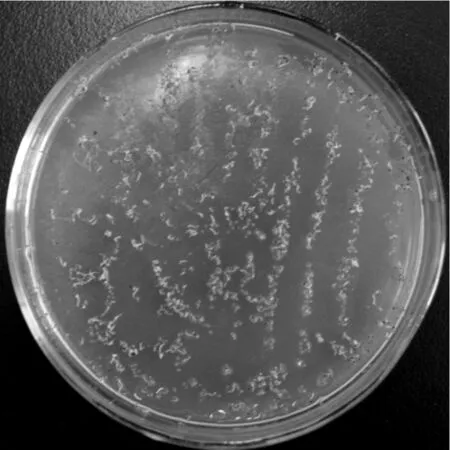
图5 转基因拟南芥获得
高等植物启动子根据不同的转录模式可分为组成型启动子、组织或器官特异性启动子及诱导型启动子这3类[20],组成型启动子所调控的基因表达是不受外界环境条件的影响, 几乎在所有植物不同组织中都能表达。如烟草花叶病毒(cauliflowermosaicvirus,CaMV)35S启动子,被广泛应用于双子叶植物转基因工程[21]。组织特异型启动子是在其调控下,目的基因只在特定器官或组织中表达[22]。该类启动子一般存在一些与组织特异性相关的特异基因序列中。诱导型启动子是由于信号刺激而具有转录活性的启动子。而后两者一直是基因工程中的难点与重点。
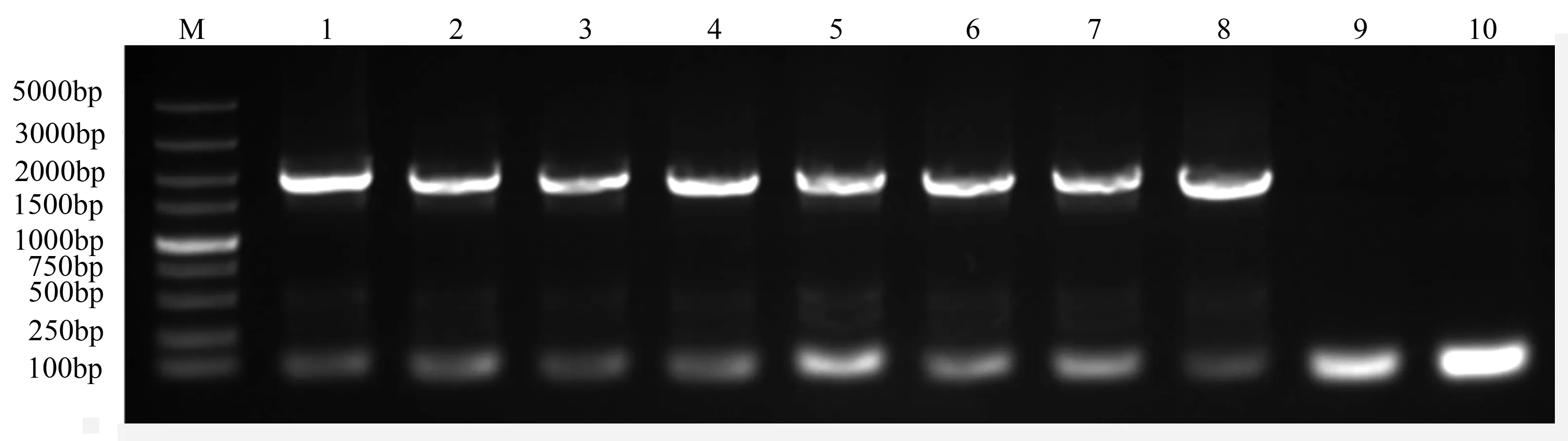
M.DNA marker DL 5000;1~7.转基因植株;8.阳性对照;9.野生型;10.阴性水对照。

图7 转基因拟南芥GUS染色
本试验为探究杨树CYCD3;3基因启动子的特性,选取Poptr:CYCD3;3上游2 000bp的启动子序列,从小黑杨基因组DNA中克隆出Poptr:CYCD3;3,由于启动子序列较长,结构较复杂,AT含量较高,易形成较复杂的内部结构,因此启动子的克隆比较困难,PCR扩增的量一般较低,对PCR产物进行多次浓缩,获得较高质量的PCR产物,并构建pCAMBIA1301-promoter:CYCD3;3植物表达载体,转化拟南芥,并对其进行GUS染色,通过启动子驱动GUS染色的图片分析说明:Poptr:CYCD3;3基因的表达在胚轴和叶脉处最强,其基因表达集中在植物分生组织中,本试验结果显示,调控CYCD3;3基因的启动子在分生组织中表达量较高,证明了该基因在细胞分裂中行使功能,同时也表明该启动子存在时空的特异性表达特征。在林木中CYCD3;3基因启动子是如何准确调控CYCD3;3基因在G1-S期行使功能的有待进一步深入研究,以期待在林木中对CYCD3;3的功能做出机理性的阐述。
参考文献
[1]DOONANJ,FOBERTP.Conservedandnovelregulatorsoftheplantcellcycle[J].CurrOpinCellBoil,1997,9(6):824-830.
[2]TESSEMAM,LEHMANNU,KREIPEH.Cellcycleandnoend[J].VirchowsArch,2004,444(4):313-323.
[3]RENAUDINJP,DOONANJH,FREEMAND,etal.Plantcyclins:aunifiednomenclatureforplantA-,B-andD-typecyclinsbasedonsequenceorganization[J].PlantMolBiol,1996,32(6):1003-1018.
[4]VEYLDERL,ALMEIDAEJ,BURSSENSS,etal.AnewD-typecyclinofArabidopsis thalianaexpressedduringlateralrootprimordiaformation[J].Planta,1999,208(4):453-462.
[5]COKCROFLC,DENBOERB,HEALYJ,etal.CyclinDcontrolofgrowthrateinplants[J].Nature,2000,405:575-579.
[6]WITTEW,RIOUKHAMLICHIC,SCOFIELDS,etal.Alteredcellcycledistribution,hyperplasia,andinhibiteddifferertiationinArabidopsiscausedbytheD-typecyclinCYCD3[J].Plantcell,2003,15(1):79-92.
[7]RIOUKHAMLICHIC,HUNTLEYR,JACQMARDA,etal.CytokininactivationofArabibopsiscelldivisionthroughaD-typecyclin[J].Science,1999,283:1541-1544.
[8]BISBISB,DELMASF,JOUBESJ,etal.Cyclin-dependentKinase(CDK)inhibitorsRegulatetheCDK-CyclincomplexactivtiesinendoreduplicatingcellsofdevelopingTomatofruit[J].JBiolChem,2006,17;281(11):7374-7383.
[9]JOSHICP.AninspectionofthedomainbetweenputativeTATAboxandtranslationstartsitein79plantgenes[J].NucleicAcidsRes,1987,15(16):6643-6653.
[10]王颖,麦维军,梁承邺,等.高等植物启动子的研究进展[J].西北植物学报,2003,23(11):2040-2046.
[11]LIUS,KRIZA.DUNCAND,etal.Abscisicacid-regulatedGlb1transientexpressioninculturedmaizeP3377cells[J].PlantCellReports,1998,17(8):650-655.
[12]HONGJK,LEESC,HWANGBK.ActivationofpepperbasicPR-1genepromoterduringdefensesignalingtopathogen,abioticandenvironmentalstresses[J].Gene,2005,356(9):169-180.
[13]YAMAGUCK,SHINOZAKIK.Organizationofcis-actingregulatoryelementsinosmotic-andcold-stress-responsivepromoters[J].TrendsPlantSci,2005,10(2):88-94.
[14]聂丽娜,夏兰琴,徐兆师,等.植物基因启动子的克隆及其功能研究进展[J].植物遗传资源学报,2008,9(3):385-391.
[15]李一琨,王金发.高等植物启动子研究进展[J].植物学通报,1998,15(增刊):1-6.
[16]路静,赵华燕,何奕昆,等.高等植物启动子及其应用研究进展[J].自然科学进展,2004,14(8):856-862.
[17]YABUYAT,YAMAGUCM,IMAYAMAT,etal.Anthocyanin5-O-glucosyltransferaseinflowersofIrisensata[J].PlantSci,2002,162(5):779-784.
[18]李一瑕,王金发.高等植物启动子研究进展[J].植物学通报,1998,15(增刊):1-6.
[19]HOLTORFS,APELK,BOHLMH.ComparisonofdifferentconstitutiveandinduciblepromotersforthetransgenesinArabidopsis thaliana[J].PlantMolBiol,1995,29(4):637-646.
[20]POTENZACL,ALEMANC,SENGUPTAG.Targetingtransgeneexpressioninresearch,agricultural,andenvironmentalapplications:Promotersusedinplanttransformation[J].InVitroCellularDevelopmentalBiology-PlantJanuary,2004,40(1):1-22.
[21]BEYFEYPN,CHUANH.TheCauliflowermosaicvirus35Spromoter:combinatorialregulationoftranscriptioninplant[J].Science,1990,250:959-966.
[22]贺红霞,陈亮,林春晶,等.组织特异性启动子在作物基因工程中的研究进展[J].中国农学通报,2014,30(9):225-231.
第一作者简介:刘彩霞,女,1990年10月生,林木遗传育种国家重点实验室(东北林业大学),硕士研究生。E-mail:1198260339@qq.com。 通信作者:曲冠证,林木遗传育种国家重点实验室(东北林业大学),教授。 E-mail:quguanzheng@yahoo.com。
收稿日期:2015年12月15日。
分类号Q943
Populus CYCD3;3GenePromoterSequenceAnalysisandExpressionAnalysisinArabidopsis//
LiuCaixia,ZhengTangchun,ZhangXinxin,GeXiaolan,QuGuanzheng
(StateKeyLaboratoryofTreeGeneticsandBreeding,NortheastForestryUniversity,Harbin150040,P.R.China)//JournalofNortheastForestryUniversity,2016,44(8):29-33.
ThroughtherelevantwebsiteandthebioinformaticssoftwareofPoptr:CYCD3;3promotersequencesareanalyzedindetail,wecloned2 000bpfragmentfromPopulusDNA,andconstructedtheplantexpressionvector(pCAMBIA1301-Promoter:CYCD3;3)andfloraldiptransformationmethodusingwild-typeArabidopsis thaliana.Fromtheresistancescreeningandmoleculardetectionresults,PCAMBIA1301-Promoter:CYCD3;3genewasintegratedintothegenomeofArabidopsis thaliana.BythetransgenicseedlingsGusstainingobservation,thegeneexpressionpatternsweremainlyconcentratedintheplantmeristemofexpression.Therefore,thePoptr:CYCD3;3regulatoryCYCD3;3geneincelldivisionwouldplayanimportantrole.
KeywordsPoptr:CYCD3;3; Arabidopsis; Genetic transformation; GUS detection
1)教育部新世纪优秀人才支持计划项目(NCET-12-0808);国家自然科学基金项目(31370661)。
责任编辑:潘华。

