茶梢信息物引诱叶蝉三棒缨小蜂效应的检测
潘 铖,林金丽,2,韩宝瑜,*
1 中国计量学院浙江省生物计量及检验检疫技术重点实验室, 杭州 310018 2 江苏省盐城市大丰农场, 盐城 224100
茶梢信息物引诱叶蝉三棒缨小蜂效应的检测
潘铖1,林金丽1,2,韩宝瑜1,*
1 中国计量学院浙江省生物计量及检验检疫技术重点实验室, 杭州310018 2 江苏省盐城市大丰农场, 盐城224100
摘要:为确定引诱假眼小绿叶蝉卵寄生蜂叶蝉三棒缨小蜂的茶梢信息物并检测其活性,遂于室内用Y管嗅觉仪进行行为测定,结果表明:①假眼小绿叶蝉口针刺吸和产卵管刺伤茶梢嫩茎、口针刺吸的茶树芽叶、以及口针刺吸芽叶近邻的健康茶叶的气味皆强烈引诱该蜂;②以健康茶梢、叶蝉为害茶梢挥发物中27种主要成分的3个剂量即10-6、10-4g/mL和10-2g/mL正己烷溶液为味源,进行嗅觉反应测定,发现顺-茉莉酮、芳樟醇、橙花醇、正戊醇、正己醇、1-戊烯- 3-醇、α-松油烯、α-松油醇和蒈烯的1或2个剂量显著引诱该蜂。茶园中:①10-4g/mL 顺-茉莉酮、10-4g/mL 芳樟醇和10-4g/mL 1-戊烯- 3-醇三组分的等量混合物显著诱集叶蝉三棒缨小蜂;10-2g/mL橙花醇、10-2g/mL正戊醇、10-2g/mL α-松油烯、10-6g/mL正己醇、10-6g/mL α-松油醇和10-6g/mL蒈烯六组分等量混合物的诱效更强;②加入液体石蜡作为缓释剂,可将该6组分诱集剂的半衰期延长0.7d;③6:00—10:00缨小蜂比较活跃,这一时段诱捕的缨小蜂数占总诱捕数�50%。认为:假眼小绿叶蝉为害的茶梢上受害和未受害芽叶含有的顺-茉莉酮等部分挥发性化合物强烈地引诱叶蝉三棒缨小蜂,当它们按恰当比例组成诱集剂之后,则诱效显著增强,再与素馨黄色彩组合,诱效更强。
关键词:茶梢挥发性化合物;叶蝉三棒缨小蜂;顺-茉莉酮;寄生蜂诱集剂
近20多年来的植物-植食性昆虫-寄生蜂三营养级间化学通讯机制的深入研究揭示了植物挥发性信息物质调节害虫行为的效能和机理[1],遭受取食或被产了卵的植物释放的一些特定信息物质在寄生蜂定位害虫时起着至关重要的作用[2-7]。寄生蜂能够辨识特定种类害虫为害特定寄主植物之后产生的特定信息物质[8- 9],借助于这类信息物质雌寄生蜂可以实现栖息地、寄主昆虫的快速定位[2,9]。虫害植物吸引寄生蜂而间接抵御害虫的过程中所释放的这类特定信息物质通常被称为互利素[3,5]。从生物化学角度来看,这类信息物质是受害植物产生的新挥发物、或是受害植物增大了释放量的挥发物;同时,各种信息物质含量比例的改变也会吸引寄生蜂。因此,将植物的多种挥发性化合物按恰当比例配制的混合物也可吸引寄生蜂[10- 11]。在茶园化学生态学研究中,成功地组合茶梢挥发物而有效招引和调控天敌昆虫的报道[12]甚少,未见挥发物调控假眼小绿叶蝉Empoascavitis(Göthe) 卵寄生蜂-叶蝉三棒缨小蜂StethyniumempoascaeSubba Rao的报道。
假眼小绿叶蝉遍布于全国茶区以及越南北部和缅甸北部的茶区,是我国大陆茶区最严重害虫[13],常年致茶叶减产15%—20%,每年需要防治10多次,少数茶区年防治20次左右。近年来发现叶蝉三棒缨小蜂寄生假眼小绿叶蝉卵[14- 15],夏秋季在杭州地区多种茶园环境中寄生率为16%—48%,9月份高达50%—75%[15]。叶蝉三棒缨小蜂在福建茶园常年可见,在假眼小绿叶蝉卵量高峰期,其寄生率高达40%—65%[16]。尽管寄生率较高,但在自然状态下该蜂不足以控制该叶蝉,假眼小绿叶蝉仍然猖獗发生。如果研发出叶蝉三棒缨小蜂诱集剂,则将有效地诱集和指引该蜂搜寻假眼小绿叶蝉,提高搜寻效率和提升寄生率。本研究检测了假眼小绿叶蝉口针和产卵管刺伤的嫩茎气味、该叶蝉口针刺吸的芽叶气味、刺吸芽叶近邻的健康茶叶气味对该蜂的诱效,再检测源于健康茶梢和该叶蝉为害茶梢的多种挥发性组分及其组合对该蜂的引诱效应,期望筛选出有效调控叶蝉三棒缨小蜂的高效诱集剂。
1材料与方法
1.1植物组织味源和合成化合物味源引诱叶蝉三棒缨小蜂效应的室内生测
1.1.1供试昆虫
从杭州梅家坞优质丰产茶园中剪取被假眼小绿叶蝉产卵器刺伤的茶梢,立即用浸水脱脂棉包裹剪口以保湿,置入人工气候箱水培,温度25℃、相对湿度68%—72%、光照14 L∶10 D。当叶蝉三棒缨小蜂羽化出来时就用指形管收集,选用雌蜂进行生物测定。
1.1.23种供试植物组织味源
在中国计量学院茶树盆栽场:①选10株树龄5a的茶树,每株接上假眼小绿叶蝉成虫15头,分别以60目纱网罩住以防逃逸;②另选5株树龄5a茶树,分别以60目纱网罩住,每株也是接上15头假眼小绿叶蝉成虫,但留1个茶枝在纱网外不受该叶蝉为害,该茶枝上的叶片记为“叶蝉刺吸芽叶近邻的健康茶叶”。叶蝉为害10 h之后:剪下叶蝉刺吸和产卵管刺伤的嫩茎,剪下叶蝉刺吸的芽和叶;剪下叶蝉刺吸芽叶近邻的健康茶叶。这3种植物组织味源的质量皆分别设为1、2、3、4、5 g和6 g,皆以洁净空气为CK,室内执行行为测定。
1.1.329种合成化合物味源
从健康茶梢和叶蝉为害茶梢挥发物[17- 20]中选择27种主要组分(表2),购自Sigma公司,色谱纯(纯度≥98%)。以正己烷为溶剂,分别将27种组分配成10-6、10-4g/mL和10-2g/mL 3种剂量。等量地吸取每种剂量的顺- 3-己烯- 1-醇、反- 2-己烯醛和芳樟醇溶液,分别组成10-6、10-4g/mL和10-2g/mL这3种剂量的混合物1(blend 1);等量地吸取每种剂量的顺- 3-己烯- 1-醇、反- 2-己烯醛、乙酸顺- 3-已烯酯、正戊醇、正己醇、1-戊烯- 3-醇、2-戊烯- 1-醇、反- 2-戊烯醛溶液,分别组成这3种剂量的混合物2(blend 2)。每次行为测定时,分别吸取27种组分、混合物1与混合物2的3种剂量1 mL溶液作为味源,以正己烷1 mL作为CK。
1.1.4 Y管嗅觉仪及生物测定程序
如Mu等[19],Y管由无色透明玻璃制成,两臂与基部长度为10 cm,内径为1.0 cm,两臂夹角为90°。两臂分别连接味源瓶(或对照瓶)、加湿瓶、空气过滤瓶(内装满已活化的活性炭)和流量计,各部件之间以Teflon管连接。
每次测定前先抽气10 min,使Y管味源臂中充满待测信息物质,调节两臂流量为80 mL/min。测试时用指形管将1头叶蝉三棒缨小蜂从Y管基部引入,释放口离味源约30 cm。当缨小蜂逆风进入Y管的一臂并爬行5 cm则计数。
29种味源的每种剂量测试20头,每头只用1次;每测试10头,则用75%乙醇擦洗Y管内外壁,烘干,调换Y管两臂与味源瓶和对照瓶的连接位置,以消除Y管可能的不对称而造成的影响。重复5次。
每种味源测试结束之后,将Y形管、味源瓶、对照瓶和加湿瓶等玻璃部分用重铬酸钾洗液清洗,100°C烘箱烘干,活性炭置于100°C烘箱内热解吸4 h以消除吸附的气体,备用。Teflon管则以清水浸泡后,晾干待用。
生物测定在暗室内执行,暗室装有换气扇持续排除室内气味以消除对试验的影响。在Y管上方1.5 m有1盏5 W白炽灯提供照明,测试时间8:00至16:00,这期间该蜂比较活跃。室温25°C,相对湿度70%。
假设供试植物组织气味、或者合成化合物对于叶蝉三棒缨小蜂行为没有影响,则趋向味源和CK的概率均为50%,则有假设测验H0=50∶50;对于该蜂趋向味源和CK的数量差异作χ2测验,当P0.05时,则差异达显著水平。
1.28种备选诱集剂对叶蝉三棒缨小蜂引诱力的田间比较
1.2.1备选的缨小蜂诱集剂和诱芯制作
依据“1.1”行为测定结果,筛选对于叶蝉三棒缨小蜂有显著引诱活性的组分,组合配成3组分诱集剂、6组分诱集剂,分别加入液体石蜡作为缓释剂而制成三组分缓释诱集剂、六组分缓释诱集剂,分别载于橡皮头上制成三组分诱芯、三组分缓释诱芯、六组分诱芯、六组分缓释诱芯(表1)。分别以α-松油烯和正己烷为对照,制成α-松油烯诱芯、α-松油烯缓释诱芯、正己烷诱芯和正己烷缓释诱芯(表1)。每个诱芯上信息物质总剂量是100 μL。
1.2.2茶园中诱集缨小蜂的试验
选用两种色板[21]:素馨黄色板亮度L、色度坐标a和色度坐标b分别是80.25、3.82和84.12;纯白色板的L、a和b分别是82.5、3.88和-9.21。色板长40 cm、宽20 cm,两面均匀涂布无色无味昆虫胶,覆盖防粘纸。
一般地,夏秋季叶蝉三棒缨小蜂密度较大,尤其在该叶蝉第2个虫口高峰期的9—11月。遂在安徽省宣城市叶家湾选一片无公害茶园,品种为福鼎大白茶,树龄20a,茶园中树高95 cm,行距1.5 m,株距33 cm。2013年9月30日9:00—11:00,选用表1中的六组分诱芯、三组分诱芯、α-松油烯诱芯和正己烷诱芯,每个诱芯用1小段细铁丝附于1块素馨黄粘板上组成诱捕器。粘板挂于小木棍上,木棍插于茶行中,粘板的底边邻接茶梢。每种诱捕器重复30次,4种诱捕器完全随机放置,诱捕器之间间距7—8 m。每24 h调查1次板上捕获的叶蝉三棒缨小蜂数量,直至10月6日。每次调查之后调整色板的方位以便均匀地诱捕来自各个方向的叶蝉三棒缨小蜂。

表1 每个诱芯上信息物质组成
2013年10月18日,选另一片无公害茶园,使用表1的六组分缓释诱芯、三组分缓释诱芯、α-松油烯缓释诱芯和正己烷缓释诱芯,每个诱芯用1小段细铁丝附于1块纯白色粘板上组成诱捕器;同法试验,直至23日。调查时将一天分为8个时间段,即20:00—6:00、6:00—8:00、8:00—10:00、10:00—12:00、12:00—14:00、14:00—16:00、16:00—18:00和18:00—20:00。在每个时间段的最后30min统计色板上的叶蝉三棒缨小蜂数量。
2013年10月27日,再选一片无公害茶园,选取表1的六组分诱芯、六组分缓释剂诱芯,每个诱芯用1小段细铁丝附于1块素馨黄粘板上组成诱捕器,同法试验,持续11d。
1.2.3数据分析方法
2013年9月30日—10月6日,4种诱芯在同一日诱捕的叶蝉三棒缨小蜂数量之间的差异用one-way ANOVA检验,接着以Duncan′s 新复极差法比较差异显著性。
2013年10月18—23日,检测六组分缓释诱芯、三组分缓释诱芯、α-松油烯缓释诱芯和正己烷缓释诱芯的每日诱效差异性;并对每种缓释诱芯在每日8个时间段诱捕的叶蝉三棒缨小蜂数量之间的差异以Duncan′s新复极差法进行检验。
分别建立2013年10月27日—11月6日六组分诱芯、六组分缓释诱芯诱捕缨小蜂数量(y)与试验天数(x)的数学关系式,检验其相关性是否显著,再计算两个关系式的半衰期(诱捕量下降为最大诱捕量50 %时的天数),以比较两种诱芯的半衰期差异。
2结果和分析
2.13种植物组织味源显著引诱叶蝉三棒缨小蜂
与空气对照相比,假眼小绿叶蝉口针和产卵管刺伤的茶梢嫩茎、假眼小绿叶蝉口针刺吸芽叶、或者刺吸芽叶近邻的健康茶叶气味显著吸引叶蝉三棒缨小蜂;随着供试味源质量的增加,吸引效果逐渐增强;当味源质量超出一定阈值时,吸引力下降。
假设选择叶蝉口针和产卵管刺伤的茶梢嫩茎的缨小蜂数为y1、选择叶蝉口针刺吸芽叶的缨小蜂数为y2、选择刺吸芽叶近邻的健康茶叶的缨小蜂数为y3,当供试味源剂量x为1、2、3、4、5、6 g时,则分别有选择3种味源的叶蝉三棒缨小蜂数量与相应的供试味源质量之间的关系式(图1):
y1=-0.7321x2+2.8679x+10.9,R2=0.7752,P<0.05
y2=-0.3393x2+2.8607x+7.3,R2=0.5681,P<0.05
y3=-0.75x2+3.1071x+12,R2=0.8930,P<0.05
其中,与空气对照相比,刺伤嫩茎3 g、口针刺吸芽叶4 g、或者刺吸芽叶近邻的健康茶叶2 g和3 g分别显著地引诱叶蝉三棒缨小蜂(P0.05,图1)。

图1 在Y管测定过程中选择3种植物组织气味和选择洁净空气的叶蝉三棒缨小蜂数量及差异 Fig.1 Number of Stethynium empoascae attracted by three botanical odor sources vs. clear air by using Y-tube olfactometer bioassay
2.211种合成化合物的15个剂量的味源显著地引诱叶蝉三棒缨小蜂
10-4g/mL 芳樟醇、10-2g/mL 橙花醇、10-6g/mL 和10-2g/mL 正戊醇、10-6g/mL 己醇、10-4g/mL 1-戊烯- 3-醇、10-4g/mL和10-2g/mLZ-顺-茉莉酮、10-6g/mL和10-2g/mLα-松油烯、10-6g/mLα-松油醇、10-6g/mL和10-2g/mL蒈烯、10-2g/mL混合物1和10-6g/mL混合物2共15剂量对叶蝉三棒缨小蜂具有显著引诱效应(P0.05,表2)。尤其是10-4g/mLZ-顺-茉莉酮、10-2g/mL 正戊醇、10-2g/mLα-松油烯、10-6g/mLα-松油醇、10-6g/mL蒈烯、10-6g/mL混合物2共6个剂量,具有极显著引诱效应(P0.01,表2)。
2.3合成的六组分或三组分化合物诱集剂显著引诱叶蝉三棒缨小蜂
在安徽省宣城市叶家湾无公害茶园中,2013年9月30日—10月6日诱捕结果显示:六组分诱芯的诱效最佳,前3日(即10月1日、2日和3日)每日捕得的缨小蜂数量与其它3种诱芯捕得的缨小蜂数量的差异达显著水平。三组分诱芯的诱效居第2位,只是试验开始后的第1日与α-松油烯诱芯和正己烷诱芯诱得的缨小蜂数量的差异达显著水平。α-松油烯诱芯诱效比正己烷诱芯的诱效略强,但差异不显著;一般地,正己烷不吸引叶蝉三棒缨小蜂,附着正己烷诱芯的素馨黄粘板捕获了缨小蜂,主要是因为素馨黄色彩的引诱效应。到了第4日即10月4日,4种诱芯的诱效之间只是略有差异,已不显著(表3)。


表3 4种诱芯每日诱捕叶蝉三棒缨小蜂的数量及差异

诱芯Lure平均每诱芯捕获三棒缨小蜂数(平均数±标准差)AverageofStethyniumempoascaetrappedperlure(X±SD)10月1日October110月2日October210月3日October310月4日October410月5日October5六组分诱芯Six-componentlure35.3±3.99a19.6±3.06a18.6±2.58a11.7±1.49a7.2±1.62a三组分诱芯Three-componentlure26.1±2.78b13.8±3.33b16.4±2.95b10.9±1.32a6.9±1.53aα-松油烯诱芯α-Terpinenelure20.5±1.72c13.1±2.38b15.3±2.18bc10.9±1.40a6.8±1.09a正己烷诱芯n-Hexanelure19.6±2.46c13.4±3.34b14.8±1.86c11.6±1.45a6.6±1.30a
同一列中标有不同小写字母的数值之间的差异达显著水平(P0.05)。每个处理重复数为30次
2.4缓释剂明显地延长六组分或者三组分诱芯的效果
在叶家湾供试茶园中2013年10月18—23日检测4种缓释诱芯的诱效,尽管使用的载体为纯白粘板,且这一阶段田间缨小蜂密度明显下降,但还是以六组分诱芯最佳、三组分诱芯次之(表4)。表3中六组分诱芯、三组分诱芯、α-松油烯诱芯和正己烷诱芯在茶园中使用到第4日,4种诱芯诱效之间已无显著差异;表4列出了4种缓释诱芯诱效,在第4日六组分缓释诱芯与正己烷缓释诱芯的诱效之间仍有显著差异(表4),亦即缓释剂延长了六组分诱芯的效果。

表4 4种缓释诱芯每日诱捕三棒缨小蜂的数量及差异
2.5三棒缨小蜂日活动节律和诱捕时间
每日每种诱芯均以6:00—8:00和8:00—10:00两个时间段引诱的叶蝉三棒缨小蜂数量最多,与其它时间段的诱捕数量差异达到显著水平;每日这两个时间段诱捕数量占诱捕总量的50%以上(图2)。
2.6缓释剂明显地延长六组分诱芯的半衰期
在2013年10月27日试验开始之后的11d内,分别求出六组分诱芯、六组分缓释诱芯捕获的缨小蜂数量(y)与天数(x)之间的关系式:
y=0.1571x2-2.874x+14.347,R2=0.8586,P<0.05
以及
y=0.0945x2-2.0897x+12.881,R2=0.9857,P<0.05
依据这2个关系式,算得六组分诱芯、六组分缓释诱芯的半衰期分别为2.98d和3.68d,亦即添加了液体石蜡,延长了诱捕半衰期0.7d(图3,图4)。
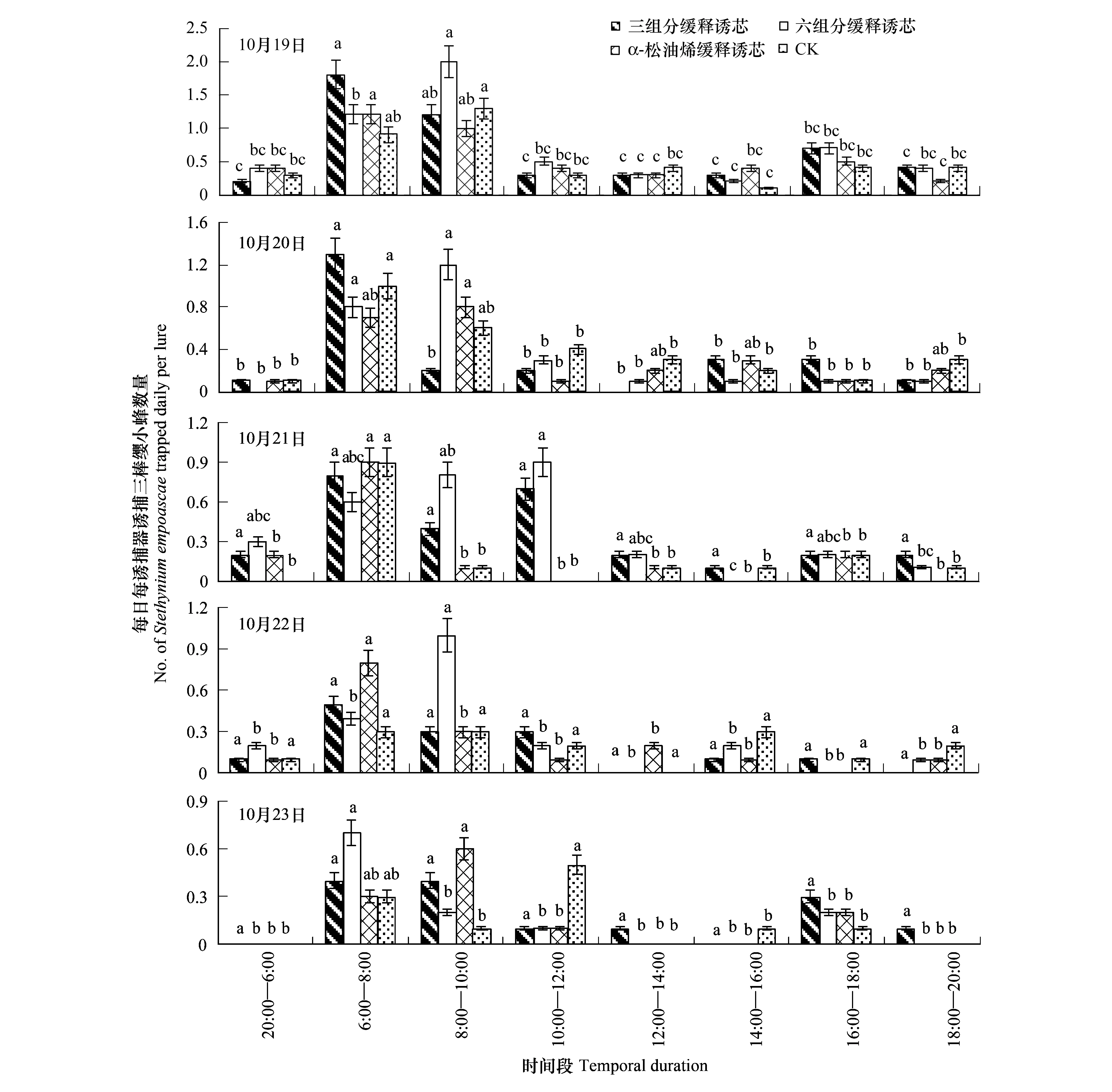
图2 每日8个时间段茶园中4种诱芯捕获的叶蝉三棒缨小蜂数量Fig.2 Average of Stethynium empoascae caught within eight temporal durations of each experimental day by four types of lures
3讨论
虫害诱导植株产生防御性反应,释放互利素招引天敌[2,9]。本研究发现假眼小绿叶蝉口针刺吸和产卵管刺伤嫩茎的气味、口针刺吸芽叶的气味强烈地引诱叶蝉三棒缨小蜂,即肯定了受害的嫩茎和芽叶气味中含有互利素。植株未受虫害的部分也会被诱导而产生防御反应[22],本研究对于叶蝉三棒缨小蜂的行为观察结果就表明:被刺吸芽叶近邻的健康茶叶的气味也显著地吸引该蜂。在一定时空条件下,供试味源质量超出某个阈值时,则引诱效果下降,甚至出现忌避(图1),这是受试昆虫对于味源剂量的一种共性反应,龟纹瓢虫也有类似的行为反应[23]。而如何把互利素精细地组成可以付诸实施的诱集剂?则是饶有兴趣的课题。很多试验表明,当把两种或两种以上的互利素混合在一起时,通常很难构成高效的天敌诱集剂。
为此,本研究从假眼小绿叶蝉为害茶树挥发物和健康茶树挥发物中选出27种组分,先于室内进行行为测定,筛选出显著引诱叶蝉三棒缨小蜂的单组分,再按其剂量将几种成分组合在一起,于田间诱集该蜂,评价其有效性,发现了本研究的六组分诱集剂具有优良的诱效。该六组分诱集剂在田间测试的第4日,其诱集效应与对照的诱集效应差异就不明显了,说明常规的羊毛毡或橡皮头作为载体的植物源诱芯,其诱效或者半衰期还不是很长。本研究尝试性地加入液体石蜡,将六组分诱集剂半衰期延长0.7d。虽然0.7d不算太长,但在田间,延长0.7d时间就会诱来许多天敌,也说明了阻抑诱集剂的释放速率是延长诱效、提升诱集效率的途径之一。

图3 六组分诱芯每日平均诱捕的叶蝉三棒缨小蜂数量 Fig.3 Daily average of Stethynium empoascae trapped by six-component lure
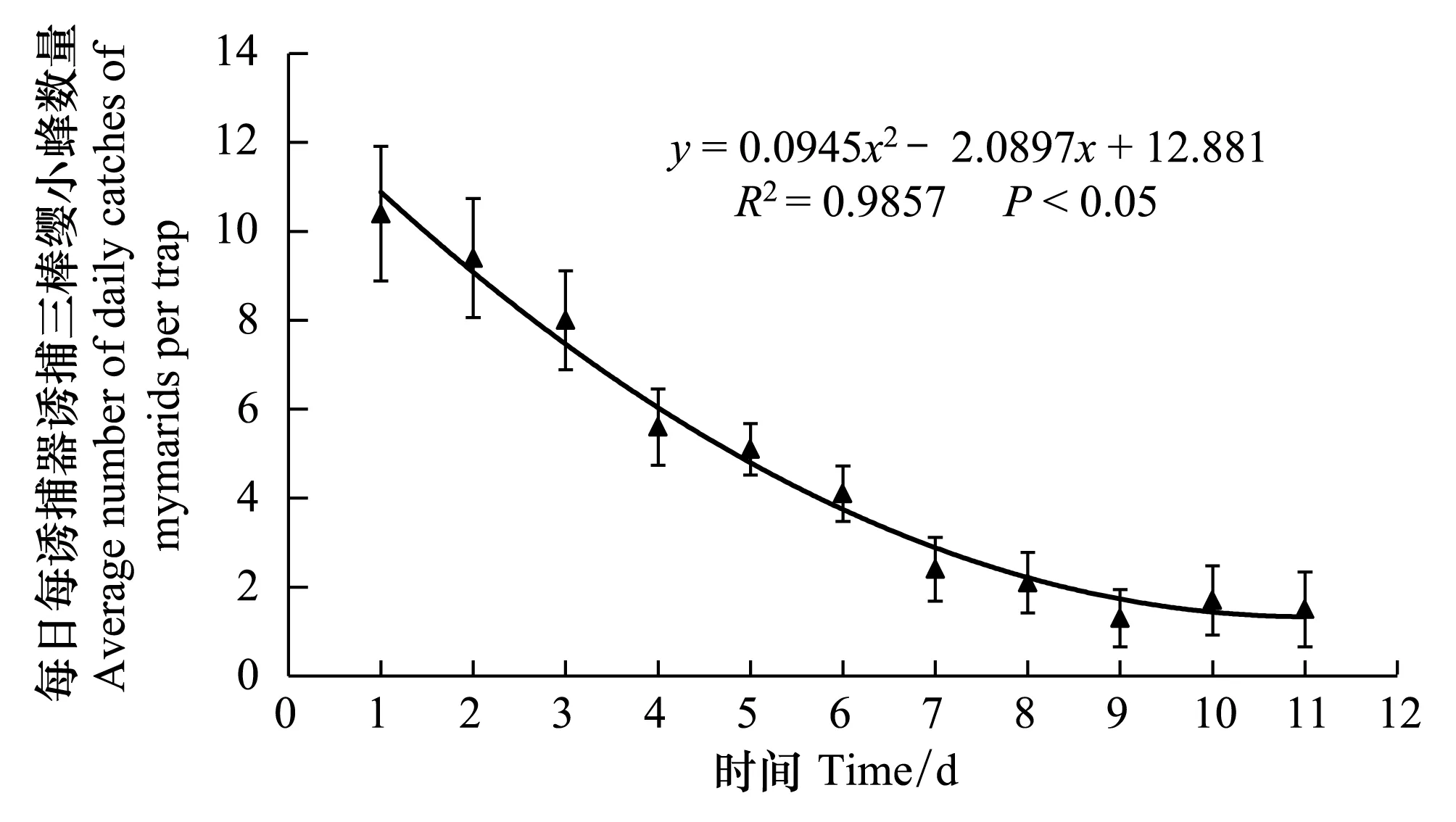
图4 六组分缓释诱芯每日平均诱捕的三棒缨小蜂数量 Fig.4 Daily average of Stethynium empoascae trapped by six-component controlled release lure
顺-茉莉酮具有愉快的香味,是茶叶主要香气成分之一[20]。本研究首次发现其强烈地引诱叶蝉三棒缨小蜂。事实上已有报道顺-茉莉酮是阿尔蚜茧蜂AphidiuserviHaliday的重要引诱剂[24]。芳樟醇可引起蚜茧蜂Aphidiussp. 强烈的触角电位反应[18],门氏食蚜蝇SphaerophoriamenthastriL. 对于橙花醇有显著趋性[25]。戊醇、己醇、1-戊烯- 3-醇、α-松油烯、α-松油醇和蒈烯6种信息物质显著引起叶蝉三棒缨小蜂的趋性系首次报道。茶梢信息物质及其组合对于茶园中缨小蜂类的引诱作用还在继续探讨中,期望还能够筛选出高效稳定的诱集剂。
色彩也吸引叶蝉三棒缨小蜂,如果在6:00—10:00该蜂最活跃时期叠加使用互利素与色彩的诱效,则可强化该蜂对于假眼小绿叶蝉的搜寻效应、提升寄生率。
参考文献(References):
[1]Bernays E A, Chapman R E. Host-plant Selection by Phytophagous Insects. US: Springer, 1994: 312- 312.
[2]Turlings T C J, Tumlinson J H, Lewis W J. Exploitation of herbivore-induced plant odors by host-seeking parasitic wasps. Science, 1990, 250(4985): 1251- 1253.
[3]Turlings T C J, Loughrin J H, McCall P J, Röse U S, Lewis W J, Tumlinson J H. How caterpillar-damaged plants protect themselves by attracting parasitic wasps. Proceedings of the National Academy of Sciences, 1995, 92(10): 4169- 4174.
[4]Turlings T C J, Fritzsche M E. Attraction of parasitic wasps by caterpillar-damaged plants // Organizer D J C, Goode J A, eds. Novartis Foundation Symposium. Wiley, 1999, 223: 21- 32.
[5]Dicke M. Evolution of induced indirect defense of plants // Tollrian R, Harvell C J, eds. The Ecology and Evolution of Inducible Defenses. Princeton: Princeton University Press, 1999: 62- 88
[6]Dicke M. Chemical ecology of host-plant selection by herbivorous arthropods: a multitrophic perspective. Biochemical Systematics and Ecology, 2000, 28(7): 601- 617.
[7]Dicke M, van Loon J J A. Multi-trophic effects of herbivore-induced plant volatiles in an evolutionary context. Entomologia Experimentalis et Applicata, 2000, 97(3): 237- 249.
[8]Steinberg S, Dicke M, Vet L E M. Relative importance of infochemicals from first and second trophic level in long-range host location by the larval parasitoidCotesiaglomerata. Journal of Chemical Ecology, 1993, 19(1): 47- 59.
[9]Tumlinson J H, Turlings T C J, Lewis W J. Semiochemically mediated foraging behavior in beneficial parasitic insects. Archives of Insect Biochemistry and Physiology, 1993 22(3/4): 385- 391.
[10]De Moraes C M, Lewis W J, Paré P W, Alborn H T, Tumlinson J H. Herbivore-infested plants selectively attract parasitoids. Nature, 1998, 393(6685): 570- 573.
[11]Paré P W, Tumlinson J H. Cotton volatiles synthesized and released distal to the site of insect damage. Phytochemistry, 1998, 47(4): 521- 526.
[12]赵冬香, 陈宗懋, 程家安. 茶树-假眼小绿叶蝉-白斑猎蛛间化学通讯物的分离与活性鉴定. 茶叶科学, 2002, 22(2): 109- 114.
[13]朱俊庆. 茶树害虫. 北京: 中国农业科技出版社, 1999: 100- 102.
[14]李慧玲, 林乃铨. 假眼小绿叶蝉卵缨小蜂的生物学特性研究. 茶叶科学, 2008, 28(6): 407- 413.
[15]韩宝瑜, 林金丽, 周孝贵, 章金明. 假眼小绿叶蝉卵及卵寄生蜂缨小蜂形态观察和寄生率考评. 安徽农业大学学报, 2009, 36(1): 13- 17.
[16]毛迎新, 邹武, 马新华, 高明清, 林乃铨. 假眼小绿叶蝉卵的寄生蜂种类及种群动态. 昆虫知识, 2008, 45(3): 472- 474.
[17]许宁, 陈宗懋, 游小清. 引诱茶尺蠖天敌寄生蜂的茶树挥发物的分离与鉴定. 昆虫学报, 1999, 42(2): 126- 131.
[18]Han B Y, Chen Z M. Behavioral and electrophysiological responses of natural enemies to synomones from tea shoots and kairomones from tea aphids,Toxopteraaurantii. Journal of Chemical Ecology, 2002, 28(11): 2203- 2219.
[19]Mu D, Cui L, Ge J, Wang M X, Liu L F, Yu X P, Zhang Q H, Han B Y. Behavioral responses for evaluating the attractiveness of specific tea shoot volatiles to the tea green leafhopper,Empoacavitis. Insect Science, 2012, 19(2): 229- 238.
[20]李名君. 化学部 // 陈宗懋. 中国茶叶大辞典. 北京: 中国轻工业出版社, 2000: 323- 359.
[21]郑颖姹, 钮羽群, 崔桂玲, 周宁宁, 张新亭, 王梦馨, 崔林, 郑雨婷, 韩宝瑜. 秋末苏南茶园昆虫的群落组成及其趋色性. 生态学报, 2013, 33(16): 5017- 5025.
[22]Dicke M. Local and systemic production of volatile herbivore-induced terpenoids: their role in plant-carnivore mutualism. Journal of Plant Physiology, 1994, 143(4/5): 465- 472.
[23]元黎, 江丽蓉, 秦华光, 韩宝瑜, 王荣富. 龟纹瓢虫对茶树挥发物的行为反应. 浙江农业学报, 2008, 20(2): 96- 99.
[24]Birkett M A, Campbell C A M, Chamberlain K, Guerrieri E, Hick A J, Martin J L, Matthes M, Napier J A, Pettersson J, Pickett J A, Poppy G M, Pow E M, Pye B J, Smart L E, Wadhams G H, Wadhams L J, Woodcock C M. New roles forcis-jasmone as an insect semiochemical and in plant defense. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(16): 9329- 9334.
[25]韩宝瑜, 周成松. 茶梢和茶花主要挥发物对门氏食蚜蝇和大草蛉引诱效应. 应用生态学报, 2004, 15(4): 623- 626.
基金项目:国家自然科学基金项目(31071744);浙江省教育厅项目(Y201329611);浙江省大学生创新创业项目(2014R409056,2015R409052)
收稿日期:2015- 07- 27;
修订日期:2015- 11- 10
*通讯作者
Corresponding author.E-mail: han-insect@263.net
DOI:10.5846/stxb201507271573
Evaluation of attraction of volatile semiochemicals from tea shoots to the mymaridStethyniumempoascae
PAN Cheng1,LIN Jinli1, 2,HAN Baoyu1,*
1ZhejiangProvincialKeyLaboratoryofBiometrologyandInspection&Quarantine,CollegeofLifeSciencesofChinaJiliangUniversity,Hangzhou310018,China2DafengFarminYanchengCityofJiangsuProvince,Yancheng224100,China
Abstract:To determine the potential attraction of tea shoot volatiles to Stethynium empoascae, a key egg parasitoid of the tea green leafhopper, laboratory behavioral bioassays using a Y-tube olfactometer and field trapping experiments in tea plantations were carried out. Results were as follows: 1) volatiles released from the tender tea stems, buds, or leaves damaged by the feeding and oviposition activities of tea green leafhoppers, and their nearby un-damaged leaves, strongly attracted the mymarid S. empoascae; 2) twenty-seven volatile compounds were identified from healthy and leafhopper-damaged tea shoots as main components. Their synthetic candidates were dissolved in hexane at three dosages (10-6, 10-4g/mL, and 10-2g/mL) and further tested in the Y-tube olfactometer as odor resources on S. empoascae. It was found that cis-jasmone, linalool, nerol, pentanol, hexanol, 1-penten- 3-ol, α-terpinene, α-terpineol, and (+)- 3-carene significantly attracted the parasitoid at one or two dosages tested. Field trapping results indicated that: 1) a ternary blend (at 1∶1∶1 ratio) of cis-jasmone, linalool, and 1-penten- 3-ol each at 10-4g/mL attracted more mymarids than any individual components in the tea gardens; furthermore, a mixture of six compounds (at equivalent ratios) including nerol, pentanol, and α-terpinene (each at 10-2g/mL) along with hexanol, α-terpineol, and (+)- 3-carene (each at 10-6g/mL) attracted even more mymarids; 2) the half-life of the six-component blend was extended for 0.7 more days when liquid paraffin was added as a controlled release agent; 3) the mymarids were active mainly during 6:00—10:00 a. m., accounting for > 50% of the daily mymarid trap catches. In conclusion, volatiles from the tea leaves on the leafhopper-damaged shoots efficaciously attract mymarid parasitoids. Furthermore, synthetic tea shoot volatile blends at near natural release ratios, and their combinations with the jasmine yellow color might be more attractive to the egg parasitoid.
Key Words:tea shoot volatiles; Stethynium empoascae; cis-jasmone; parasitoid attractant
潘铖,林金丽,韩宝瑜.茶梢信息物引诱叶蝉三棒缨小蜂效应的检测.生态学报,2016,36(12):3785- 3795.
Pan C,Lin J L,Han B Y.Evaluation of attraction of volatile semiochemicals from tea shoots to the mymaridStethyniumempoascae.Acta Ecologica Sinica,2016,36(12):3785- 3795.

