PKH67示踪骨髓间充质干细胞迁移至损伤脊髓的实验研究
马娇 张雪梅 孙杨 俞冰倩
PKH67示踪骨髓间充质干细胞迁移至损伤脊髓的实验研究
马娇 张雪梅 孙杨 俞冰倩
目的 探讨SCI后体外移植PKH67标记的BMSCs迁移至脊髓损伤处并进行增值和分化的动员情况。方法 用梯度离心法分离和培养出SD 大鼠第3代BMSCs,用绿色荧光染料PKH67标记;采用钳夹法制备脊髓损伤(SCI)模型,分为实验组(n=15)、对照组(n=16)、假手术组(n=16);SCI术后对脊髓损伤组织进行HE染色,实验组和假手术组于术后尾静脉移植含有1×107个BMSCs的0.5 mL生理盐水,对照组注射等量生理盐水;分别于术后1、7、14、21 d观察大鼠后肢运动功能恢复情况,并做BBB分;术后21 d后取脊髓组织,行免疫荧光染色,观察BMSCs的迁移,增值和分化情况。结果 (1)镜下可见损伤脊髓形成的空洞、坏死及炎性细胞的增多;(2)共聚焦荧光显微镜观察显示术后21 d实验组脊髓损伤部位可见移植的BMSCs, 部分BMSCs呈GFAP和Nestin阳性表达;假手术组无 PKH67标记的BMSCs;实验组GFAP和Nestin阳性细胞数较对照组和假手术组明显增加(P<0.05),对照组较假手术组增加不明显(P>0.05);(3)实验组和对照组BBB评分均有增加,但实验组BBB评分显著高于对照组(P<0.05)。结论 PKH67示踪的BMSCs可迁移至损伤脊髓部位,进行增值并分化为神经元样细胞,促进损伤脊髓的神经功能恢复。
PKH67 骨髓间充质干细胞 脊髓损伤 增值
随着工矿事业和现代交通事业的发展,脊髓损伤(spinal cord injury,SCI)的发病率近几年在不断上升,SCI是以损伤平面以下感觉、运动神经系统功能丧失的中枢神经系统严重疾病。虽然现在有类固醇类、金属蛋白酶抑制剂、蛋白激酶抑制剂和再生技术等多种方法来改善SCI患者的症状,但是效果都很有限[1~2]。近年随着生物学和分子生物学的发展,干细胞移植已经成为一种有效的治疗手段[3]。其中,骨髓间充质干细胞(bone marrow mensenchymal stem cells,BMSCs)因为其具有易于提取和培养、多向分化、低免疫原性等能力已经成为众多学者的研究方向[4~5],并且已经应用于临床治疗SCI[6]。但目前仍存在许多问题需要解决,其中主要问题之一就是移植细胞在体内的迁移、增值和分化情况。为了追踪并观察移植细胞在宿主体内的存活、迁移和分化情况就必须对移植细胞加以标记,以便识别和监测。目前,已经有研究者用PKH26及基因转染的方法标记[7~9],而用绿色荧光染料PKH67标记BMSCs的研究却鲜有报道。本实验采用绿色荧光染料PKH67标记BMSCs,探讨SCI后体外移植PKH67标记的骨髓间充质干细胞迁移至损伤处并进行增值和分化的动员情况。
1 材料与方法
1.1 实验动物及主要试剂、仪器
成年雌性SD大鼠47只,体重200~220 g;1月龄雄性SD鼠8只,体重40~60 g;均由哈尔滨医科大学附属第二医院实验动物中心提供,动物质量合格证号为SCXK- (黑) 2013-001,实验中对动物处置均符合中华人民共和国科学技术部2016年发布的《关于善待实验动物的指导性意见》[10],获得哈尔滨医科大学伦理委员会批准 (审查编号为HMUIRB20150029)。主要试剂与仪器:PKH67试剂盒(PKH67染料1瓶,0.1 mL,稀释液C 1瓶,10 mL,Sigma公司);DMEM/F12(Hyclone公司);胎牛血清(ScienCell公司);淋巴细胞分离液(天津灏洋);兔单克隆抗体GFAP,小鼠单克隆抗体Nestin(Abcam公司);FV-1000共聚焦荧光显微镜(Olympus公司)。
1.2 方法
1.2.1 BMSCs的制备及培养 取8只1月龄雄性SD大鼠,10%水合氯醛腹腔注射麻醉,体积分数75%乙醇全身浸泡消毒10 min;无菌环境中取股骨及胫骨,PBS浸泡;在超净台中用无菌器械剥去肌肉组织,剪掉股骨及胫骨的骨骺端,用5.0 mL灭菌注射器抽取4.0 mL DMEM-F12培养基,冲出骨髓,反复吹打,收入无菌离心管中。向骨髓细胞悬液中缓缓加入与之相等的淋巴细胞分离液,2500 r/min,离心30 min;取出离心管可见液体分4层(图1),用无菌吸管吸取第2层(从上向下数)雨雾状液体,移入另一离心管中,用5.0 mL DMEM培养基洗涤1次,1500 r/min,离心5 min,弃上清,加入4.0 mL含10%胎牛血清的培养液,充分吹打混匀至单细胞悬液,接种于无菌透气培养瓶中;置于37 ℃、体积分数5% CO2、饱和湿度培养箱中培养;3 d后首次换液,以后每3 d换液1次,1周后当细胞生长融合达80%以上时,以0.25%胰蛋白酶消化后按1∶2比例进行传代培养,倒置显微镜下观察细胞形态及生长情况。
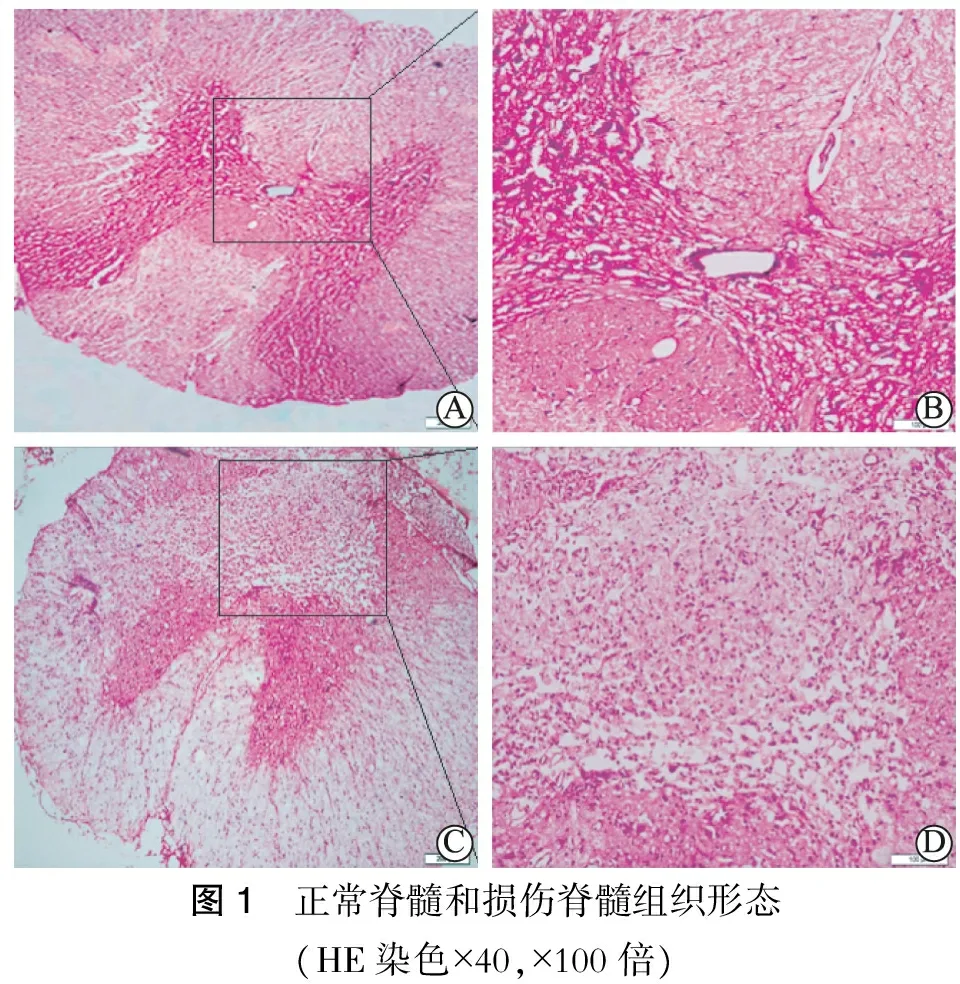
图1 正常脊髓和损伤脊髓组织形态(HE染色×40,×100倍)
1.2.2 PKH67标记BMSCs 首先将含2×107细胞的悬液放于离心管中,用无血清培养基DMEM洗1次;400 r/min离心5 min,弃去上清,使细胞团上剩余液体小于25.0 μL;染色前准备2×细胞染料 (4×10-6M)用稀释液C稀释,即在1.0 mL稀释液C中加4.0 μL的PKH67染料,置于离心管中,充分混匀;准备2×细胞悬液即加1.0 mL稀释液C到细胞团中,重悬细胞保证完全离散,但注意不要旋转震荡,不要让细胞在稀释液中存留太长时间;尽快加1.0 mL的2×细胞悬液到1.0 mL 2×染料悬液中,立即用吸管均匀快速混合样品;在混匀的预定体积中最终浓度将是2×10-6M PKH67染料和1×107细胞;25 ℃孵育含有细胞和染料的悬液5 min,定期混匀;然后加入等量(2.0 mL) 的血清或其他合适的蛋白溶液(1% BSA)终止染色反应;充分混匀,孵育1min来和过量的染料结合;25 ℃细胞离心,400 r/min,10 min,弃去上清;向离心管中加入10.0 mL完全培养液,重悬细胞团,然后移到新试管中,25 ℃离心,400 r/min,5 min;弃去上清后用10.0 mL完全培养基清洗细胞团2次,确保洗掉了未结合的染料;在最后清洗后以1.0 mL生理盐水重悬,细胞浓度为2×107个/mL。
1.2.3 大鼠SCI模型制备 47只成年雌性大鼠随机编号,分为3组,A组为实验组 (SCI+BMSCs移植,n=15),B组为对照组(SCI+生理盐水,n=16),C组为假手术组(假手术+BMSCs移植,n=16);术前8 h禁食、禁水,称重后以10%水合氯醛腹腔注射麻醉(3 mL/kg),定位后沿后正中线切开3.0 cm长皮肤,钝性分离筋膜及肌肉,充分暴露T9-T11脊椎,咬除T10及部分T9、T11棘突及椎板,不破坏硬脊膜,暴露该段脊髓组织,用动脉瘤夹夹持脊髓,时间为1 min;夹持过程中可见大鼠尾巴逐渐卷曲翘起,双后肢出现抽搐,随后尾巴及双后肢松弛瘫软;移除动脉瘤夹后可见T9-T10 段脊髓明显充血 (图2),去除残余的肌肉组织及骨碎片,用生理盐水冲洗伤口,后用庆大霉素冲洗,逐层缝合假手术组仅暴露出脊髓组织,不进行动脉瘤夹加持。对实验组和假手术组大鼠尾部用碘伏消毒,1.0 mL无菌注射器吸取0.5 mL上述制备好的骨髓细胞液,缓慢经尾静脉注射,注射时间大于2 min,对照组注射等量生理盐水。大鼠术中和术后期间体温维持在37 ℃,术后每只鼠分笼饲养,饮用含500 g/L 庆大霉素水7 d,防止感染;每日各早晚予以人工膀胱按摩排尿1次,直至恢复自主排尿功能。

图2 脊髓损伤前后脊髓形态
1.2.4 运动功能评价BBB评分 大鼠后肢运动功能的恢复通过BBB (Basso,Beattie,Bresnahan)评分[11]检测,包括0~21分,0分为后肢完全瘫痪,无运动,21分为完全正常。在术后1、7、14、21 d,两名对实验双盲的人员观察大鼠后肢运动并记录评分。
1.2.5 组织病理学检测 造模1 d后分别取对照组和假手术组大鼠各1只,以10%水合氯醛腹腔注射麻醉,仰卧位固定,剪开胸骨,暴露心脏,经左心室灌注生理盐水2000 mL,先快后慢;直至右心耳流出清亮的液体后开始灌注4%多聚甲醛300 mL,前100 mL快灌,当出现肌颤后改为慢灌,直至肝脏质地变硬;然后将全部脊髓组织取出,进行拍照;后截取损伤部位上下各1.0 cm的脊髓组织,放置于4%多聚甲醛溶液中继续后固定24 h;然后将脊髓组织进行冲洗、脱水、透明、浸蜡、包埋、制成4 μm切片,每10张取1张进行HE染色;染色后显微镜下观察脊髓损伤部位的组织形态学变化。
1.2.6 组织免疫荧光染色 剩余大鼠按上述方法处死,取损伤部位上下各1.0 cm的脊髓组织放置于4%多聚甲醛溶液中继续后固定24 h,继续30%蔗糖脱水48 h以上;在冰冻切片机内-24 ℃环境下进行OCT包埋,行4 μm厚度的切片;将切片在室温25 ℃复温30 min,浸入4 ℃预冷的丙酮固定10 min;将切片用0.01 mol/L的PBS冲洗3次,每次10 min;然后用含0.25% TritonX-100的0.01 mol/L的PBS对组织通透处理30 min,山羊血清封闭30 min;去除山羊血清后加入一抗兔抗GFAP (稀释浓度为1∶400)、Nestin (稀释浓度为1∶200),放置于避光湿盒中4 ℃过夜;第2 d取出湿盒,室温下复温30 min,0.01 mol/L的PBS冲洗3次;加入Dylight 594山羊抗兔,抗小鼠荧光二抗,37 ℃孵育1 h;取出,0.01 mol/L的PBS冲洗3次;用DAPI染核10 min,0.01 mol/L的PBS冲洗3次,后在蒸馏水中漂洗1次;用滤纸吸除多余水分,每张组织切片加入10 μL抗荧光淬灭封片剂,进行封片;激光共聚焦显微镜下进行观察PKH67,GFAP,Nestin阳性细胞分布情况,并拍照。每个组织选不连续3张切片进行染色,每张切片随机选取6个(×40倍)视野进行计数。
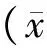
2 结 果
2.1 脊髓组织形态观察
术后1 d光镜下可见损伤的脊髓组织结构被破坏,有大量炎性细胞浸润,有较多的空腔形成,神经细胞水肿、坏死 (图1)。
2.2 骨髓间充质干细胞形态观察
培养第3 d可见原代培养的骨髓细胞开始贴壁,细胞呈梭形、三角形或多角形外观,杂质较多,换液去除未贴壁的杂质细胞后可见部分细胞形成集落;后每3~4 d换1次培养液,7~10 d可见细胞融合达到80%~90%,呈漩涡状,均匀一致生长;后进行消化传代,传代细胞24 h后完全贴壁,生长更加迅速,4 d左右即可传代,取第3代细胞进行染色(图3)。
2.3 PKH67标记阳性细胞的检测
PKH67染料染色后在荧光显微镜下观察,可见BMSCs细胞膜在波长为488 nm的激发光作用下发出明亮的绿色荧光,表面细胞标记成功(图3);移植21 d后在共聚焦荧光显微镜下可发现,实验组损伤脊髓组织周围均可见到分布的绿色荧光光点,为PKH67阳性细胞(记为PKH67+),而假手术组没有阳性细胞。
2.4 免疫荧光染色观察
术后21 d共聚焦荧光显微镜下可见实验组脊髓损伤组织周围GFAP阳性和Nestin阳性的PKH67标记的BMSCs (记为GFAP+,Nestin+),胞膜呈现绿色荧光,胞浆呈现红色荧光,胞核呈现蓝色荧光,共合成后呈现黄绿色荧光(图4)。假手术组对应的脊髓组织周围几乎没有PKH67+细胞(图4)。 实验组GFAP和Nestin阳性细胞数较对照组和假手术组明显增加(P<0.05),对照组较假手术组增加不明显(P>0.05)。
2.5 运动功能评价
SCI术后1 d假手术组大鼠四肢恢复活动,但未达正常水平,实验组和对照组大鼠评分均为0分,BBB评分比较差异无统计学意义(P>0.05)。术后1周假手术组恢复正常,实验组和对照组BBB评分均有增加, 差异有统计学意义(P<0.05)。术后2、3周实验组BBB评分明显高于对照组(16.0±1.7,9.2±1.2;13.2±1.8,19.0±1.4;P<0.05)(图5)。
3 讨 论
SCI是一种严重并常见的中枢神经系统疾病,它可直接导致神经损伤,从而引起损伤平面以下感觉及运动功能的丧失,为患者的家庭及整个社会带来沉重的经济负担。SCI分为原发性损伤阶段(物理损伤阶段)和继发性损伤阶段,原发性损伤是脊髓直接受到外力后引起的组织损伤,继发性损伤是原发性损伤后的缺血、炎症、过氧化作用、轴突脱髓鞘、瘢痕形成等过程[12~13]。因此,治疗SCI的继发性损伤十分重要,目前临床治疗方法包括大剂量激素、手术治疗减轻脊髓压迫、物理治疗及联合治疗,然而这些治疗效果都比较有限[14]。近年来,干细胞移植通过减少损伤体积,减轻胶质瘢痕形成,诱导轴突再生等治疗SCI已经成为一种新型治疗方法[15]。骨髓间充质干细胞又称骨髓基质干细胞,是一类非造血干细胞,具有多向分化潜能,可以分化为脂肪细胞、软骨细胞、成肌细胞等,可作为细胞治疗的来源[16]。

图3 BMSCs提取分层,形态及PKH67染色(×40倍)

图4 移植的BMSCs在损伤脊髓组织中的检测(×40倍)

图5 各组BBB评分
因此,BMSCs移植已经成为近几年治疗SCI的研究热点,大量动物实验和临床前期分析证明BMSCs能够增加动物SCI后修复。然而其治疗SCI的机制十分复杂,移植细胞在体内的迁移,增值和分化情况仍在研究中。
在目前研究中有三种主要的脊髓损伤动物模型即脊髓横断模型、脊髓挫伤模型和脊髓压迫模型。本实验采用和人类脊髓损伤发生过程最为接近的脊髓压迫模型,通过尾静脉移植PKH67标记的BMSCs,来研究它对SCI的治疗作用。在术后通过镜下观察损伤部位的脊髓组织来确定造模成功,同时通过BBB运动功能评分来评价BMSCs的治疗效果。PKH67是一种通过长脂肪族末端结合细胞膜脂质区的绿色荧光染料,它通过细胞膜上的受体与细胞相连接,减少了染料标记细胞转与非标记细胞的交换。其性质稳定,无细胞毒性,半衰期较长,可在488 nm的激发光作用下发出绿色荧光。本实验可观察到PKH67+的BMSCs在大鼠SCI模型中存活良好,并可迁移到损伤组织周围,部分分化为神经胶质细胞和类神经元,而未损伤的脊髓组织内几乎没有PKH67+的BMSCs分布。这说明损伤脊髓组织神经元的坏死、炎症介质的释放、损伤微环境的形成都可能刺激外源性移植的BMSCs迁移至损伤区域,并诱导其分化为神经元,从而修复神经功能的缺损。动物行为测定也发现,BMSCs移植的大鼠运动神经功能恢复均好于单纯SCI的大鼠。
综上本实验可说明以下几个问题:(1)在脊髓损伤时部分外源性移植的BMSCs可以通过血脑屏障到达损伤脊髓组织,本研究推测这可能是由于损伤区的血脑屏障开放,便于BMSCs进入脊髓组织;(2)未进入脊髓组织的BMSCs可能通过血液进入其他组织器官;(3)通过静脉移植的BMSCs能够迁移到损伤脊髓组织中,并分化为类神经元,修复损伤;(4)PKH67标记BMSCs保持了其干细胞生物学特性,是一种,安全、有效、实用的标记方法,可用于干细胞在活体内的示踪。以后,可以进一步研究BMSCs除了分化为类神经元外,是否还有通过其他作用如抑制凋亡蛋白表达、分泌神经营养因子等作用共同促进损伤脊髓的恢复,为BMSCs在未来临床更大范围的应用上提供有力证据。
[1] Liu WG,Wang ZY,Huang ZS.Bone marrow-derived mesenchymal stem cells expressing the bFGF transgene promote axon regeneration and functional recovery after spinal cord injury in rats[J].Neurol Res,2011,33(7):686-693.
[2] Silva NA,Sousa N,Reis RL,et al.From basics to clinical: a comprehensive review on spinal cord injury[J].Prog Neurobiol,2014,114:25-57.
[3] Murray M.Cellular transplants: steps toward restoration of function in spinal injured animals[J].Prog Brain Res,2004,143:133-146.
[4] Yin F,Guo L,Meng CY,et al.Transplantation of mesenchymal stem cells exerts anti-apoptotic effects in adult rats after spinal cord ischemia-reperfusion injury[J].Brain Res,2014,1561:1-10.
[5] Neirinckx V,Agirman G,Coste C,et al.Adult bone marrow mesenchymal and neural crest stem cells are chemoattractive and accelerate motor recovery in a mouse model of spinal cord injury[J].Stem Cell Res Ther,2015,6:211.
[6] Jiang PC,Xiong WP,Wang G,et al.A clinical trial report of autologous bone marrow-derived mesenchymal stem cell transplantation in patients with spinal cord injury[J].Exp Ther Med,2013,6(1):140-146.
[7] Kang ES,Ha KY,Kim YH.Fate of transplanted bone marrow derived mesenchymal stem cells following spinal cord injury in rats by transplantation routes[J].J Korean Med Sci,2012,27(6):586-593.
[8] Gu W,Zhang F,Xue Q,et al.Transplantation of bone marrow mesenchymal stem cells reduces lesion volume and induces axonal regrowth of injured spinal cord[J].Neuropathology,2010,30(3):205-217.
[9] Torres-Espín A,Redondo-Castro E,Hernndez J,et al.Bone marrow mesenchymal stromal cells and olfactory ensheathing cells transplantation after spinal cord injury--a morphological and functional comparison in rats[J].Eur J Neurosci,2014,39(10):1704-1717.
[10]The Ministry of Science,Technology of the People's Republic of China.Guidance suggestions for the care and use of laboratory animals[Z],2016.
[11]Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].J Neurotrauma,1995,12(1):1-21.
[12]Yin X,Yin Y,Cao FL,et al.Tanshinone IIA attenuates the inflammatory response and apoptosis after traumatic injury of the spinal cord in adult rats[J].PLoS One,2012,7(6):e38381.
[13]Rowland JW,Hawryluk GW,Kwon B,et al.Current status of acute spinal cord injury pathophysiology and emerging therapies: promise on the horizon[J].Neurosurg Focus,2008,25(5):E2.
[14]Silva NA,Sousa N,Reis RL,et al.From basics to clinical: a comprehensive review on spinal cord injury[J].Prog Neurobiol,2014,114:25-57.
[15]Gu W,Zhang F,Xue Q,et al.Transplantation of bone marrow mesenchymal stem cells reduces lesion volume and induces axonal regrowth of injured spinal cord[J].Neuropathology,2010,30(3):205-217.
[16]Friedenstein AJ,Gorskaja JF,Kulagina NN.Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J].Exp Hematol,1976,4(5):267-274.
(2016-04-22收稿)
Study on the utilization of PKH67 in the transplantation of bone marrow mesenchymal stem cells to injured spinal cord
MaJiao,ZhangXuemei,SunYang,etal.
DepartmentofNeurology,SecondAffiliatedHospitalofHarbinMedicalUniversity,Harbin150086
Objective To investigate the utilization of PKH67 in the transplantation of bone marrow mesenchymal stem cells to injured spinal cord and the migration,proliferation and differentiation of the BMSCs.Methods Density gradient centrifugation method was used for isolating the rat BMSCs and the 3rd passage of BMSCs were labeled with green fluorescent dye PKH67.SCI model was generated by using aneurysm clip to clamp the the spinal cord of the rat.There were three groups: BMSCs group,sham operation group and
control group.After SCI,the lesion of spinal cord was taken for HE,1.0×107cells labeled with PKH67 in 0.5 mL 0.9% sterile saline solution were transfused intravenously in BMSCs group and sham-operation group,the same volume of sterile saline solution were transfused in control group.The BBB scale was performed at 1 day,7 days,14 days,21 days after surgery for evaluating hind limbs movement.The migration and differentiation of BMSCs were determined by using triple immunofluorescent staining.Results (1)Syringomyelia after injury,necrosis and increased inflammatory cells could be seen under microscopy.(2)Immunofluoresence analysis were performed at 21 days post-transplantation and the transplanted BMSCs were centralized in the epicenter of injured spinal cord,part of BMSCs expressed by GFAP and Nestin.There were no PKH67+cells in sham operation group.The GFAP+and Nestin+cells in BMSCs group were significantly higher than other two groups (P<0.05),while there was no obviously difference between sham operation group and control group (P>0.05).(3)The BBB scores of BMSCs group and control group both improved,but the rats in BMSCs group improved rapidly than control group (P<0.05).Conclusion The bone marrow mesenchymal stem cells labeled with PKH67 could migrate to the lesion of spinal cord,proliferate and differentiate into neurocyte-like cells,which could promote the recovery of spinal cord’s function.
PKH67 Bone marrow mesenchymal stem cells Spinal cord injury Proliferation
于维汉院士杰出青年培养基金项目
150086 哈尔滨医科大学附属第二医院[马娇 张雪梅(通信作者) 孙杨 俞冰倩]
R744
A
1007-0478(2016)06-0432-06
10.3969/j.issn.1007-0478.2016.06.012

