沙鼠脑缺血再灌注损伤后Hsp22和c-fos的表达变化
卫杏利 胡治平
沙鼠脑缺血再灌注损伤后Hsp22和c-fos的表达变化
卫杏利 胡治平
目的 探讨沙鼠脑缺血再灌注损伤后脑组织中Hsp22和c-fos的表达变化及相应的保护机制。方法 健康雄性蒙古沙鼠制作脑缺血再灌注模型,缺血10 min,再灌注6 h、1、3、7 d。采用HE染色、免疫组织化学染色法观察脑组织的病理变化,Hsp22和c-fos的表达情况。结果 (1)HE染色:脑缺血再灌注组根据时间点的不同可见胶质细胞增生、肥大,细胞间质和细胞水肿,神经元坏死;(2)免疫组化:缺血再灌注损伤后Hsp22的表达上调,于第3 d达到高峰,与对照组比较有显著差异(p<0.05),第7 d开始下降但仍高于正常组和假手术组;c-fos在脑缺血再灌注后表达明显增高,于第1 d达到高峰,与对照组比较有显著差异(p<0.05),随后逐渐减少。结论 沙鼠脑缺血再灌注后脑组织Hsp22及c-fos表达上调,推测Hsp22可能通过抑制c-fos的活性而起到凋亡负性调节的作用。
脑缺血再灌注 Hsp22 c-fos 蒙古沙鼠
热休克蛋白(Heat Shock Proteins,HSPs)是从细菌到哺乳动物中广泛存在一类热应急蛋白质。脑组织缺血再灌注后会出现热休克蛋白等基因表达的动态变化,进而发挥相应的功能。人类的Hsp22属于sHsp亚家族成员,关于Hsp22对缺血性心肌的保护作用已经有较多的报道,Hsp22对缺血后脑组织的保护机制还不清楚。c-fos基因是参与细胞最早功能活动的基因,被认为是研究中枢神经系统最有代表性的即刻早期基因[1]。c-fos过度表达与神经元凋亡有必然联系,且参与细胞凋亡过程,但其具体机制尚未完全明了。Hsp22在脑缺血组织中与c-fos的表达关系尚未见报道。
1 材料与方法
1.1 动物分组 健康雄性蒙古沙鼠30只,9月龄,体重(90±10)克,由浙江省医科院动物实验室提供。随机分为正常对照组、假手术组、脑缺血再灌注组。正常对照组,n=5,不予任何处理即断头处死沙鼠;假手术组,n=5,分离双侧颈总动脉,不予夹闭,处死;缺血再灌注组(I/R),n=20,分为I/R后6 h(I/R6h组)、1(I/R1d组)、3(I/R3d组)及7 d(I/R7d组)4组,每组n=5。
1.2 脑缺血再灌注动物模型的建立[2]将健康雄性蒙古沙鼠用3%戊巴比妥以30 mg/kg体重的剂量腹腔注射进行麻醉,固定沙鼠,消毒,颈正中切开皮肤1.5 cm,钝性分离皮下组织,分离暴露双侧颈总动脉,微血管夹夹闭双侧颈总动脉10 min后松夹再灌注恢复血流,最后缝合皮肤,消毒;并分别于再灌注6 h、1、3、7 d后断头处死沙鼠。
1.3 主要试剂 抗Hsp22兔多克隆抗体,抗c-fos兔多克隆抗体,SP免疫组织化学试剂盒及DAB显色试剂盒由北京中杉金桥生物技术有限公司提供。
1.4 病理变化的观察 采用相邻切片作常规HE染色,用光学显微镜观察脑组织的病理变化,估计缺血再灌注后不同时间的脑损伤程度。
1.5 免疫组织化学染色 具体步骤:常规应用二甲苯脱蜡,梯度酒精脱蜡至水;以3%H2O2灭活内源性过氧化物酶,微波修复抗原,血清封闭,滴加一抗[Hsp22兔抗鼠多克隆抗体IgG(1∶200);c-fos兔抗鼠多克隆抗体IgG(1∶100)],4 ℃湿盒过夜,次日PBS洗涤,再滴加生物素化抗兔IgG(二抗),PBS洗涤,棕色DAB显色,苏木素复染,酒精脱水,二甲苯透明,中性树脂封片。免疫组化对照用随试剂提供的阳性对照片作阳性对照,阴性对照采用替代法,用PBS代替一抗,其余步骤与上述操作相同。取各组沙鼠切面水平相似的连续脑组织切片,所有切片分析均在同一强度、同一放大倍数下进行,每个指标采用阳性细胞计数法。在40×10倍的光镜视野下观察免疫反应,以细胞浆着棕褐色为阳性,每张切片随机选取前脑皮层区域8个不重叠400倍视野分别对切片的Hsp22、c-fos免疫阳性细胞进行计数,取均数作为各时间点该指标的阳性细胞数。
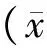
2 结 果
2.1 病理观察 正常对照组和假手术组脑组织形态结构没有明显的变化,随着缺血再灌注的时间延长,可见胶质细胞增生明显, 神经元坏死程度加重。
2.2 免疫组化染色 Hsp22在大脑皮质的神经元和胶质细胞中均有表达,阳性反应为细胞浆出现棕褐色细颗粒。Hsp22在正常对照组及假手术组脑组织神经细胞中呈弱阳性表达,2组之间没有显著性差异(p>0.05)。I/R6h组可见Hsp22表达开始明显升高,I/R3 d达高峰,I/R7 d表达减少(表1)。

表1 各组Hsp22和c-fos表达水平比较,阳性细胞数/每400倍视野)
注:表示与假手术组、正常对照组比较,*P<0.05;与C6 h组比较,ΔP<0.05;与C1 d组比较,▲P<0.05;与C3 d组比较,#P<0.05
c-fos在大脑皮质的神经元及胶质细胞中表达,以胞核表达为主,部分可见胞核、胞浆均有表达或胞浆表达。c-fos在正常对照组及假手术组脑组织神经细胞中呈极弱阳性表达,偶可见阳性细胞。I/R6 h组c-fos的表达开始增加,I/R1 d达高峰,I/R3 d,I/R7 d表达逐渐减少(表1)。
Hsp22和c-fos在各组沙鼠前脑神经元和神经胶质细胞内均有表达,随着Hsp22的表达逐渐达到高峰,相应的出现c-fos表达迅速下调(图1~3)。
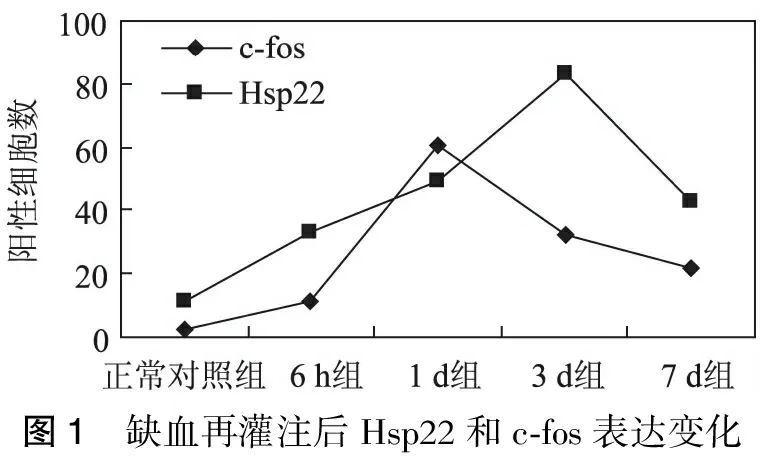
图1 缺血再灌注后Hsp22和c⁃fos表达变化

图2 Hsp22的免疫组化表达水平

图3 c⁃fos的免疫组化表达水平
3 讨 论
热休克蛋白是组织受应激后表达的一类蛋白,它的表达可以增强机体对有害应激的耐受能力。根据分子量、结构、性质特点可以分为Hsp100,Hsp90,Hsp70,Hsp60和小热休克蛋白(sHsp)。人类的Hsp22是一种分子量是21.6KDa小热休克蛋白也被称作HspB8、H11激酶和E2IG1,由位于12q24.23的基因编码,属于sHsp亚家族成员,以单体的形式存在[3]。Hsp22蛋白广泛存在于哺乳动物的很多组织中,在肌肉、胎盘、心脏和脑组织中高度表达。Hsp22具有丝/苏氨酸激酶活性,是一种磷蛋白。在体外Hsp22主要被蛋白激酶C和P44MAPK磷酸化。Hsp22不仅有分子伴侣的作用还有激酶活性、促凋亡或抗凋亡的作用[4],在延长生物体的寿命、抗缺血再灌注损伤[5]、肿瘤和神经系统疾病等很多方面发挥着重要作用。
本实验采用沙鼠前脑缺血再灌注模型,发现在I/R6h 和I/R1dHsp22的表达开始迅速增加,I/R3d Hsp22表达增加达到高峰,I/R7dHsp22表达减少。I/R6h到I/R3d Hsp22表达逐渐上调达到高峰,随后下调,而病理结果显示I/R6h到I/R7d脑组织损伤逐渐加重,可能的原因是在缺血再灌注应激下机体产生大量应激因子,上调了HSF的表达从而诱导了Hsp22表达增高。I/R3d后,机体对缺血性刺激可能逐渐适应,应激因子减少,因而导致Hsp22表达下调。在缺血再灌注应激下,细胞基因水平的反应性上调,使Hsp22的表达增强,从而发挥分子伴侣的作用和激酶的作用。Hsp22对缺血再灌注后的脑组织起到保护作用的机制可能有(1)Hsp22通过分子伴侣作用可以发现错误折叠的蛋白质,并通过重新折叠或者降解的作用防止变异蛋白聚集,维持线粒体结构和功能的完整性[6];(2)稳定细胞骨架,保证细胞膜的完整性。Hsp22可以保护肌动蛋白的稳定,增加微管的完整,避免中间丝的异常聚合。研究发现当Hsp22变异时会使轴突骨架破坏和轴突运输功能发生障碍[7];(3)抑制细胞凋亡,挽救受损的神经细胞。
在原癌基因家族中有一类能被第二信使所诱导的原癌基因,被称为“即刻早期基因” (immediately earlygenes,IEGs),又称快速反应基因。IEGs 家族中具有代表性且研究较为深入的主要是 c-fos 和 c-jun 家族,其中以 c-fos 转录、激活最快,活性最高。正常情况下 c-fos在神经元中仅是低水平的表达,而在脑缺血、缺氧等病理情况下却被快速地诱导高表达[8],其产物Fos蛋白由胞质转入核内,与c-jun 基因的产物Jun蛋白形成Fos-Jun异源二聚体,作用于DNA的特殊序列,调节相关基因转录,发挥第三信使的作用,进而干预细胞核的修复,导致细胞凋亡[9]。c-fos 表达产物(c-fos mRNA 和c-fos 蛋白)常作为细胞对缺血反应的敏感标志物,近年来其与脑外伤、癫痫、脑血管病等神经系统疾病的关系研究越来越多。Zheng 等[10]运用弥漫性脑损伤模型观察c-fos表达的变化,结果显示脑损伤后c-fos表达即开始增加,随后降低但与对照组比较仍维持在较高水平,说明 c-fos表达在脑损伤后随时间发生变化。毛晓霞等[11]以四血管阻断法建立全脑缺血再灌注损伤模型,发现药物干预降低c-fos与c-jun表达后凋亡神经细胞明显减少。这些研究提示脑损伤后抑制c-fos基因的高表达有利于减少脑卒中后神经元的凋亡。
本实验用沙鼠前脑脑缺血再灌注模型,发现I/R6h c-fos的表达开始少量增加,I/R1d c-fos表达迅速增强,并且达到高峰, I/R3d和I/R7d c-fos表达逐渐下降。结合病理HE染色,缺血再灌注6h是脑缺血病变的超急性期,这时脑组织变化不明显,脑损伤程度较轻,I/R1d脑组织轻度水肿,脑损伤程度加重,I/R3d和I/R7d脑组织损伤进一步加重。这与神经元凋亡表达时间基本一致,因此c-fos表达变化的时间和脑损伤变化的时间也保持一致,提示c-fos参与了缺血后神经元的损伤过程,推测脑缺血再灌注后c-fos介导了神经细胞的凋亡。脑缺血再灌注后c-fos表达上调的可能机制是①兴奋性氨基酸(excita-tive amino acid,EAA)所激发的[12];②脑缺血再灌注时细胞内Ca2+超载(Ca2+-overload),可诱导c-fos表达[13];③脑缺血再灌注时产生的大量氧自由基的作用;④NO能诱导c-fos基因表达,引起细胞的凋亡。 脑缺血再灌注时缺血脑组织的NO含量明显升高,可达基线水平的100倍[14]。总之,脑缺血再灌注时兴奋性氨基酸、钙超载、自由基及NO的增多共同参与中枢神经系统中c-fos的表达过程,诱导细胞凋亡的发生。c-fos因脑缺血再灌注在中枢神经系统诱导转录后其编码产物Fos随即与同时被诱导转录、编码的c-jun核磷蛋白Jun结合形成AP-1复合物,后者有可能再通过作用并影响靶基因的转录而参与脑缺血再灌注后的继发性损害,从而促进神经细胞凋亡[15]。也就是说,c-fos是把短时外界伤害性刺激信号转变为长时程病理变化的关键性调控因素。缺血再灌注3 d和7 d c-fos表达逐渐下降,结合病理,此刻脑组织损伤却逐步加重。本研究推测可能原因是机体在接受缺血再灌注等应激后启动的自身保护性机制在逐渐加强,一些保护性因子在一定程度上抑制了c-fos的活化,抑制了c-fos基因的表达,从而抑制c-fos介导的凋亡。
目前国内外还没有关于Hsp22和c-fos在脑缺血再灌注模型中的表达关系及其作用机制的报道。本研究采用沙鼠前脑缺血再灌注模型,在相同条件下同步检测Hsp22、c-fos的表达变化,在I/R1d后随着Hsp22的缓慢上调,c-fos开始迅速下调,提示可能由于Hsp22的脑保护作用抑制了c-fos的活性,从而抑制神经细胞的凋亡,挽救受损的神经细胞,可能的机制是:一方面,Hsp22通过抑制Ca2 +外流,减少氧自由基的生成等,抑制c-fos基因的表达,减少神经元损伤;另一方面,Hsp22的激酶作用可以激活相关的信号传导通路[16],使抗调亡蛋白Bcl-2稳定、Bag-1上调,进而抑制c-fos 基因的表达。总之,c-fos作为第三信使进一步诱导相关保护基因如Hsp22等的转录表达,随着Hsp22的表达增多,抑制c-fos 基因的表达,阻止细胞开始自杀途径,最终达到对缺血再灌注脑组织的保护作用。
脑缺血-再灌注损伤的病理机制非常复杂, 涉及兴奋性氨基酸毒性、细胞内钙负荷超载、自由基损伤、炎症反应及局部免疫反应等许多方面, 其中脑缺血后脑组织局部神经细胞过度凋亡是造成再灌注损伤的主要原因之一。Hsp22和c-fos的相互作用机制还需要进一步研究。
[1] Funahashi M,He YF,Sugimoto T,et al.Noxious tooth pulp stimulation suppresses c-fos expression in the rat hippocampal formation[J].Brain Res,1999,827(1/2):215-220.
[2] Carmichael ST.Rodent models of focal stroke: size, mechanism, and purpose[J].NeuroRx,2005,2(3):396-409.
[3] Kim MV,Seit-Nebi AS,Marston SB,et al.Some properties of human small heat shock protein Hsp22(H11 or HspB8) [J].Biochem Biophys Res Commun,2004,315(4):796 801.
[4] Sui X,Li D,Qiu H,et al.Activation of the bone morphogenetic protein receptor by H11kinase/Hsp22 promotes cardiac cell growth and survival[J].Circ Res,2009,104(7):887-895.
[5] Hollander JM,Martin JL,Belke DD,et al.Overexpression of wild-type heat shock protein 27 and a nonphosphorylatable heat shock protein 27 mutant protects against ischemia/reperfusion injury in a transgenic mouse model[J].Circulation,2004,110(23):3544-3552.
[6] Fontaine JM,Sun X,Benndorf R,et al.Interactions of HSP22 (HSPB8) with HSP20, alphaB-crystallin, and HSPB3[J].Biochem Biophys Res Commun,2005,337(3):1006-1011.
[7] Carra S,Sivilotti M,Chvez Zobel AT,et al.HspB8, a small heat shock protein mutated in human neuromuscular disorders, has in vivo chaperone activity in cultured cells[J].Hum Mol Genet,2005,14(12):1659-1669.
[8] Rau SW,Dubal DB,B ttner M,et al.Estradiol differentially regulates c-Fos after focal cerebral ischemia[J].J Neurosci,2003,23(33):10487-10494.
[9] Schäbitz WR,Schade H,Heiland S,et al.Neuroprotection by hyperbaric oxygenation after experimental focal cerebral ischemia monitored by MRI[J].Stroke,2004,35(5):1175-1179.
[10]Zheng W,Niu L,Zhang C,et al.Brain edema and protein expression of c-Fos and c-Jun in the brain after diffused brain injury[J].Int J Clin Exp Pathol,2014,7(6):2809-2817.
[11]毛晓霞,夏爱华,吴晓光,等.山楂叶总黄酮对脑缺血再灌注损伤大鼠神经元凋亡和c-fos,c-jun表达的影响[J].中国实验方剂学杂志,2015,21(2):174-177.
[12]韩济生.北京[M].北京:中国青年出版社,2011:273.
[13]Takei N,Endo Y.Ca ionophore-induced apoptosis on cultured embryonic rat cortical neurons[Z],1994:65.
[14]Malinski T,Bailey F,Zhang ZG,et al.Nitric oxide measured by a porphyrinic microsensor in rat brain after transient middle cerebral artery occlusion[Z],1993:335.
[15]Whitfield J,Neame SJ,Paquet L,et al.Dominant-negative c-Jun promotes neuronal survival by reducing BIM expression and inhibiting mitochondrial cytochrome c release[J].Neuron,2001,29(3):629-643.
[16]Smith CC,Yu YX,Kulka M,et al.A novel human gene similar to the protein kinase[Z],2000.
(2016-04-15收稿 2016-05-13修回)
046000 山西省长治医学院附属和平医院老年病科(卫杏利);中南大学湘雅二医院神经内科(胡治平)
R743
A
1007-0478(2016)06-0449-04
10.3969/j.issn.1007-0478.2016.06.016

