一株纤维素酶高产菌的筛选、鉴定与产酶研究
田 云,曹林友,周 赓,邓成刚,陈 帅,卢向阳,周海燕
(1.湖南省农业生物工程研究所,湖南 长沙 410128;2.湖南农业大学东方科技学院,湖南 长沙 410128;3.湖南农业大学生物科学技术学院,湖南 长沙 410128)
一株纤维素酶高产菌的筛选、鉴定与产酶研究
田云1,3,曹林友1,2,3,周赓1,3,邓成刚1,2,3,陈帅1,2,3,卢向阳1,3,周海燕3
(1.湖南省农业生物工程研究所,湖南 长沙 410128;2.湖南农业大学东方科技学院,湖南 长沙 410128;3.湖南农业大学生物科学技术学院,湖南 长沙 410128)
摘要:从蘑菇培养基质中筛选到一株纤维素酶高产菌株,将其命名为SAISA10,经形态学及分子生物学鉴定,确认该菌为真菌Hypocreales sp.。发酵产酶条件分析结果表明,该菌株最佳发酵条件为:发酵时间3 d、发酵温度40 ℃、pH值4.0、m(羧甲基纤维素钠)∶m(麸皮)=1∶1(g∶g)、(NH4)2SO4含量0.8 g·(100 mL)-1。酶学性质初步研究结果表明,该菌株所产纤维素酶的最适酶解条件为:温度45~55 ℃、pH 值4.0;最佳稳定条件为:温度40 ℃、pH值4.5。菌株SAISA10是一株高产纤维素酶的真菌,在高温和低pH值下仍有高活性和稳定性,具有较高的开发价值。
关键词:纤维素酶;真菌;筛选;鉴定;产酶条件;Hypocreales sp.
随着社会发展和经济水平的不断提高,能源危机、资源短缺等问题日益突出。目前第一代化石燃料仍占能源消耗的85%以上[1-2],其造成的污染使人类的居住环境变得恶劣。为了既满足人类对能源的需求、实现可持续发展,又能最大程度地降低能源物质开发和使用造成的环境污染,寻找并开发资源丰富、可再生、绿色环保、廉价适用的新能源物质,成为近年的研究热点[3-6]。
纤维素资源十分丰富,主要存在于植物细胞壁中[7],其植物碳素比例超过50%,藻类、被囊动物以及一些细菌也能合成纤维素[8]。纤维素是由D-吡喃式葡萄糖基通过β-1,4糖苷键连接而成的线性不分支的同聚多糖。天然的纤维素由排列整齐且规则的结晶区和相对不规则、松散的无定形区组成,其结晶度一般在30%~80%之间[9]。纤维素降解成小分子物质后,可以转化为具有广阔应用前景的能源物质[10]。由于纤维素本身的致密结构使得其分子结构十分稳定,通常采用酶法对其进行降解。
纤维素酶是一种多组复合酶系,相对分子量为45~75kDa,由3种相互起协同作用的酶组合而成[11],这3种酶分别为内切葡聚糖酶(1,4-β-D-glucanglucanohydrolase,EC3.2.1.4)、外切葡聚糖酶(1,4-β-D-glucancellobilhydrolase,EC3.2.1.91)、葡萄糖苷酶(β-1,4-glucosidase,EC3.2.1.21)[12-13]。纤维素酶广泛存在于微生物、原生动物和植物中,甚至一些昆虫和动物也能产生纤维素酶[14]。自1912年Kellerma等首次从土壤中筛选出一株纤维素降解菌以来,各种降解纤维素的菌种陆续被发现[15]。已报道的对纤维素降解作用较强的菌株多是木霉属(Trichoderma)、曲霉属(Aspergillus)、青霉属(Penicillium)、枝顶孢霉属(Acremonium)、漆斑霉属(Myrothecium)、脉孢霉属(Neurospora)、毛壳霉属(Chaetomium)等的菌株[16-20]。最近几年对纤维素酶研究的热衷使得有关纤维素酶高产菌种的筛选有不少报道,如:吴文韬等[21]从蚯蚓养殖场中分离出一株高效纤维素降解菌株NH11,其对稻草具有较高的降解效率;刘韫滔等[22]从用于堆肥的水稻秸秆中筛选到斜卧青霉;Kaur等[23]筛选到一株可产较高活力的耐热、中性纤维素酶嗜热菌Melanocarpussp.。作者从蘑菇培养基质中筛选出一株纤维素酶高产菌株,对其进行了鉴定,并分析了其产酶条件及酶学性质。
1实验
1.1菌株的筛选与鉴定
蘑菇培养基质配制成5mL悬浮液进行菌落富集。将稀释的菌液样品涂布到加有1%羧甲基纤维素钠(CMC-Na)的PDA培养基上,28 ℃培养3d,长成的菌落用刚果红染色,观察培养基上的水解圈,选择水解圈直径(D)与菌落直径(d)比值较大的菌株,采用DNS法测定其酶活,根据酶活大小进行复筛。
观察筛选菌株的菌丝、菌落颜色、表面、边缘、孢子形态和菌落质地等,同时对菌株进行分子生物学鉴定,按试剂盒说明进行基因组提取,根据真菌ITSDNA基因的序列特征,以菌株总DNA为模板,ITS5和ITS4为引物,扩增真菌的ITS基因片段。基因产物转化至DH5α感受态细胞,在含有Amp+的LB平板培养基上进行抗性筛选,其中阳性克隆菌采用通用引物M13F与M13R进行PCR扩增,将扩增检测中具有564bp条带的菌株送至华大基因公司测序。
1.2产酶条件优化
纤维素酶高产菌的产酶初始条件为:接种量5%、发酵时间3d、发酵温度28 ℃、pH值5.0、CMC-Na和麸皮的含量均为1g·(100mL)-1、(NH4)2SO4含量0.4g·(100mL)-1。产酶优化研究中分别考察发酵时间(1d、2d、3d、4d、5d、6d、7d)、发酵温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)、pH值(3、4、5、6、7)、CMC-Na和麸皮的质量比(0∶1.0、0.25∶0.75、0.5∶0.5、0.75∶0.25、1.0∶0,g∶g)、(NH4)2SO4含量[0、0.4、0.8、1.2、1.4,g·(100mL)-1]对产酶的影响。
1.3酶学性质研究
菌株在优化后的条件下培养,培养物于4 ℃、5 000 r·min-1离心10 min,收集上清液即得到粗酶液。
内切葡聚糖酶(Cx)酶活的测定:以CMC-Na为底物进行反应测定酶活。取1.5 mL 0.05 mol·L-1醋酸缓冲液(含0.5%的CMC-Na)于50 ℃水浴预热后加入0.5 mL粗酶液,保温30 min,立即取出并加入1.5 mL DNS试剂以终止酶反应,沸水浴5 min,取出后加水定容至25 mL,测定540 nm处吸光度。
滤纸酶(FPA)酶活的测定:以去淀粉的滤纸为底物进行反应测定酶活。往1.5 mL 0.05 mol·L-1醋酸缓冲液中加入0.5 mL粗酶液,50 ℃预热后加入50 mg新华定量滤纸,保温1 h后取出并加入1.5 mL DNS试剂以终止酶反应,沸水浴5 min,取出后加水定容至25 mL,测定540 nm处吸光度。
酶活单位定义:以每分钟生成1 μg葡萄糖所需的酶量定义为一个酶活单位(U)。酶活(U·mL-1)按下式计算:

式中:m为葡萄糖质量,mg;n为粗酶液稀释倍数;t为反应时间,min;V为反应液中酶液加入量,mL。
在酶解温度分别为25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃及pH值分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5的条件下考察菌株SAISA10所产纤维素酶的最适酶解条件。
另外,分别在35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃条件下将酶反应体系保温2 h,测定不同温度下粗酶液的酶活保存率;分别在pH值为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5的缓冲液中,在最适温度下将酶反应体系保温12 h,测定不同pH值中粗酶液的酶活保存率。筛选菌株SAISA10所产纤维素酶的最佳稳定条件。
2结果与讨论
2.1纤维素酶高产菌的筛选
从蘑菇培养基质中分离出637株真菌菌株,初步筛选出6株水解圈较为显著的菌株,其水解圈直径(D)与菌落直径(d)的比值(D/d)见表1。
表16株水解圈显著菌株的D/d值
Tab.1D/dValue of six strains with significant hydrolytic zone

菌株编号A10C5F1G3G11H9D/d1.58±0.0351.37±0.0871.37±0.0421.44±0.0211.27±0.0311.48±0.221
由表1可知,菌株A10、G3、H9降解纤维素的效果较好,对菌株A10、G3、H9进行Cx酶活及FPA酶活测定(表2)。结果发现,菌株A10所产2种酶的酶活均高于菌株G3和H9,将其命名为SAISA10。
2.2纤维素酶高产菌的鉴定
菌株SAISA10的菌落生长较快,呈扁平圆形,肉色,表面有少量黏液,边缘分布细柔的菌丝(图1a),菌株分生孢子光滑透明,孢子梗稀缺,产孢细胞直接着生于菌丝细胞上,大量孢子聚集呈微弱红色(图1b、1c)。
表2筛选获得菌株所产纤维素酶的酶活/(U·mL-1)
Tab.2Activity of cellulase produced by the screened strains/(U·mL-1)
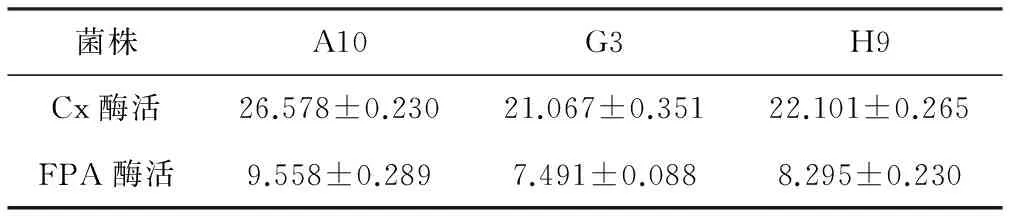
菌株A10G3H9Cx酶活26.578±0.23021.067±0.35122.101±0.265FPA酶活9.558±0.2897.491±0.0888.295±0.230
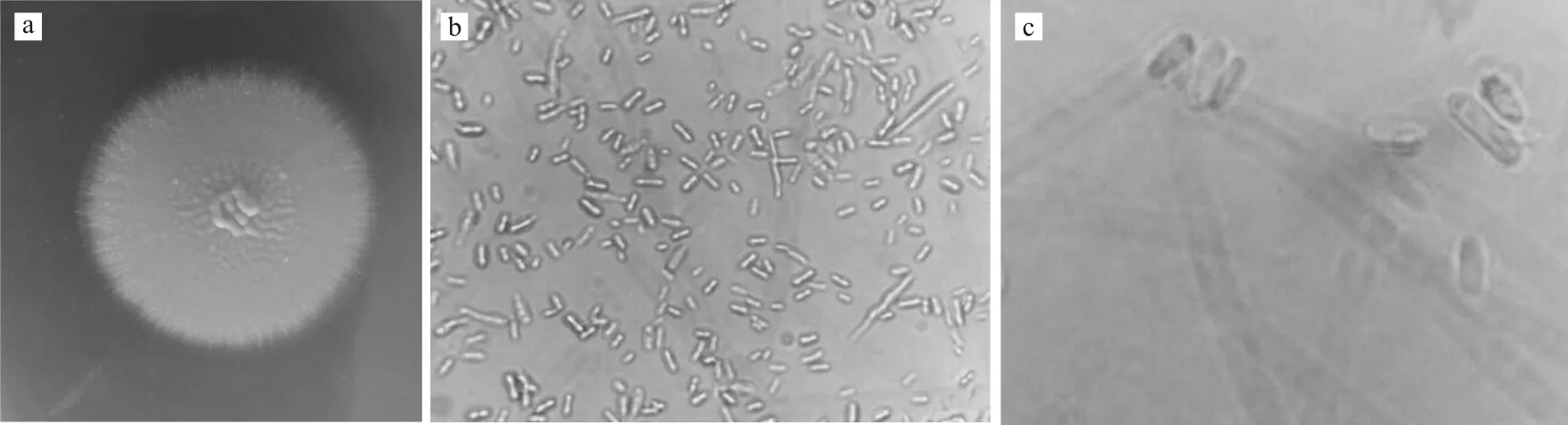
图1 菌株SAISA10的形态Fig.1 Morphology of strain SAISA10
菌株SAISA10的ITS序列全长为616 bp(图2),碱基序列如图3所示。
将菌株SAISA10的ITS序列进行BLAST比对,结合菌株的形态学分析,鉴定该菌为肉座菌目(Hypocrealessp.)。
2.3纤维素酶高产菌的产酶条件优化
2.3.1发酵时间对菌株产酶的影响(图4)

图2菌株SAISA10的电泳图谱
Fig.2Electrophorogram of strain SAISA10
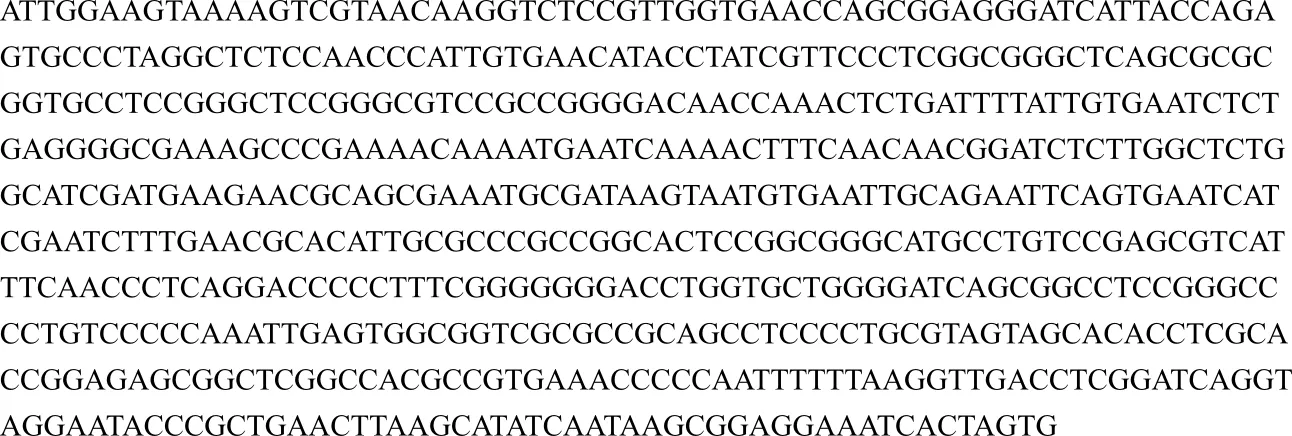
图3 菌株SAISA10的ITS序列分析Fig.3 ITS Sequence analysis of strain SAISA10
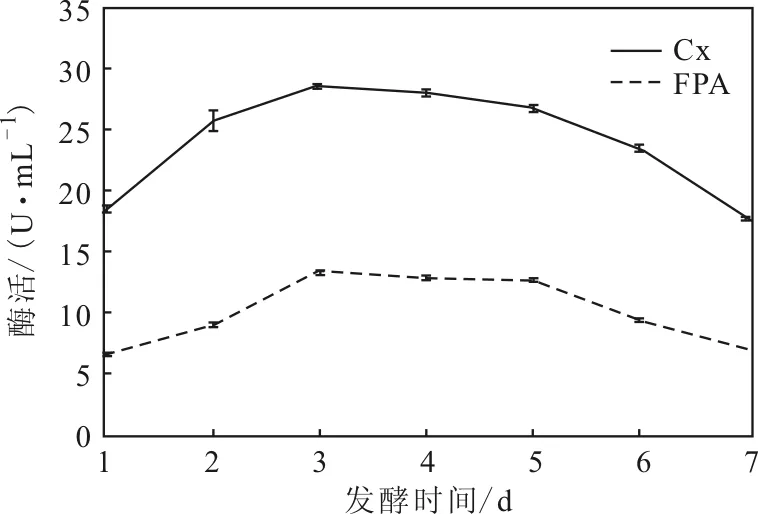
图4 发酵时间对菌株SAISA10产酶的影响Fig.4 Effect of fermentation time on enzyme-producing of strain SAISA10
由图4可知,发酵初期,Cx酶活及FPA酶活均呈上升趋势;第3 d后,酶活开始下降,菌体也开始出现自溶现象。因此,该菌株发酵时间以3 d较为适宜。
2.3.2发酵温度对菌株产酶的影响
温度对微生物生长发育及生理活动的影响非常显著,左右着微生物代谢与产物合成的方向。温度过低时,微生物生长发育缓慢,代谢活动受到抑制;温度过高时,不仅对微生物发酵和产酶产生不利影响,严重时还会导致微生物死亡。发酵温度对菌株SAISA10产酶的影响如图5所示。
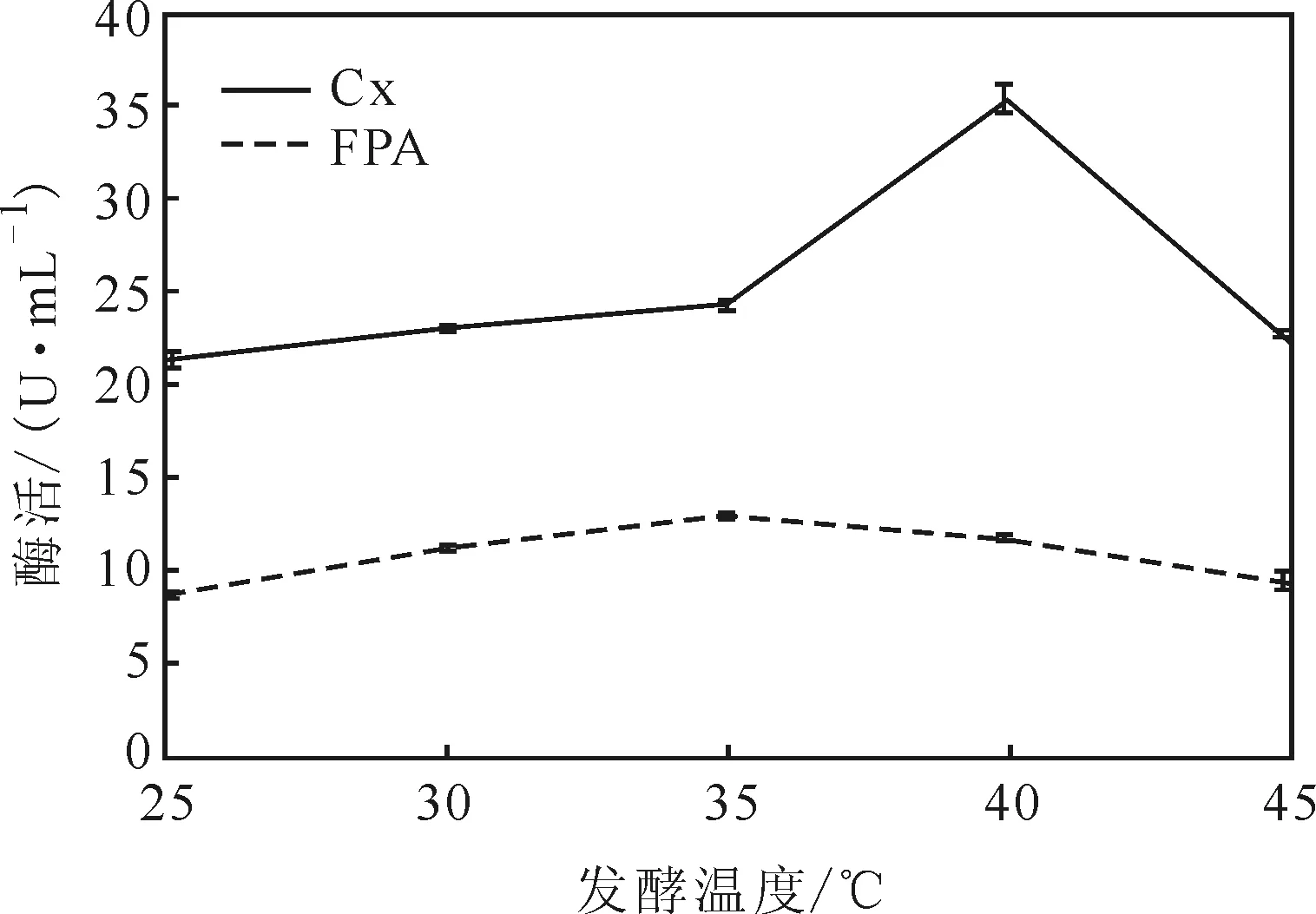
图5 发酵温度对菌株SAISA10产酶的影响Fig.5 Effect of fermentation temperature on enzyme-producing of strain SAISA10
由图5可知,菌株SAISA10的FPA酶活随发酵温度的升高出现先上升后下降的趋势,但变化不大;而Cx酶活在35 ℃以下时受到抑制,酶活偏低,40 ℃时酶活达到最高,发酵温度超过40 ℃后,酶活迅速下降。因此,该菌株发酵温度以40 ℃较为适宜。
2.3.3pH值对菌株产酶的影响
pH值对微生物的生长发育有着显著影响。最适pH值条件下的微生物生长代谢旺盛、增殖迅速,有利于菌株的发酵产酶;高于或低于最适pH值时,都可能严重影响微生物的生长发育,甚至造成微生物死亡。pH值对菌株SAISA10产酶的影响如图6所示。
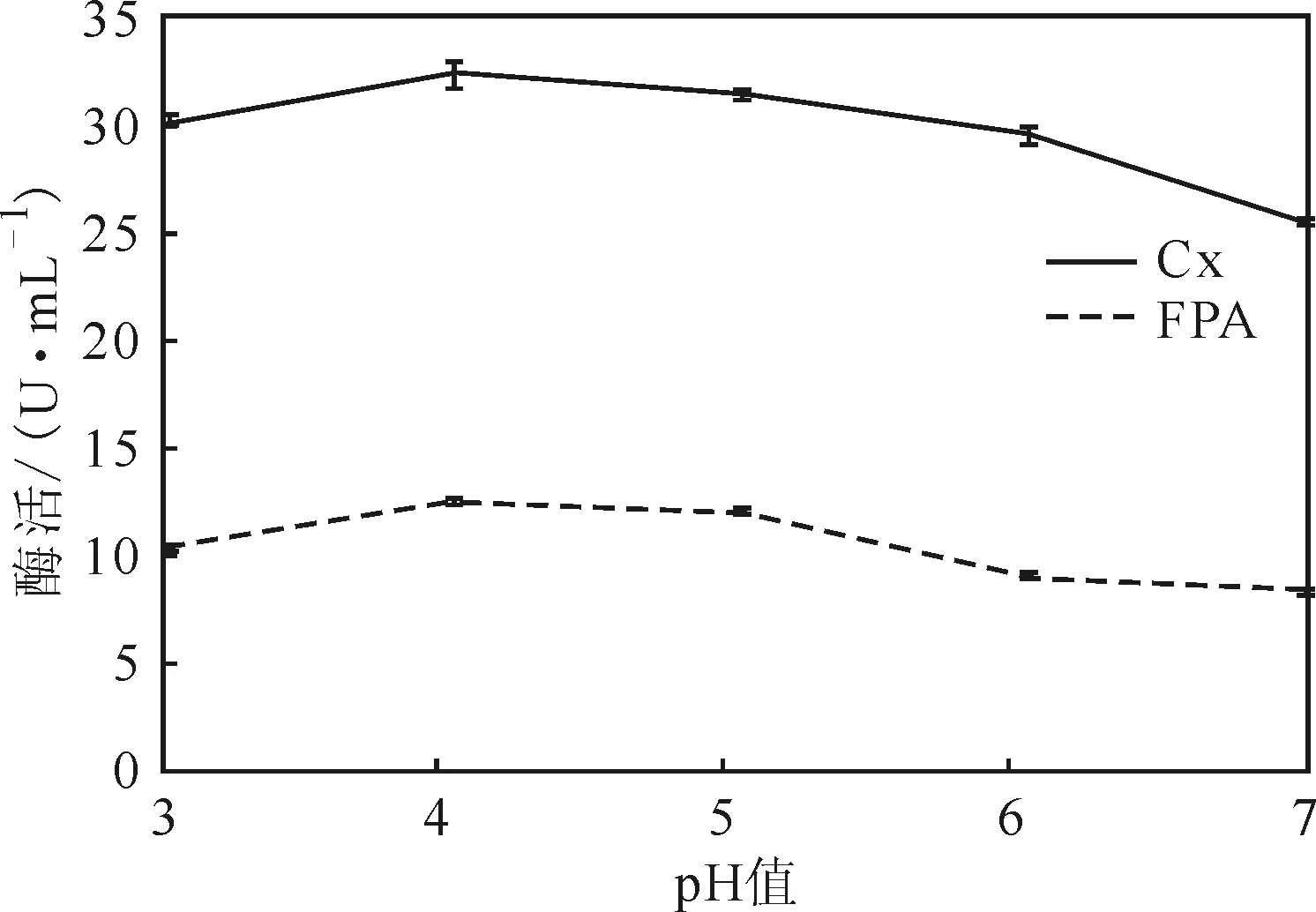
图6 pH值对菌株SAISA10产酶的影响Fig.6 Effect of pH value on enzyme-producing of strain SAISA10
由图6可知,当pH值为4时,菌株SAISA10所产2种酶的酶活最高,表明该菌株所产纤维素酶为嗜酸性酶。
2.3.4碳源和氮源对菌株产酶的影响
碳源和氮源是微生物生长及代谢所必需的核苷酸、维生素、矿物质元素等重要营养成分的合成原料,对微生物的生长代谢有着至关重要的作用。在菌株SAISA10的培养过程中,以CMC-Na作为碳源对于菌体来说较易吸收,但其含量的增加会使发酵液变得黏稠,导致通气量降低;以麸皮作为碳源对于菌体而言较难利用,但麸皮能够使发酵培养基变得松散,从而影响菌体发酵产酶。本实验将CMC-Na和麸皮同时作为菌株SAISA10的培养碳源,并考察了2种碳源的比例对菌株产酶的影响(图7a),结果表明,当CMC-Na与麸皮的含量都为0.5 g·(100 mL)-1,即二者质量比为1∶1时,菌株SAISA10发酵产酶达到最佳,酶活达到最高。
无机氮源(NH4)2SO4对菌株产酶的影响如图7b所示。当培养基中(NH4)2SO4含量低于0.8 g·(100 mL)-1时,培养基中氮源不足,从而影响营养成分的合成,使发酵产酶过程不够充分;但当(NH4)2SO4含量高于0.8 g·(100 mL)-1时,氮源过剩,对菌株的发酵产酶反而有抑制作用。

图7 碳源(a)、氮源(b)对菌株SAISA10产酶的影响Fig.7 Effects of carbon source(a) and nitrogen source(b) on enzyme-producing of strain SAISA10
2.4菌株SAISA10所产纤维素酶的酶学性质
2.4.1最适酶解温度
酶作为生物催化剂都有其最适的酶解温度。分别在不同温度下加入粗酶液进行酶解反应,考察酶解温度对酶解效率的影响,结果见图8。

图8 酶解温度对酶解效率的影响Fig.8 Effect of enzymatic hydrolysis temperature on enzymatic hydrolysis efficiency
由图8可以看出,菌株SAISA10所产纤维素酶在温度为45~55 ℃时,酶活最高,酶解效率较高。
2.4.2最适酶解pH值
分别向pH值为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5的缓冲液配制的底物溶液中加入粗酶液进行酶解反应,考察pH值对酶解效率的影响,结果见图9。
由图9可看出,菌株SAISA10所产纤维素酶在pH值为4.0时,酶活最高,酶解效率最高,表明该纤维素酶具有嗜酸特性。
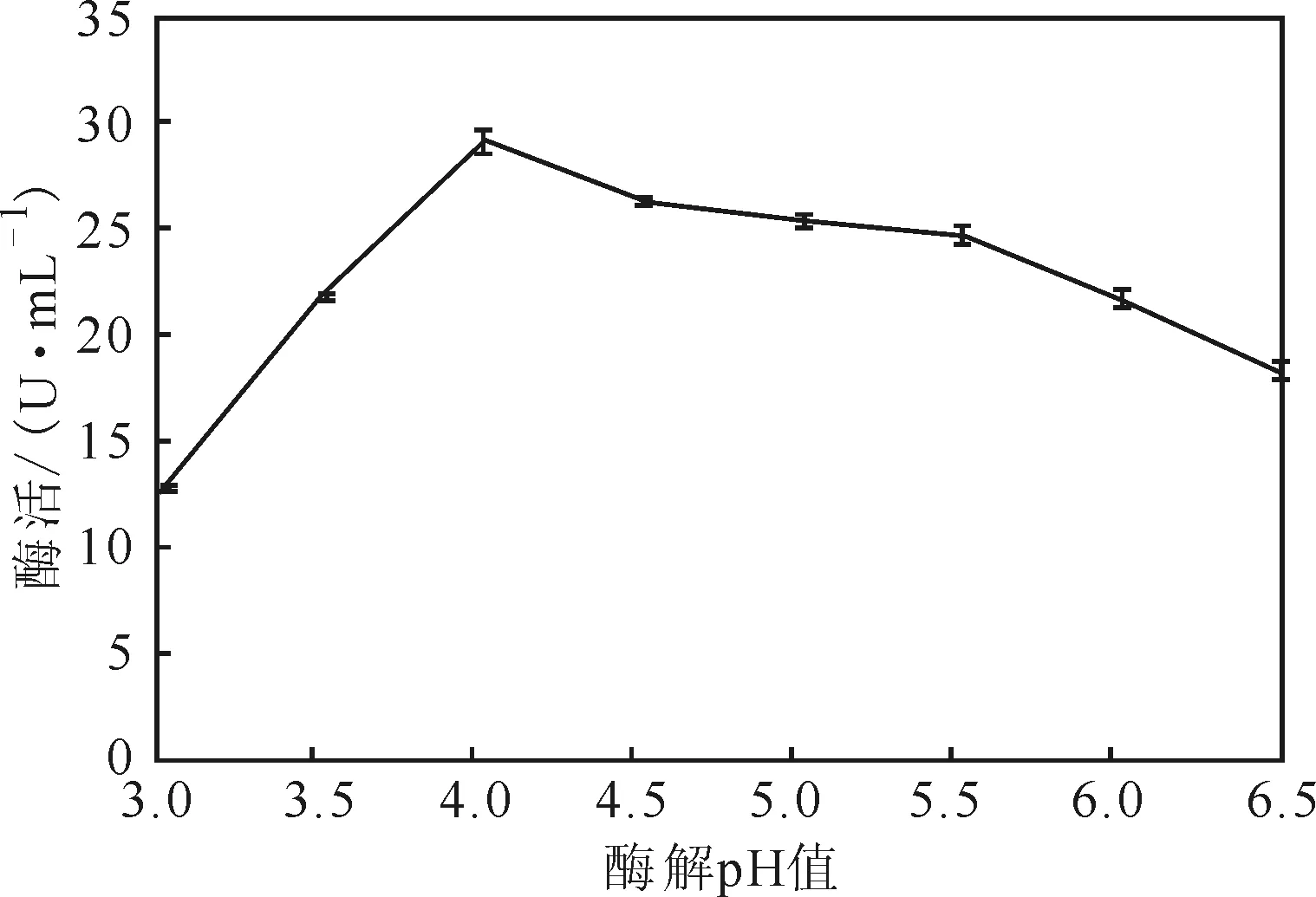
图9 酶解pH值对酶解效率的影响Fig.9 Effect of pH value on enzymatic hydrolysis efficiency
2.4.3 酶稳定性
为了考察菌株SAISA10所产纤维素酶的稳定性,从SAISA10培养液中进行粗酶提取,并将粗酶液分别在35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃,pH值为4.0的条件下保温2 h,测定纤维素酶活力残留率;另外,将粗酶液保存在40 ℃,pH值分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5的磷酸缓冲液中12 h后测定纤维素酶活力残留率,结果见图10。
图10a显示粗酶中纤维素酶活力在40 ℃下保温2 h后酶活力残留率最高,达90%。图10b显示粗酶液的纤维素酶活力在pH值为4.5的磷酸缓冲液中酶活力残留率最高,约为70%。
3结论
对蘑菇培养基质产纤维素酶菌株进行了筛选、鉴定、产酶条件优化及酶学性质的初步研究,分离出纤维素酶高产菌株SAISA10,并通过形态学及分子生物学鉴定,确认该菌株为Hypocrealessp.,其发酵产酶的最佳条件为:发酵时间3 d、发酵温度40 ℃、pH值4.0、羧甲基纤维素钠与麸皮的比例为1∶1(g∶g)、氮源含量为0.8 g·(100 mL)-1。菌株所产纤维素酶的最适酶解条件为:温度45~55 ℃、 pH值4.0;最佳稳定条件为:温度40 ℃、pH值4.5。

图10 温度(a)和pH值(b)对粗酶活力稳定性的影响Fig.10 Effects of temperature (a)and pH value(b)on the crude enzyme stability
筛选获得的纤维素酶具有较好的耐热性和稳定性,产酶活力很高,该酶是一种嗜酸酶,非常适合产业化应用。
参考文献:
[1]AGARWAL A K.Biofuels (alcohols and biodiesel) applications as fuels for internal combustion engines[J].Progress in Energy and Combustion Science,2007,33:233-271.
[2]ESCOBAR J C,LORA E S,VENTURINI O J,et al.Biofuels:environment,technology and food security[J].Renewable and Sustainable Energy Reviews,2009,13(6/7):1275-1287.
[3]SINGH A,PANT D,KORRES N E,et al.Key issues in life cycle assessment of ethanol production from lignocellulosic biomass:challenges and perspectives[J].Bioresource Technology,2010,101(13):5003-5012.
[4]PRASAD S,SINGH A,JAIN N,et al.Ethanol production from sweet sorghum syrup for utilization as automotive fuel in India[J].Energy & Fuels,2007,21(2):2415-2420.
[5]SINGH A,SMYTH B M,MURPHY J D.A biofuel strategy for Ireland with an emphasis on production of biomethane and minimization of land-take[J].Renewable and Sustainable Energy Reviews,2010,14(1):277-288.
[6]PRASAD S,SINGH A,JOSHI H C.Ethanol as an alternative fuel from agricultural,industrial and urbaurban residues[J].Resource,Conservation and Recycling,2007,50:1-39.
[7]陈洪章,李佐虎.纤维素原料微生物与生物量全利用[J].生物技术通报,2002,24(5):17-20.
[8]HENRIKSSON M,BERGLUND L A.Structure and properties of cellulose nanocomposite films containing melamine formaldehyde[J].Journal of Applied Polymer Science,2007,106(4):2817-2824.
[9]丘燕临.纤维素酶的研究和应用前景[J].粮食与饲料工业,2001(8):30-31.
[10]范艳丽.纤维素降解菌的筛选及特性研究[D].武汉:武汉科技大学,2004.
[11]高伦江,董全,唐春红.纤维素酶的研究进展及前景展望[J].江苏食品与发酵,2007(4):14-17.
[12]朱旭芬.现代微生物学实验技术[M].杭州:浙江大学出版社,2011:275-279.
[13]蒋建新.生物质化学分析技术[M].北京:化学工业出版社,2013:152-156.
[14]刘家建,陆怡.纤维素酶的研究及应用综述[J].林产化工通讯,1995(1):6-10.
[15]窦全林,陈刚.纤维素酶的研究进展与应用前景[J].畜牧与饲料科学,2006,27(5):58-60.
[16]刘娣.秸秆纤维素高效降解真菌的筛选、鉴定及其纤维素酶基因克隆[D].北京:中国农业科学院,2008.
[17]SAKON J,ADNEY W S,HIMMEL M E.Crystal structure of thermostable family 5 endoeellulase EI fromAeidothermuscellulolytieusin complex with cellotetraose[J].Biochemical Journal,1996,35(33):10648-10660.
[18]刘东波,高培基.纤维素诺卡氏菌的一个新菌株[J].微生物学报,1990,30(1):70-72.
[19]LI X.Streptomycescellulolyticussp.nov.,a new cellulolytic member of the genusStreptomyces[J].International Journal of Systematic and Evolutionary Microbiology,1997,47(2):443-445.
[20]朴哲,崔宗均,苏宝林,等.一组高效稳定纤维素分解菌复合系MCI的酶活特性[J].中国农业大学学报,2003,8(3):74-79.
[21]吴文韬,鞠美庭,刘金鹏,等.一株纤维素降解菌的分离、鉴定及对玉米秸秆的降解特性[J].微生物学通报,2013,40(4):712-719.
[22]刘韫滔,禤淑霞,龙传南,等.纤维素降解菌L-06的筛选、鉴定及其产酶条件的分析[J].生物工程学报,2008,24(6):1112-1116.
[23]KAUR J,CHADHA B S,SAINI H S.Regulation of cellulase production in two themophilic fungiMelanocarpussp.MTCC 3922 andScytalidiumthermophilumMTCC 4520[J].Enzyme and Microbial Technology,2006,38(7):931-936.
基金项目:国家自然科学基金青年科学基金资助项目(31401637),湖南省战略性新兴产业关键共性技术导向类项目(2015GK1017),湖南农业大学东方科技学院大学生研究性学习和创新性实验计划项目(DFCXY201308)
收稿日期:2016-03-02
作者简介:田云(1979-),男,湖南益阳人,教授,研究方向:生物化学与分子生物学;通讯作者:周海燕,副研究员,E-mail:284971991@qq.com。
doi:10.3969/j.issn.1672-5425.2016.07.008
中图分类号:Q 939.9
文献标识码:A
文章编号:1672-5425(2016)07-0034-06
Screening,Identification and Enzyme-Producing Study of A High Cellulase-producing Strain
TIAN Yun1,3,CAO Lin-you1,2,3,ZHOU Geng1,3,DENG Cheng-gang1,2,3,CHEN Shuai1,2,3,LU Xiang-yang1,3,ZHOU Hai-yan3
(1.HunanAgriculturalBioengineeringResearchInstitute,Changsha410128,China;2.CollegeofOrientScience&Technology,HunanAgriculturalUniversity,Changsha410128,China;3.CollegeofBioscienceandBiotechnology,HunanAgriculturalUniversity,Changsha410128,China)
Abstract:A high cellulase-producing strain was screened from the mushroom cultivation matrix,and named as SAISA10.It was identified as Hypocreales sp. by morphological observation and DNA sequence identification.Results showed that,the optimum fermentation conditions for strain SAISA10 were as follows:fermentation time of 3 d,fermentation temperature of 40 ℃,pH value of 4.0,the mass ratio of sodium carboxymethyl cellulose and bran of 1∶1(g∶g),(NH4)2SO4 content of 0.8 g·(100 mL)-1.The preliminary research results of enzymatic properties showed that,the optimum enzymatic hydrolysis conditions were as follows:temperature of 45~55 ℃,pH value of 4.0,and the optimum stable conditions were as follows:temperature of 40 ℃,pH value of 4.5.The strain SAISA10 is a high cellulase-producing strain with high activity and stability at high temperature or low pH value,which has high exploration potential.
Keywords:cellulase;fungus;screening;identification;fermentation condition;Hypocreales sp.
田云,曹林友,周赓,等.一株纤维素酶高产菌的筛选、鉴定与产酶研究[J].化学与生物工程,2016,33(7):34-39.

