草酸葑醇酯的合成及其表征
袁晓敏, 赵振东,2*, 徐士超,2, 卢言菊,2, 朱守记
(1. 中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042; 2. 中国林业科学研究院 林业新技术研究所,北京 100091)
草酸葑醇酯的合成及其表征
袁晓敏1, 赵振东1,2*, 徐士超1,2, 卢言菊1,2, 朱守记1
(1. 中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042; 2. 中国林业科学研究院 林业新技术研究所,北京 100091)
摘要:以α-葑醇和草酰氯为原料合成草酸葑醇酯,考察了反应条件对葑醇酯化反应的影响,确定了葑醇酯化反应的较佳条件:草酰氯与葑醇的物质的量之比为0.6∶1.0,反应温度为55 ℃,反应时间10 h,最佳条件下目标产物收率为93.9 %,重结晶后纯度可达99.9 %。采用GC-MS、IR、1H NMR、13C NMR等对合成的草酸葑醇酯进行了结构表征。
关键词:葑醇;草酰氯;草酸葑醇酯;表征
草酸葑醇酯,也叫乙二酸二葑醇酯,化学名称为1,2-二[1,3,3-三甲基二环[2.2.1]庚-2-醇]乙二酸酯,是合成冰片生产过程中的主要副产物中间体之一[1-4]。在科研和生产实践中,由于缺乏草酸葑醇酯的市场供应,对于评价松节油合成草酸冰片酯的反应、定性和定量测定中间体化学组成、优化合成反应工艺、提升合成冰片品质等重要工作难于进行。目前,有关草酸葑醇酯合成及应用方面的研究报道很少:MaGee等[5]在研究Grignard试剂与对称草酸酯反应合成手性的不对称α-酮酸酯时,用到并合成了草酸葑醇酯;Huckel等[6]在研究α/β-葑醇的对甲苯磺酸酯醇解反应时,为了得到光学纯的葑醇,合成并应用了α/β-葑醇的草酸酯,但都没有对草酸葑醇酯的结构及特性进行表征。与草酸葑醇酯类似的乙酸葑醇酯或草酸龙脑酯和草酸异龙脑酯的研究工作也不多:何春茂等[7]以葑醇与乙酸酐为原料在硫酸的催化下合成乙酸葑醇酯;张平辉等[8-11]在硼酐或偏钛酸的催化作用下将龙脑或异龙脑与草酸反应合成了草酸龙脑酯和草酸异龙脑酯。由于葑醇结构中的羟基比龙脑及异龙脑具有更大的空间位阻效应,不易与草酸直接酯化,本研究采用草酰氯作为间接酯化试剂合成草酸葑醇酯,并对其进行结构表征,以期作为标准物质或对照样品应用于工业合成冰片生产过程中对草酸酯中间体进行跟踪分析或检验,同时也为进一步探讨其在医药及香料方面的应用价值提供依据。
1实 验
1.1原料、试剂和仪器

WRS-1B数字熔点仪,上海申光仪器仪表有限公司;WZZ-2S自动旋光仪,上海申光仪器仪表有限公司;GC2014AF型气相色谱仪,日本岛津公司;Thermo Nicolte IS10红外光谱仪,美国Thermo公司;6890N型气相色谱仪及5973型质谱仪,美国Agilent公司;Bruker AV-500型核磁共振仪,德国Bruker公司;Flash 2000元素分析仪,美国Thermo公司。
1.2草酸葑醇酯的合成
采用α-葑醇为原料、以草酰氯为酯化剂的间接酯化反应方式合成草酸葑醇酯,见图1。

图 1 草酸葑醇酯合成示意图Fig. 1 Scheme for synthesis of fenchyl oxalate
在150 mL圆底烧瓶中加入0.05 molα-葑醇及30 g正己烷,搅拌至完全溶解,于一定温度下缓慢滴加一定量的草酰氯, 0.5 h内滴加完毕,反应一段时间后减压蒸馏除去部分草酰氯,浓缩液用正己烷溶解,依次用2 % 的碳酸钠溶液洗涤4~5次、稀盐水洗涤4~5次至中性,收集有机相并再次减压蒸馏除去溶剂,得到粗产品,用乙醇重结晶得到无色透明针状晶体。
1.3分析方法
1.3.1熔点的测定于WRS-1B数字熔点仪上测定,采用一端封口的标准毛细管(外径1.4 mm,内径1.0 mm),装样3 mm,初始温度106 ℃,线性升温速率1 ℃/min,测定5次取平均值。
1.3.2比旋光度的测定以无水乙醇作为空白对照,将样品用无水乙醇溶解,配制成0.1 mol/L的乙醇溶液,测定6次取平均值。
1.3.3GC分析采用气相色谱仪,FID检测器,Rtx-5型毛细管色谱柱(长度30 m, 内径0.25 mm,膜厚0.25 μm),进样量1 μL,载气N2,检测器温度及进样器温度280 ℃,试样溶解于正己烷,用面积归一化法计算草酸葑醇酯产率,采用程序升温方法进行组分的分离,即70 ℃保持2 min,以3 ℃/min的升温速率升至115 ℃,再以5 ℃/min的升温速率升至180 ℃,以2 ℃/min的升温速率升至250 ℃,最后以10 ℃/min的升温速率升至270 ℃,测试结束。
1.3.4FT-IR分析于红外光谱仪上采用压片法测定,扫描范围400~4000 cm-1。
1.3.5GC-MS联用分析色谱柱采用HP-5型毛细管柱,气相色谱方法同1.3.3节。
1.3.61H NMR和13C NMR分析核磁共振仪上进行,CDCl3为溶剂,以四甲基硅烷(TMS)为内标。
2结果与讨论
2.1反应条件对草酸葑醇酯收率的影响
2.1.1反应时间在草酰氯和葑醇的物质的量之比为0.6∶1.0时,于55 ℃下反应24 h,间隔取样,研究反应时间对产物收率的影响,结果如图2 (a)所示。由图2 (a)可知,草酸葑醇酯的收率随着反应时间的增加而增加,反应2 h时,由于草酰氯的活性较大,产物的收率已达90 %, 2~10 h增加速率相对较大,10 h以后反应基本平衡,收率增加缓慢,为了得到相对较高收率的草酸葑醇酯,选择适宜反应时间为10 h,此时产物收率为94 %。

a.反应时间 reaction time;b.反应温度 reaction temperature;c.物料比值 molar ratio of oxalyl chloride and fenchyl alcohol图 2 反应条件对草酸葑醇酯收率的影响Fig. 2 Effects of reaction conditions on the yield of fenchyl oxalate
2.1.2反应温度在草酰氯和葑醇的物质的量之比为0.6∶1.0时,分别在不同的温度下反应10 h,研究反应温度对产物收率的影响,结果如图2 (b)所示。由图2 (b)可知,草酸葑醇酯的收率随反应温度的增加而增加,当反应温度大于55 ℃时,产物收率的增加速率减慢,当反应温度为65 ℃时,产物收率仅比55 ℃时增加0.7 %,并且由于此温度接近正己烷的沸点,溶剂挥发较快。因此,反应的适宜温度为55 ℃。
2.1.3原料物质的量比在反应温度为55 ℃时,分别加入不同的物质的量比的原料反应10 h,研究原料物质的量比对产物收率的影响,结果如图2 (c)所示。由图2 (c)可知,原料物质的量比对草酸葑醇酯的收率影响很大,随着草酰氯的增加,目标产物的收率先升高后降低,当n(草酰氯)∶n(葑醇)=0.7∶1.0时,目标产物收率最大,原料比大于0.7∶1.0后,副反应增多,产物收率有所降低,原料比为0.6∶1.0与0.7∶1.0时目标产物收率相差不大,且对过多的草酰氯的处理会导致最终产率降低,因此,原料适宜的物质的量比选为0.6∶1.0。
2.1.4验证实验由以上单因素试验结果,确定较佳反应实验条件为:n(草酰氯)∶n(葑醇)=0.6∶1.0,反应温度55 ℃,反应时间10 h。在此条件下重复实验3次,草酸葑醇酯的收率分别为94.3 %、93.5 %、93.9 %,平均值为93.9 %,实验重复稳定性好。
2.2产物性质及结构表征

2.2.2气相色谱-质谱分析 图3是草酸葑醇酯的气相色谱-质谱图。
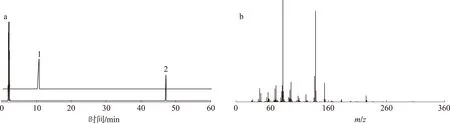
1. α-葑醇α-fenchyl alcohol; 2. 草酸葑醇酯fenchyl oxalate a. GC; b. MS图 3 草酸葑醇酯气相色谱-质谱图Fig. 3 GC-MS spectra of fenchyl oxalate
图3(a)为葑醇酯化前后气相色谱图,其中10.4 min为葑醇吸收峰, 46.5 min为目标产物的吸收峰,由图中可以看出,葑醇已转化为草酸葑醇酯,且通过纯化可获得高纯度的产品。3(b)为草酸葑醇酯质谱图,其中m/z362.2为草酸葑醇酯的分子离子峰,主要的碎片离子峰分析如图4所示。

图 4 草酸葑醇酯的质谱碎片离子Fig. 4 The fragment ions of fenchyl oxalate
2.2.3红外谱图分析草酸葑醇酯的红外谱图如图5所示。从红外光谱图中可以看出,2966、2874和2935 cm-1分别为甲基和亚甲基的伸缩振动吸收峰,1737 cm-1为羰基强吸收峰,1459、1384和1365 cm-1为甲基、亚甲基的变形振动吸收峰,其中1365 cm-1为典型的偕二甲基弯曲振动峰,1181和1158 cm-1为C—O—C对称和反对称伸缩振动吸收峰,760 cm-1为亚甲基的平面摇摆振动吸收峰。红外光谱特征吸收峰与草酸葑醇酯的结构一致。

图 5 草酸葑醇酯红外谱图Fig. 5 IR spectrum of fenchyl oxalate
2.2.4氢谱分析草酸葑醇酯的氢谱和碳谱图如图6所示。1H NMR (500 MHz, CDCl3,化合物碳原子编号见图1)δ:4.52(s,2H,H-2,H-2′),1.71~1.81(m,6H,He-5,He-5′,H-4,H-4′,He-6,He-6′),1.62~1.64(d,2H,He-7,He-7′,J=10.2 Hz),1.48~1.52(m,2H,Ha-6,Ha-6′),1.24~1.26(d,2H,Ha-7,Ha-7′,J=10.4 Hz),1.17(m,2H,Ha-5,Ha-5′),1.15(s,6H,CH3-9,CH3-9′),1.09(s,6H,CH3-10,CH3-10′),0.84(s,6H,CH3-8,CH3-8′)。

图 6 草酸葑醇酯的 1H NMR(a)和13C NMR(b)谱图Fig. 6 1H NMR(a) and 13C NMR(b) spectra of fenchyl oxalate
化学位移(δ)在5.04处的单峰属于酯基α-位(图1中2和2′-位)氢,δ1.71~1.81处的多重峰分别属于4,4′-位的氢,5,5′及6,6′-平伏键He,δ1.62~1.64处的双峰属于7,7′-位平伏键He,δ1.48~1.52处的多重峰属于6,6′-位直立键Ha,δ1.24~1.26处的双峰属于7,7′-位直立键Ha,δ1.17处的多重峰属于5,5′-位直立键Ha,δ1.15、1.09以及0.84处的单峰则属于9,9′、 10,10′以及8,8′-位甲基氢,与草酸葑醇酯的结构相吻合。
2.2.5碳谱分析从草酸葑醇酯的碳谱图可以看出:不同碳原子(序号见图1)的13C NMR化学位移值见表1。在13C NMR中,酯基碳C11和C11′处于最低场,化学位移δ为159;受酯基吸电子效应的影响C2和C2′移向低场,化学位移为88.88和88.83;处于高场的6个甲基碳C8、 C8′、 C9、 C9′、 C10和C10′,化学位移较小;而C5、 C5′、 C6、 C6′化学环境接近,化学位移相近,C6和C6′离甲基近,化学移位向高场移动,比C5和C5′小;C1、 C1′、 C3、C3′、 C4、 C4′、 C7和C7′由于电子云密度的关系,化学位移处于中间。13C NMR分析结果表明,草酸葑醇酯中左右两侧的2个葑醇基上的碳原子所处的化学环境有微小差别,即通过葑醇合成的草酸葑醇酯不是一个完全对称的结构。其中1和1′、 3和3′、 11和11′这3组碳原子表现为单峰, 2和2′、 4和4′这2组碳原子表现为二重峰, 5和5′、 6和6′这2组碳原子表现为多重峰, 7和7′这组碳原子表现为三重峰, 8和8′、 9和9′、 10和10′这3组碳原子表现为四重峰。

表 1 草酸葑醇酯中各碳原子13C NMR归属
3结 论
以α-葑醇和草酰氯为原料合成了草酸葑醇酯,用IR、GC-MS、1H NMR、13C NMR等对其进行了结构表征。通过实验探讨了反应时间、反应温度及原料物质的量之比对产物收率的影响,确定了较佳合成反应条件为反应温度55 ℃、反应时间10 h、草酰氯与葑醇的物质的量之比为0.6∶1.0,此条件下草酸葑醇酯的收率为93.9 %。对制备的草酸葑醇酯经重结晶后纯度可达99.9 %。
参考文献:
[1]刘小琴,张煌,郑辉东,等. 锐钛型介孔偏钛酸催化剂的制备及其催化酯化性能[J]. 化工进展,2013,32(7):1573-1576.
[2]金梅梅,杨义文,谭军. 硫酸钛催化α-蒎烯合成龙脑[J]. 合成化学,2011,19(6):791-793.
[3]陈尚和,江美玉,黄兴. 硼钛基复合催化剂在合成龙脑生产中的应用[J]. 生物质化学工程,2010,44(3):36-39.
[4]GOLETS M,AJAIKUMAR S,BLOMBERG D,et al. Liquid phase acetoxylation ofα-pinene over Amberlyst-70 ion-exchange resin[J]. Applied Catalysis A:General,2012(435/436):43-50.
[5]MAGEE D I,MALLAIS T C,EIC M. Asymmetric synthesis of chiralα-keto esters via Grignard addition to oxalates[J]. Tetrahedron: Asymmetry,2003,14(20):3177-3181.
[6]HUCKEL W,ROHRER H. Alcoholysis of toluenesulfonic acid esters. VI.α- andβ-fencholp-toluenesulfonate[J]. Chemische Berichte,1960(93):1053-1059.
[7]何春茂,李华杰,朱金忠,等. 一种乙酸葑酯的制备方法:中国,CN 103012130 A[P]. 2012-11-08.
[8]张平辉,赵振东,徐士超,等. 草酸二龙脑酯的合成及其表征[J]. 精细化工,2014,31(11):1402-1405.
[9]田新庭,赵振东,张平辉,等. 一种由龙脑合成草酸二龙脑酯的方法:中国,CN 103992221 A[P]. 2012-11-08.
[10]张平辉,郭利群,袁晓敏,等. 草酸二异龙脑酯的合成及其结构表征[J]. 林产化学与工业,2015,35(3):33-37.
[11]赵振东,张平辉,田新庭,等. 一种合成草酸二异龙脑酯的方法:中国,CN 103980117 A [P]. 2012-11-08.
doi:10.3969/j.issn.1673-5854.2016.04.001
收稿日期:2015-12-18
基金项目:农业科学技术成果转化资金项目(2013GB24320604)
作者简介:袁晓敏(1990— ),女,河南安阳人,硕士生,主要从事应用化学研究;E-mail:yxmcfu@163.com *通讯作者:赵振东,研究员,博士生导师,主要从事萜类化学、天然产物化学、应用化学、松树病虫害化学等方面的研究与利用;E-mail:zdzhao@189.cn。
中图分类号:TQ351.4
文献标识码:A
文章编号:1673-5854(2016)04-0001-05
Synthesis and Characterization of Fenchyl Oxalate
YUAN Xiao-min1, ZHAO Zhen-dong1,2, XU Shi-chao1,2, LU Yan-ju1,2, ZHU Shou-ji1
(1. Institute of Chemical Industry of Forest Products,CAF;National Engineering Lab. for Biomass Chemical Utilization;Key and Open Lab. of Forest Chemical Engineering,SFA;Key Lab. of Biomass Energy and Material,Jiangsu Province, Nanjing 210042, China; 2. Research Institute of Forestry New Technology,CAF, Beijing 100091, China)
Abstract:Fenchyl oxalate was synthesized by the reaction of α-fenchyl alcohol and oxalyl chloride.The influences of reaction conditions on the esterification were studied.The optimum conditions of the esterification were the molar ratio of oxalyl chloride and fenchyl alcohol 0.6∶1.0,reaction temperature 55 ℃ and reaction time 10 h.Under these conditions,the yield of fenchyl oxalate was 93.9 %.After recrystallization,the purity could be 99.9 %.And the structure of fenchyl oxalate was characterized by GC-MS,IR,1H NMR and13C NMR.
Key words:fenchyl alcohol;oxalyl chloride;fenchyl oxalate;characterization
·研究报告——生物质化学品·

