柚皮苷抑制黑色素瘤的生长与转移
郭冰玉, 张 宇, 回 蔷, 常 鹏, 陶 凯
作者单位:110084 辽宁 沈阳,沈阳军区总医院 整形外科
柚皮苷抑制黑色素瘤的生长与转移
郭冰玉, 张 宇, 回 蔷, 常 鹏, 陶 凯
作者单位:110084 辽宁 沈阳,沈阳军区总医院 整形外科
目的 初步探索柚皮苷对黑色素瘤细胞生长与迁移的抑制作用。方法 使用不同浓度的柚皮苷分别处理A375细胞,应用MTT法检测不同处理因素对A375细胞增殖的影响,利用TRANSWELL实验检测不同处理因素对A375细胞迁移的作用。通过WESTERN BLOT及REAL-TIME PCR方法检测不同因素作用下相关蛋白的变化。结果 不同浓度的柚皮苷对A375细胞增殖与迁移均有一定的抑制作用,其中10、20、40 μm/L柚皮苷作用24 h后,对A375细胞增殖的抑制率分别为(40.01±0.74)%、(48.69±3.66)%和(54.32±1.61)%。20、40 μm/L柚皮苷作用24 h后,对A375细胞迁移的抑制率分别为(18.44±3.89)%和(38.14±7.98)%。柚皮苷对A375细胞增殖与迁移功能的抑制作用随着剂量增加。柚皮苷对调控细胞增殖、迁移的CDK4等蛋白均有抑制作用。结论 柚皮苷对黑色素瘤细胞A375细胞增殖与转移均有抑制作用,可以作为临床治疗黑色素瘤的新的潜在药物而进一步研究。
黑色素瘤; 柚皮苷; 增殖; 迁移; A375
黑色素瘤的5年生存率不足10%,其致死率占皮肤肿瘤的首位[1]。近年来,黑色素瘤的发病率逐年升高,而不断改进的手术方案与化疗措施并不能很好地提高患者的生存率[2]。很多报道指出,致癌基因的突变是黑色素瘤诱发的主要因素,因此,越来越多的靶向药物研究进入了人们的视线[3]。柚皮苷(naringin)是一种双氢黄酮类化合物,目前已被证明具有抗氧化、抗炎等多种生物学活性[4]。也有研究指出,柚皮苷是一种潜在的抗癌药物,但作用机制并不明确[5]。柚皮苷已被证明可以抑制如乳腺癌、结肠癌、肝癌、肺癌、肠癌和卵巢癌等多种肿瘤细胞的生长与侵袭转移[6]。自2015年6月至2016年1月,沈阳军区总医院整形外科以人黑色素瘤细胞A375作为研究对象,初步探索柚皮苷对于A375细胞增殖与迁移的影响,并且进一步初探对其起作用的原因。
1 对象与方法
1.1 研究对象
人黑色素瘤A375细胞株(实验室冻存);DMEM培养基(美国INVITROGEN公司);胎牛血清(天津灏洋);柚皮苷(美国SELLECK公司);0.4 %台盼蓝,抗体: CDK4,CDK6,MMP2,MMP9和GAPDH(美国SANTA公司);SYBR Green (美国PROMEGA公司)。
1.2 研究方法
1.2.1 细胞培养 人黑色素瘤细胞A375使用含10%胎牛血清DMEM培养基培养。
1.2.2 药物处理浓度 通过前期试验筛选,柚皮苷选取10、20、40 μm/L 3个浓度,使用生理盐水配置;对照组使用生理盐水处理。
1.2.3 MTT实验 将处于对数生长期的A375细胞以1×104每孔的密度接种于96孔板中,细胞培养12 h添加不同处理因素,每组每个时间点设3个复孔。药物处理后分别取0、12、24、36、48 h时间点添加5 mg/ml MTT 10 μl,孵育4 h后,小心吸去培养基,每孔中加入100 μl DMSO,溶解MTT-甲臜结晶,15 min后,在490 nm处记录吸光值。
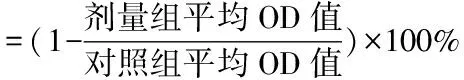
1.2.4 TRANSWELL实验 对数生长期细胞以1×105每孔的密度接种于TRANSWELL小室中,终体积200 μl,下室加入600 μl无血清培养基;12 h后更换培养基,使用不同药物浓度处理细胞,每组设3个复孔。药物作用24 h后,棉签擦去上层细胞,95%乙醇固定20 min,0.4%台盼蓝染色20 min。200倍显微镜下观察。

1.2.5 WESTERN BLOT检测蛋白表达水平 对数生长期的细胞于6孔板中,贴壁培养12 h后,添加不同浓度的药物进行处理,药物作用24 h后收集细胞,提取总蛋白;电泳、转膜后,室温封闭1 h;一抗4℃过夜。二抗室温1 h。
1.2.6 REALTIME PCR检测蛋白RNA表达水平 通过TRIZOL法提取细胞总RNA,反转录成cDNA,进行REALTIME PCR反应。所用引物为CDK4,F(5′-3′):CTGGTGACAAGTGGTGGAAC;R(5′-3′):GGTCGGCTTCAGAGTTTCC;CDK6,F(5′-3′):GTCTGATTACCTGCTCCGC;R(5′-3′):CCTCGAAGCGAAGTCCTC;MMP2,F(5′-3′):CGCATCTGGGGCTTTAAAC;R(5′-3′):CAGCACAAACAGGTTGCAG;MMP9,F(5′-3′):CGACGTCTTCCAGTACCGAG;R(5′-3′):GTATCCGGCAAACTGGCT;GAPDH,F(5′-3′):CATCCCTTCTCCCCACACAC;R(5′-3′):AGTCCCAGGGCTTTGATTTG。
1.2.7 划痕实验 在6孔板加入约5×105个细胞。第2天用枪头比对着直尺划痕,枪头要垂直,不能倾斜。用PBS洗细胞3次,去除漂浮的细胞,加入无血清培养基。放入37℃ 5%CO2培养箱,培养24 h时取样,拍照。

2 结果
2.1 不同浓度的药物对A375细胞增殖的影响
对不同浓度的柚皮苷处理后,在不同的时间点下,通过MTT检测细胞的增殖情况(图1)。结果显示,柚皮苷可以抑制A375细胞的增殖。柚皮苷对A375细胞增殖的抑制作用随着浓度的增加而增加(图2)。
2.2 不同浓度的柚皮苷对A375细胞增殖相关蛋白的影响
不同浓度的柚皮苷对CDK4和CDK6均有一定程度的抑制作用,随着药物浓度的升高抑制作用增强(图3)。
2.3 不同浓度的柚皮苷对A375细胞转移的影响
不同浓度的柚皮苷作用24 h后,对A375细胞的转移功能均有一定程度的抑制,其抑制率随着药物浓度的增加而增加。通过transwell实验发现,不同浓度的柚皮苷具有抑制A375细胞转移的作用,随着浓度的增高,抑制作用有所增强(图4)。划痕实验证实,柚皮苷处理后细胞迁移能力减慢。
2.4 不同浓度的柚皮苷对A375细胞转移相关蛋白的影响
不同浓度的柚皮苷对MMP2与MMP9均有一定程度的抑制作用,随着药物浓度的升高抑制作用增强(图5~7)。
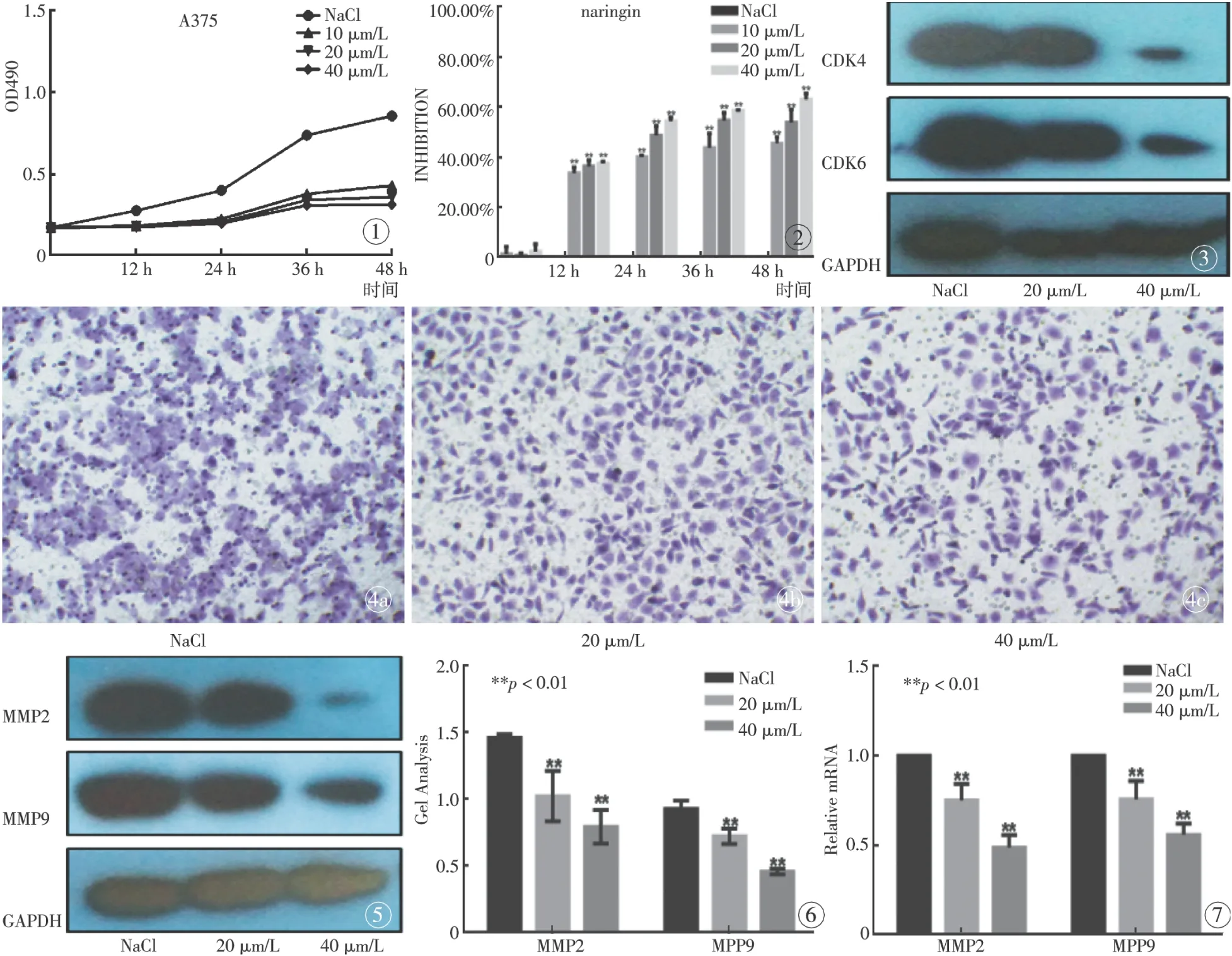
图1 不同浓度柚皮苷处理后A375细胞的增殖情况 图2 不同剂量柚皮苷对A375细胞增殖的抑制率 图3 不同浓度柚皮苷作用下A375细胞蛋白的变化 图4 不同剂量的柚皮苷作用下A375细胞的转移情况 a. Nacl. b. 20 μm/L. c. 40 μm/L. 图5 不同浓度柚皮苷作用下A375细胞蛋白的变化 图6 不同浓度柚皮苷处理后A375细胞MMP2, MMP9的影响 图7 不同浓度柚皮苷处理后A375细胞蛋白RNA水平的影响
Fig 1 The proliferation of A375cells treated by Naringin with different concentrations. Fig 2 The inhibition on A375 cell proliferation treated by Naringin with different concentrations. Fig 3 The changes of A375 proteins treated by Naringin with different concentrations. Fig 4 The migration of A375 cells treated by Naringin with different concentrations. a. Nacl. b. 20 μm/L. c. 40 μm/L. Fig 5 The proteins of A375 cells treated by Naringin with different concentrations. Fig 6 The MMP2 and MMP9 levels of A375 cells treated by Naringin with different concentrations. Fig 7 The RNA levels of A375 cells treated by Naringin with different concentrations.
3 讨论
黑色素瘤具有恶性程度高、增殖快、易发生淋巴结等部位的远隔转移等特点[7]。虽然近年来手术及各种放化疗方法不断改进[8],但黑色素瘤患者的生存率仍然不高。因此,寻找新的靶向药物,针对黑色素瘤进行靶向治疗对于提高患者生存率有很大意义。
目前多种研究发现,中药不仅对肿瘤细胞具有直接杀伤作用,还可以对抗放化疗所产生的并发症与不良反应,而且中药不易产生耐受现象,对身体不良反应较小,因此,中药是目前肿瘤治疗研究的热点。有报道指出在肿瘤患者的化疗过程中,中药的配合使用可以有效地减轻化疗药物导致的如恶心、呕吐、食欲不振等不良反应,从而提高患者的生活质量,改善预后,延长患者生存时间。柚皮苷全称为柚皮素-7-O-新橙皮糖苷,主要存在于芸香科植物中,作为重要的有效成分已经被报道对多种肿瘤有抑制作用。在结肠癌细胞中,柚皮苷可以通过调节p21蛋白的表达,抑制细胞的增殖。乳腺癌细胞中柚皮苷可以调节wnt通路抑制细胞的生长[9]。也有报道指出,柚皮苷可以降低基质金属蛋白酶的表达,抑制肿瘤细胞的侵袭转移[10]。与此同时,柚皮苷也可以通过抑制c-src通路来调节细胞的代谢水平,进而通过抑制细胞的糖代谢,对细胞的生长与侵袭转移起到抑制作用[11]。
CDK4与CDK6是一类丝/苏氨酸蛋白激酶,可以与细胞周期素D结合,调节细胞G1/S期的转换。CDK4与CDK6的特异性激活与肿瘤的增殖密切相关,人类大约80%的肿瘤都存在CDK4/CDK6异常表达的现象[12]。CDK4/CDK6的异常表达,可以加速G1期的进程,加速肿瘤细胞增殖,使肿瘤细胞获得生存优势。因此,CDK4/CDK6已成为抗肿瘤的药物靶点而被广泛研究[13]。研究表明,CDK4/CDK6的靶向抑制剂具有较小的细胞毒性及较高的药物敏感性[14]。肿瘤转移的基本过程大致为:形成早期原发灶,生成相关血管,细胞脱落而侵入基质,细胞进入脉管系统而形成癌栓,进一步生长成转移灶[15]。基质金属蛋白酶(MMPs)可以降解细胞外基质,这是导致肿瘤转移的关键蛋白酶。其中,MMP2和MMP9均属于明胶类基质金属蛋白酶,可以水解细胞外基质,促进癌细胞转移[16]。与此同时,MMP2与MMP9也可以启动血管基底膜的蛋白降解,为内皮细胞的转移开辟通路,进一步促进血管生成[17]。也有研究证明,MMP2与MMP9具有一定的生长因子释放功能[18]。因此,许多靶向药物是通过抑制MMPs来对肿瘤起到抑制作用[19]。
本研究表明,不同浓度的柚皮苷对人黑色素瘤细胞A375均有一定程度的抑制作用,它可以抑制细胞的增殖与转移。实验结果表明,柚皮苷在很低的浓度(40 μm/L)时,对细胞的抑制率可以达到50%。柚皮苷可以通过抑制CDK4/CDK6、MMP2和MMP9来实现对细胞增殖与转移的抑制作用。
[1] Ghosh S, Sikdar S, Mukherjee A, et al. Evaluation of chemopreventive potentials of ethanolic extract of Ruta graveolens against A375 skin melanoma cells in vitro and induced skin cancer in mice in vivo[J]. J Integr Med, 2015,13(1):33-44.
[2] Lose IM, Immervoll H, Angelsen JH, et al. Performance comparison of three BRAF V600E detection methods in malignant melanoma and colorectal cancer specimens[J]. Tumour Biol, 2015,36(2):1003-1013.
[3] Eisemann N, Waldmann A, Garbe C, et al. Development of a microsimulation of melanoma mortality for evaluating the effectiveness of population-based skin cancer screening[J]. Med Decis Making, 2015,35(2):243-254.
[4] Raha S, Yumnam S, Hong GE, et al. Naringin induces autophagy-mediated growth inhibition by downregulating the PI3K/Akt/mTOR cascade via activation of MAPK pathways in AGS cancer cells[J]. Int J Oncol, 2015,47(3):1061-1069.
[5] Zeng L, Zhen Y, Chen Y, et al. Naringin inhibits growth and induces apoptosis by a mechanism dependent on reduced activation of NF-kB/COX-2-caspase-1 pathway in HeLa cervical cancer cells[J]. Int J Oncol, 2014,45(5):1929-1936.
[6] Li H, Yang B, Huang J, et al. Naringin inhibits growth potential of human triple-negative breast cancer cells by targeting beta-catenin signaling pathway[J]. Toxicol Lett, 2013,220(3):219-228.
[7] Rager EL, Bridgeford EP, Ollila D. Cutaneous melanoma: update on prevention, screening, diagnosis, and treatment[J]. Am Fam Physician, 2005,72(2):269-276.
[8] Zhao F, He X, Sun J, et al. Cancer stem cell vaccine expressing ESAT-6-gpi and IL-21 inhibits melanoma growth and metastas-es[J]. Am J Transl Res, 2015,7(10):1870-1882.
[9] Ramesh E, Alshatwi AA. Naringin induces death receptor and mitochondria-mediated apoptosis in human cervical cancer (SiHa) cells[J]. Food Chem Toxicol, 2013,51:97-105.
[10] Aroui S, Aouey B, Chtourou Y, et al. Naringin suppresses cell metastasis and the expression of matrix metalloproteinases (MMP-2 and MMP-9) via the inhibition of ERK-P38-JNK signaling pathway in human glioblastoma[J]. Chem Biol Interact, 2015,244:195-203.
[11] Adebiyi OO, Adebiyi OA, Owira PM. Naringin reverses hepatocyte apoptosis and oxidative stress associated with HIV-1 nucleotide reverse transcriptase inhibitors-induced metabolic complications[J]. Nutrients, 2015,7(12):10352-10368.
[12] MrCain J. First-in-class CDK4/6 inhibitor palbociclib could usher in a new wave of combination therapies for HR+, HER2-breast cancer[J]. PT, 2015,40(8):511-520.
[13] Lu J. Palbociclib: a first-in-class CDK4/CDK6 inhibitor for the treatment of hormone-receptor positive advanced breast can-cer[J]. J Hematol Oncol, 2015,8:98.
[14] Dukelow T, Kishan D, Khasraw M, et al. CDK4/6 inhibitors in breast cancer[J]. Anticancer Drugs, 2015,26 (8):797-806.
[15] XU Y, Li Z, Jiang P, et al. The co-expression of MMP-9 and Tenascin-C is significantly associated with the progression and prognosis of pancreatic cancer[J]. Diagn Pathol, 2015,10:211.
[16] Zhang XX, Fu Z, Zhang Z, et al. Miemeystin-LR promotes melanoma cell invasion and enhances MMP2/9 expression mediated by NF-kappaB activation[J]. Environ Sci Technol, 2012,46(20):11319-11326.
[17] Ricci S, Bruzzese D, DI Carlo A. Evaluation of MMP-2, MMP-9, TIMP-1, TIMP-2, NGAL and MMP-9/NGAL complex in urine and sera from patients with bladder cancer[J]. Oncol Lett, 2015,10(4):2527-2532.
[18] Wieczorek E, Jablonowski Z, Tomasik B, et al. MMP, VEGF and TIMP as prognostic factors in recurring bladder cancer[J]. Clin Biochem, 2015,48(18):1235-1240.
[19] 张 宇, 郭冰玉, 回 蔷, 等. 氧化苦参碱增强多西他赛对黑色素瘤细胞增殖的抑制作用[J]. 中国美容整形外科杂志, 2015,26(11):702-704.
Inhibition of Naringin in the growth and migration of melanoma
GUOBing-yu,ZHANGYu,HUIQiang,CHANGPeng,TAOKai.
(DepartmentofPlasticSurgery,TheGeneralHospitalofShenyangMilitaryRegion,Shenyang110084,China)
TAOKai,Email:13309887570@163.com
Objective To explore the effect of Naringin on the growth and migration of melanoma cells.Methods A375 cells were treated with Naringin at different concentrations, MTT assay was used to detect the influence on the proliferation of A375 cells; Transwell assay was used to detect the effect on migration. The proteins which were associated with proliferation and migration were detected by western blot and real-time PCR. Results Different concentrations of Naringin had certain inhibition on A375 cell proliferation and migration. The inhibition rates on A375 cell proliferation at 24 hours after treatment of 10 μm/L, 20 μm/L and 40 μm/L Naringin were (40.01±0.74)%, (48.69±3.66)% and (54.32±1.61)%, the inhibition rates on A375 cell migration at 24 hours after treatment of 20 μm/L and 40 μm/L Naringin were (18.44±3.89)% and (38.14±7.98)%. Inhibitions on A375 cells proliferation and migration were enhanced as the dose increased. At the same time Naringin can significantly inhibit the expression of the proteins which were associated with the cells proliferation and migration. Conclusion Naringin can inhibit the proliferation and migration of A375 cells, which means that it may provide a new strategy for the treatment of melanoma cancer.
Melanoma; Naringin; Proliferation; Migration; A375
郭冰玉(1989-),女,辽宁沈阳人,技师,硕士研究生.
陶 凯,110084,沈阳军区总医院 整形外科,电子信箱:13309887570@163.com
10.3969/j.issn.1673-7040.2016.08.019
R739.5
A
1673-7040(2016)08-0503-04
2016-05-16)

