S100A9在糖尿病大鼠牙周组织中的表达及其作用研究
孙文华 陈国庆 田卫东
1.四川大学生命科学学院,成都 610065;2.口腔疾病研究国家重点实验室 华西口腔医院(四川大学);3.口腔再生医学国家地方联合工程实验室(四川大学),成都 610041
S100A9在糖尿病大鼠牙周组织中的表达及其作用研究
孙文华1,2,3陈国庆2,3田卫东2,3
1.四川大学生命科学学院,成都 610065;2.口腔疾病研究国家重点实验室华西口腔医院(四川大学);3.口腔再生医学国家地方联合工程实验室(四川大学),成都 610041
目的研究S100A9蛋白在糖尿病大鼠牙周组织中的表达,探讨其在糖尿病诱发的牙周病变中可能的作用机制。方法本实验通过对SD大鼠腹腔注射链脲佐菌素(STZ)构建糖尿病大鼠模型,通过苏木精-伊红(HE)染色观察糖尿病大鼠牙周结构的变化,免疫组织化学染色观察糖尿病大鼠牙周组织中S100A9的表达与分布,同时检测其配体Toll受体4(TLR4)和核转录因子κB(NF-κB)/p-P65蛋白的表达。通过分析上述蛋白的表达规律,探讨S100A9蛋白在糖尿病诱发的牙周病变中的作用机制。结果糖尿病大鼠的牙槽骨骨小梁结构稀疏,硬骨板消失;免疫组织化学染色显示牙周膜、牙槽骨及牙龈上皮中S100A9的表达水平比对照组明显上调,TLR4在牙槽骨、牙周膜、牙龈中的表达水平相较于对照组也显著增强;p-P65在对照组中没表达,但在糖尿病组中牙周膜和牙槽骨中呈阳性表达。结论糖尿病导致大鼠牙周组织结构病变,其原因可能与S100A9介导的TLR4和NF-κB信号通路的活化有关。
S100A9;牙周病变;糖尿病;Toll受体4;核转录因子κB
糖尿病是一类以高血糖为特征的代谢性疾病,主要的病理生理基础为两种,胰岛素分泌缺陷和胰岛素抵抗。牙周炎同样属于多发高发的慢性疾病,是一类由细菌引起的慢性牙周感染,导致牙周组织破坏、牙槽骨吸收、牙周袋内形成溃疡等症状的疾病。糖尿病患者出现牙周炎的概率比正常人要高出3~5倍。研究[1]发现糖尿病会导致因牙周微生物群引起的过度炎性反应,使牙周组织修复功能受损,进而导致牙周组织的进一步破坏。牙周炎也会影响糖尿病患者的血糖调控机制[2],促发糖尿病的多种并发症发生,但两者间的相互关系尚未完全明确。
S100A9是S100蛋白家族的一员,在体内可和S100A8形成异源二聚体,S100A9自身也能形成同源二聚体,临床中大多数炎症患者血清中S100A9及其同源二聚体和形成的异源二聚体的表达量都呈明显的升高[3]。S100A9和S100A8结合形成的异源二聚体是S100A9在体内最稳定的生理结构[4],有推测S100A9的生理活性形态是在和S100A8结合后,也有研究[5]发现S100A8/A9二聚体可调控细胞的凋亡,且具有一定的抗菌能力[6]。然而,目前就S100A9在糖尿病导致的牙周病变中的表达和作用机制的研究甚少。
S100A9蛋白功能多样,可高亲和性地结合Ca2+、Zn2+等离子,参与细胞迁移、骨髓细胞成熟[7]、酪蛋白激酶抑制、免疫调节等生物学过程[8]。该蛋白主要表达于中性粒细胞和单核细胞的胞质中,少量表达于细胞核、细胞骨架和质膜上。体内S100A9大概分为分泌型和胞内型两种,胞内主要以钙离子依赖的方式调节细胞活性,分泌型S100A9蛋白则位于胞外通过结合晚期糖基化终末产物受体(advanced glycation end products receptor,RAGE)和Toll受体(Tolllike receptor,TLR)发挥生物学功能。研究[9]发现S100A9蛋白通过RAGE作用于P38、P42/44和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路,以激活核转录因子κB(nuclear factor κB,NF-κB)进而导致一系列的生物学反应。本课题旨在研究分泌型S100A9蛋白在糖尿病大鼠牙周组织中的高表达和牙周组织病变的关联,以及S100A9蛋白对TLR、NF-κB信号通路的作用。
1 材料和方法
1.1主要试剂
S100A9(稀释比例为1∶200,Thermo公司,美国),TLR4(稀释比例为1∶200,Abcam公司,美国),p-P65(稀释比例为1∶200,Santa Cruz公司,美国),链脲佐菌素(streptozotocin,STZ)(Sigma公司,美国)。
1.2方法
1.2.1糖尿病大鼠模型建立选取8周龄雄性SD大鼠30只,体重250~300 g,随机选取20只作为糖尿病模型组(实验组),10只为对照组。现配0.1 mol·L-1pH为4.5的柠檬酸缓冲液溶解STZ,22 μm孔径滤器过滤除菌,注射用量以60 mg·kg-1体重为准,腹腔注射一次;正常对照组以0.1 mol·L-1柠檬酸缓冲液作为对照。在腹腔给药前12 h严格禁食,给药后可自由取食。模型组分别在给药48 h、1周后取尾静脉血测定血糖,血糖值≥16.5 mmol·L-1视为造模成功。此后每周检测血糖,饲养过程中一旦发现血糖恢复正常者或死亡者均视为造模失败。按照标准实验动物规定饲养。
1.2.2组织固定和切片制作对照组和实验组大鼠在以STZ注射12周后取材,实验组和对照组分别注射10%水合氯醛2 mL麻醉致死后取下颌组织,立即置于4%多聚甲醛中4 ℃固定24 h,PBS缓冲液清洗2~3次,置于10%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)中进行脱钙处理12周。组织脱钙完成后,进行梯度乙醇脱水,70%、80%、90%乙醇各1 h,100%乙醇2 h2次,组织置于二甲苯中1 h 2次,进行浸蜡包埋,制作8 μm切片。
1.2.3苏木精-伊红(hematoxylin-eosin,HE)染色石蜡切片经脱蜡、水化处理后,依次PBS缓冲液清洗5 min×2次,苏木素染色5 min,双蒸水清洗5 min× 2次,伊红染色10 min,双蒸水清洗5 min×2次,梯度乙醇脱水、二甲苯透明后中性树脂封片。
1.2.4免疫组织化学染色免疫组织化学染色采用ABC法进行,详细步骤如下:石蜡切片经脱蜡、水化处理后,以3%H2O2室温处理20 min灭活内源性过氧化物酶;切片经PBS漂洗后进行抗原修复、羊血清封闭;随后切片滴加相应一抗后37 ℃孵育2 h,4 ℃过夜;二抗37 ℃孵育1 h,室温下DAB显色,显微镜下观察显色效果,PBS漂洗终止显色,苏木素复染30 s,梯度乙醇脱水、二甲苯透明后封片。
1.2.5免疫组织化学染色半定量分析染色结果的半定量分析以多数细胞的阳性染色程度进行评分:从阴性到强阳性分为4个等级:0分为阴性(-),1分为弱阳性(+),2分为阳性(++),3分为强阳性(+++)。切片置于高倍镜下观察,每张切片至少选取4个视野进行综合评分。
1.3数据处理和统计
采用SPSS 17.0软件对实验数据进行分析,对实验组和对照组的血糖和体重等计量资料进行正态性检验,用均数±标准差进行统计描述,采用t检验进行统计学分析,以P<0.01为差异显著。
2 结果
2.1糖尿病大鼠模型构建
实验组和对照组大鼠血糖分别为(29.22±4.47)、(5.41±0.96) mmol·L-1,实验组大鼠血糖水平显著高于对照组(P<0.001)。实验组和对照组大鼠体重分别为(241.08±46.23)、(332.54±34.39) g, 实验组大鼠体重显著下降(P<0.001)。由此表明糖尿病大鼠模型建立成功。
2.2大鼠下颌牙周组织结构的改变
通过组织形态学观察发现,实验组大鼠牙槽骨中骨小梁结构稀疏并且散乱,骨吸收明显增加,在牙周膜与牙槽骨相衔接的一层硬骨板被完全破坏(图1),表明糖尿病导致大鼠牙周炎性病变或外伤。
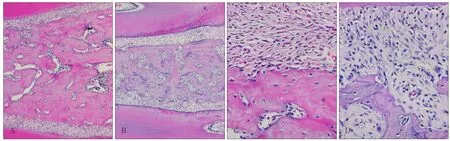
图1 糖尿病大鼠和正常大鼠牙周组织形态学观察 HEFig 1 The histomorphology observation of diabetic and control rats' periodontium HE
2.3S100A9在糖尿病大鼠下颌牙周组织中的表达
免疫组织化学染色结果显示,S100A9在糖尿病大鼠牙槽骨、牙周膜和牙龈组织中均有表达,且主要集中于细胞质中表达。与对照组相比,S100A9在牙周膜中的表达增强;在牙龈组织中的表达明显增强,且主要集中于牙龈上皮中;在牙槽骨中出现显著上调(图2)。通过半定量分析对染色组织进行评分,S100A9蛋白在正常大鼠牙周膜、牙龈、牙槽骨中的表达评分分别为1、2、1;在糖尿病大鼠牙周膜、牙龈、牙槽骨中的表达评分分别为2、3、2。
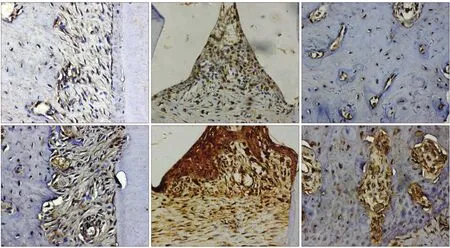
图2 S100A9蛋白在糖尿病和正常大鼠牙周中的表达 免疫组织化学染色 × 400Fig 2 The expression of S100A9 in the periodontium of diabetic and control rats immunohistochemical staining × 400
2.4TLR4和p-P65在糖尿病大鼠牙周组织中的表达
TLR4在牙周膜、牙龈上皮和牙槽骨中均有阳性表达。与对照组相比,TLR4在糖尿病大鼠牙周膜中的表达更强;在牙龈中TLR4的表达仅局限于牙龈上皮中,相比于对照组表达明显上调;在对照组牙槽骨中TLR4的表达较低,而在糖尿病大鼠牙槽骨中TLR4的表达明显增强且更为广泛(图3)。通过半定量分析对染色组织进行评分,TLR4蛋白在正常大鼠牙周膜、牙龈、牙槽骨中的表达评分均为1。在糖尿病大鼠牙周膜、牙龈、牙槽骨中的表达评分分别为2、3、3。
p-P65在对照组的牙周组织中均无表达,在糖尿病大鼠牙周膜和牙槽骨中均出现较为明显的表达,而在糖尿病大鼠牙龈组织中不表达(图4)。通过半定量分析对染色组织进行评分,p-P65蛋白在正常大鼠牙周膜、牙龈、牙槽骨中的表达评分均为0,在糖尿病大鼠牙周膜、牙龈、牙槽骨中的表达评分分别为1、0、2。
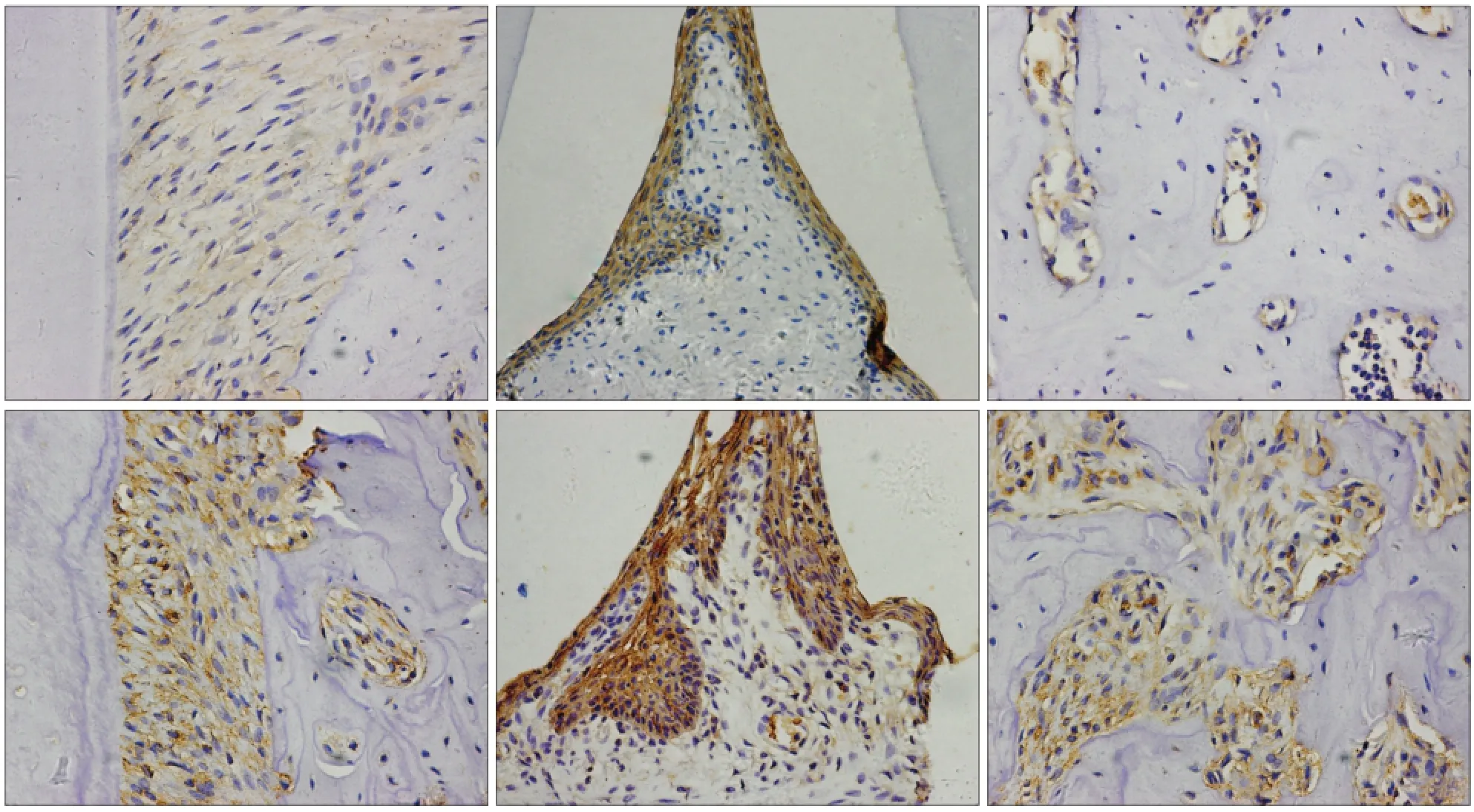
图3 TLR4蛋白在糖尿病和正常大鼠牙周中的表达 免疫组织化学染色 × 400Fig 3 The expression of TLR4 in the periodontium of diabetic and control rats immunohistochemical staining × 400

图4 p-P65蛋白在糖尿病和正常大鼠牙周中的表达 免疫组织化学染色 × 400Fig 4 The expression of p-P65 in the periodontium of diabetic and control rats immunohistochemical staining × 400
3 讨论
本研究发现,在糖尿病大鼠的牙周组织中,牙槽骨吸收明显增加,骨小梁稀疏,且与牙周膜结合的硬骨板破坏;免疫组织化学染色结果显示S100A9表达显著上调,TLR4和NF-κB信号活化水平显著增加。研究[10]发现S100A9/A8复合物激活NF-κB信号通路,而本实验组检测到的TLR4和NF-κB/p-P65在糖尿病大鼠牙周组织中激活,推测S100A9蛋白高表达可能通过激活NF-κB和TLR4信号通路促进牙周炎症的发生,增加牙槽骨的骨吸收。
以往研究表明,糖尿病会引起成骨细胞的分化功能障碍[11],导致下颌骨骨密度降低[12],糖尿病引起的S100A9表达水平增加与炎症密切相关[13],并且可能通过TLR4[14]和NF-κB[5]信号通路发挥作用。已有研究[15]发现在S100A9敲除的小鼠体内,通过抗原诱导形成的骨关节炎模型中骨吸收明显被抑制,据此推测糖尿病导致的牙周结构的改变可能是与S100A9介导的炎症反应和S100A9对骨吸收的促进有关。在目前的临床案例中,糖尿病和牙周炎关系密切,而且糖尿病患者会有更高的概率患牙周炎。有研究[16]表明高血糖会诱导骨髓髓系祖细胞的增殖和扩增,释放单核细胞进入血液循环,并且会促进中心粒细胞分泌S100A8/A9蛋白。本研究糖尿病大鼠模型中,单是从牙周组织来看,牙周被严重破坏,推测糖尿病大鼠牙槽骨骨髓腔单核细胞会被激活分泌S100A9蛋白,并释放到牙周组织中,促使牙周组织中细胞炎性发生,促进破骨细胞分化,加强牙槽骨中破骨性骨吸收,而糖尿病大鼠的牙龈上皮中S100A9高表达是组织被细菌侵入,S100A9表达的增强有着微生物抵抗的作用[6],实验中S100A9在牙龈上皮中的表达很高,可能预示着糖尿病大鼠的牙龈已被微生物感染;S100A9的内源性配体TLR4,作为牙周炎中牙龈上皮表达的信号蛋白[17],检测到的TLR4在牙龈中的高表达也有文献证实,高糖的环境会促使牙龈中TLR4的表达上调,在局部的炎症环境中TLR4的表达增强还会促进糖尿病患者更容易患上牙周炎[18]。通过对S100A9、TLR4、p-P65在牙周膜、牙龈和牙槽骨中表达的半定量分析发现,在实验组动物中三者的表达有明显相似的趋势,推测S100A9蛋白可能通过激活TLR4表达使牙槽骨的破骨性吸收加重。
本研究通过构建糖尿病大鼠模型,研究糖尿病对牙周结构的影响,并检测牙周组织中S100A9蛋白的表达,以及TLR4和NF-κB/p-P65在牙周组织中的表达。本研究结果表明,S100A9可能通过激活TLR4的表达增强牙槽骨的破骨性骨吸收,同时通过激活NF-κB信号通路促进牙周炎症的发生,本研究结果可为糖尿病导致的牙周病变的临床治疗提供药物靶点,可能会为改善糖尿病导致的牙周病变提供新的治疗靶点。
[1] Lalla E, Papapanou PN. Diabetes mellitus and periodontitis: a tale of two common interrelated diseases[J]. Nat Rev Endocrinol, 2011, 7(12):738-748.
[2] Ajita M, Karan P, Vivek G, et al. Periodontal disease and type 1 diabetes mellitus: associations with glycemic control and complications: an Indian perspective[J]. Diabetes Metab Syndr, 2013, 7(2):61-63.
[3] Sunahori K, Yamamura M, Yamana J, et al. The S100A8/ A9 heterodimer amplifies proinflammatory cytokine production by macrophages via activation of nuclear factor kappa B and p38 mitogen-activated protein kinase in rheumatoid arthritis[J]. Arthritis Res Ther, 2006, 8(3):R69.
[4] Schiopu A, Cotoi OS. S100A8 and S100A9: DAMPs at the crossroads between innate immunity, traditional risk factors,and cardiovascular disease[J]. Mediators Inflamm, 2013,2013:828354.
[5] Zheng Y, Hou J, Peng L, et al. The pro-apoptotic and proinflammatory effects of calprotectin on human periodontal ligament cells[J]. PLoS ONE, 2014, 9(10):e110421.
[6] Nishii K, Usui M, Yamamoto G, et al. The distribution and expression of S100A8 and S100A9 in gingival epithelium of mice[J]. J Periodont Res, 2013, 48(2):235-242.
[7] Heizmann CW, Ackermann GE, Galichet A. Pathologies involving the S100 proteins and RAGE[J]. Subcell Biochem,2007, 45:93-138.
[8] Yin LM, Jiang GH, Wang Y, et al. Use of serial analysis of gene expression to reveal the specific regulation of gene expression profile in asthmatic rats treated by acupuncture [J]. J Biomed Sci, 2009, 16:46.
[9] Ghavami S, Rashedi I, Dattilo BM, et al. S100A8/A9 at low concentration promotes tumor cell growth via RAGE ligation and MAP kinase-dependent pathway[J]. J Leukoc Biol,2008, 83(6):1484-1492.
[10] Hermani A, De Servi B, Medunjanin S, et al. S100A8 and S100A9 activate MAP kinase and NF-kappaB signaling pathways and trigger translocation of RAGE in human prostate cancer cells[J]. Exp Cell Res, 2006, 312(2):184-197.
[11] 吴璇, 刘洪臣, 鄂玲玲, 等. 糖尿病大鼠下颌骨成骨细胞葡萄糖转运蛋白-1及胰岛素受体α1的表达[J]. 华西口腔医学杂志, 2011, 29(4):348-350, 354. Wu X, Liu HC, E LL, et al. Expression of glucose transporter-1 and insulin receptor α1 in osteoblast obtained from diabetic rats'mandibles[J]. West Chin J Stomatol, 2011, 29(4):348-350, 354.
[12] 刘梅, 张君, 王旭霞. 糖尿病大鼠牙槽骨骨密度与全身骨密度变化的相关实验研究[J]. 华西口腔医学杂志, 2009,27(4):451-454. Liu M, Zhang J, Wang XX. A relevant experimental study of alveolar and systemic bone mineral density changes in diabetes rats[J]. West Chin J Stomatol, 2009, 27(4):451-454.
[13] Vogl T, Eisenblätter M, Völler T, et al. Alarmin S100A8/ S100A9 as a biomarker for molecular imaging of local inflammatory activity[J]. Nat Commun, 2014, 5:4593.
[14] Gao H, Zhang X, Zheng Y, et al. S100A9-induced release of interleukin (IL)-6 and IL-8 through toll-like receptor 4 (TLR4) in human periodontal ligament cells[J]. Mol Immunol, 2015, 67(2 Pt B):223-232.
[15] Grevers LC, de Vries TJ, Vogl T, et al. S100A8 enhances osteoclastic bone resorption in vitro through activation of Toll-like receptor 4: implications for bone destruction in murine antigen-induced arthritis[J]. Arthritis Rheum, 2011,63(5):1365-1375.
[16] Nagareddy PR, Murphy AJ, Stirzaker RA, et al. Hyperglycemia promotes myelopoiesis and impairs the resolution of atherosclerosis[J]. Cell Metab, 2013, 17(5):695-708.
[17] Promsudthi A, Poomsawat S, Limsricharoen W. The role of Toll-like receptor 2 and 4 in gingival tissues of chronic periodontitis subjects with type 2 diabetes[J]. J Periodont Res, 2014, 49(3):346-354.
[18] Yang X, Zhang J, Ni J, et al. Toll-like receptor 4-mediated hyper-responsiveness of gingival epithelial cells to lipopolysaccharide in high-glucose environments[J]. J Periodontol,2014, 85(11):1620-1628.
(本文编辑杜冰)
Expression and effect of S100A9 in the periodontium of diabetic rats
Sun Wenhua1,2,3, Chen Guoqing2,3, Tian Weidong2,3. (1. College of Life Science, Sichuan University, Chengdu 610065, China; 2. State Key Laboratory of Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China; 3. National Engineering Laboratory for Oral Regenerative Medicine, Sichuan University, Chengdu 610041, China)
Supported by: The National Natural Science Foundation of China (81271119); Basic Research Program of Sichuan Province (2013JY0019). Correspondence: Tian Weidong, E-mail: drtwd@sina.com.
ObjectiveThe study seeks to investigate the expression of S100A9 and its potential role in periodontal diseases induced by diabetes. MethodsA diabetic SD rat model was established through intraperitoneal injection of streptozotocin (STZ). Hematoxylin-eosin (HE) staining was performed to study the structure of the periodontium of diabetic rats. Using immunohistochemical staining, the distribution of S100A9 expression was detected in the periodontium of diabetic rats. Expressions of Toll-like receptor 4 (TLR4) (ligands of S100A9) and p-P65/nuclear factor κB (NF-κB) were also measured. ResultsThe trabecular structure of alveolar bone was sparser, and lamina dura was disappeared in diabetic rats. Obviously higher expressions of S100A9 were observed in the periodontal ligament, alveolar bone, and gingival epithelial of diabetic rats than in the control rats. TLR4 expressions in the periodontal ligament, alveolar bone and gingival epithelial of the diabetic rats were also higher as compared to the control rats. p-P65 expression was not detected in the control rats, but was detected in the periodontal ligament and alveolar bone of the diabetic rats. ConclusionPeriodontium lesions in diabetes mellitus may be induced by the activation of TLR4 and NF-κB signaling pathway meditated by S100A9.
S100A9;periodontal lesion;diabetes;Toll-like receptor 4;nuclear factor κB
R 781.4
A
10.7518/hxkq.2016.04.020
2016-01-18;
2016-05-10
国家自然科学基金(81271119);四川省应用基础研究项目(2013JY0019)
孙文华,硕士,E-mail:whsun91@163.com
田卫东,教授,博士,E-mail:drtwd@sina.com

