条斑紫菜不同栽培品系的遗传多样性分析*
杨立恩,韩晓磊,周 伟,邓银银,许广平,胡传明,朱建一,陆勤勤**,徐建国
(1.江苏省海洋水产研究所,江苏南通 226007;2.常熟理工学院,江苏常熟 215500;3.江苏省海洋渔业指挥部,江苏南通 226000)
条斑紫菜不同栽培品系的遗传多样性分析*
杨立恩1,韩晓磊2,周伟1,邓银银1,许广平1,胡传明1,朱建一2,陆勤勤1**,徐建国3
(1.江苏省海洋水产研究所,江苏南通226007;2.常熟理工学院,江苏常熟215500;3.江苏省海洋渔业指挥部,江苏南通226000)
2.Changshu Institute of Technology,Changshu,Jiangsu,215500,China;3.Marine Fisheries Dispatching Department of Jiangsu,Nantong,Jiangsu,226000,China)
【目的】确定通过杂交和突变选育出的条斑紫菜(Pyropia yezoensis)栽培品系的遗传多样性。【方法】采用简单重复序列区间(Inter simple sequence repeat,ISSR)、扩增片段长度多态性(Amplified fragment length polymorphism,AFLP)和随机扩增多态性DNA(Random amplified polymorphism DNA,RAPD)等3种分子标记对条斑紫菜不同栽培品系进行遗传多样性分析。【结果】3种分子标记的多态性比率分别为38.10%、38.95%和61.75%;所表现出来的不同栽培品系间遗传距离分别为0.1785,0.1029和0.2845;3种分子标记聚类结果并不完全一致,但可以看出Y-0602、Y-HA01和Y-H001总是聚类在一起,而Y-DL02倾向于单独聚为一支。【结论】通过诱变和杂交所选育的品系,在遗传角度上仍然属于条斑紫菜,但已形成不同栽培品系,具有一定的遗传多样性。
条斑紫菜遗传距离分子标记栽培品系
0 引言
【研究意义】条斑紫菜(Pyropia yezoensis)是我国长江以北地区的主要紫菜栽培物种[1]。江苏是我国条斑紫菜主产区,其产业规模和产量均占全国条斑紫菜的97%以上,行业年产值超过50亿元。江苏省海洋水产研究所国家级紫菜种质库长期从事条斑紫菜遗传育种工作,不仅保存有大量的条斑紫菜基础种质,而且还以此为基础进行诱变、筛选、纯化、扩增与保存等有关条斑紫菜优良品系选育方面的工作,所选育的优良品系长期应用于江苏省紫菜产业,良种覆盖率达到30%以上,对产业的稳定起到不可忽视的作用。因此,鉴定这些基础种质和选育品系之间在分子遗传学水平上的关系至关重要。【前人研究进展】分子标记被广泛用于遗传多样性分析、品种和种质鉴定以及种群亲缘关系等方面的研究。常用的分子标记有简单重复序列区间(Inter simple sequence repeat,ISSR)、扩增片段长度多态性(Amplified fragment length polymorphism,AFLP)和随机扩增多态性DNA(Random amplified polymorphism DNA,RAPD)。这3种分子标记所需DNA样品量少,无需预先知道受试基因组DNA信息,结果记录方便,并可通过0/1矩阵计算遗传距离、遗传相似性指数、聚类分析等参数,因而被广泛应用于紫菜栽培品系鉴定和遗传多样性的研究工作中[2-18]。【本研究切入点】不同的分子标记各有优劣,所表现出来的多态性也会在具体数据上有所差异,但得出的一致结论可能更加可靠,因此本研究同时应用ISSR、AFLP和RAPD 3种分子标记检测不同选育品系间的遗传多样性。【拟解决的关键问题】通过品系间遗传距离的比较和聚类分析,确定诱变和杂交所选育出的品系在遗传角度上是否仍然属于条斑紫菜。
1 材料与方法
1.1材料
本研究所采用的条斑紫菜为江苏省海洋水产研究所国家级紫菜种质库所保存的野生条斑紫菜种质和长期选育的栽培品系(表1),材料取自研究所与紫菜栽培企业合作建设的新品系栽培示范基地。按照Yang等[19]所述方法提取叶状体基因组DNA,所提取DNA用1%(W/V)琼脂糖凝胶电泳检测后,-20℃保存备用。
1.2方法
1.2.1ISSR扩增
ISSR引物为British Columbia大学公布的第9套引物,由上海生工生物工程有限公司合成。MgCl2、dNTP、rTaq DNA聚合酶等试剂购自Takara公司。PCR反应在Biometra PCR仪上进行。针对多态性较高的引物,则先对MgCl2、dNTP浓度,引物的退火温度等因子进行优化,选用优化后的参数进行扩增反应。用混合DNA模板对100条引物进行扩增筛选,反应体系为25 μL,内含2 mmol/L MgCl2,0.2 mmol/L dNTP,0.2 μmol/L引物,约20 ng的DNA模板和1 U rTaq酶。PCR扩增反应程序:94℃预变性3 min;94℃变性30 s,54℃退火45 s,72℃延伸90 s,35个循环;最后72℃延伸5 min。选择多态性高的引物对每个样品基因组DNA进行扩增,扩增产物用1.5%(W/V)琼脂糖凝胶电泳检测,用凝胶成像仪(Biorad)观察结果并拍照记录。
表1实验所用的紫菜栽培品系
Table 1Cultivars used in the present study

品系Cultivar来源SourceYQD1993年采自于青岛的野生条斑紫菜品系WildcultivarcollectedfromQingdaoin1993YDL01大连条斑紫菜野生种群选育品系(2013年)BreedingcultivarwithgrowthadvantagefrompopulationcollectedfromDalianin2013YDL02大连条斑紫菜野生种群选育品系(2014年)BreedingcultivarwithgrowthadvantagefrompopulationcollectedfromDalianin2014Y0601种藻经60Coγ诱变、高光胁迫筛选后于适温栽培海区选育(2003年)Cultivarscreenedbyhighlightstressinmoderatetemperaturecoastafterbeingmutatedby60Coγsince2003Y0602种藻经60Coγ诱变、高光胁迫筛选后于低温栽培海区选育(2003年)Cultivarscreenedbyhighlightstressinlowtemperaturecoastafterbeingmutatedby60Coγsince2003Y06D0具生长优势的栽培群体经60Coγ诱变选育(南通,2003年)Breedingcultivarofmutatedpopulationswithgrowthadvantageby60CoγinNantongin2003YHA01海安条斑紫菜栽培海区选育品系(2011年)BreedingcultivarofgrowthadvantagepopulationcollectedfromcultivationcoastinHai’anin2011YH001条斑紫菜与坛紫菜杂交重组的黑色丝状体选育品系BreedingcultivarfromblackconchocelisafterhybridizationofP.yezonesisandP.haitanensisYH002条斑紫菜与坛紫菜杂交重组的红色丝状体选育品系BreedingcultivarfromredconchocelisafterhybridizationofP.yezonesisandP.haitanensis
1.2.2AFLP扩增
取各品系基因组DNA 100 ng,用EcoR Ⅰ和Mse Ⅰ(20 μL体系)在37℃水浴条件下酶切3 h,酶切片段与EcoR Ⅰ和Mse Ⅰ接头在T4连接酶的作用下(25 μL体系)18℃水浴条件下连接过夜。EcoRⅠ接头序列:5′-CTCGTAGACTGCGTACC-3′和5′-CTGACGCATGGTTAA-3′;Mse Ⅰ接头序列:5′-GACGATGAGTCCTGAG-3′和5′-TACTCAGGACTCAT-3′。取酶切连接产物5 μL用于预扩增,预扩增引物3′端带有1个选择性碱基,引物序列为E01:5′-GACTGCGTACCAATTCA-3′和M02:5′-GATGAGTCCTGAGTAAC-3′,50 μL PCR反应体系含有1.5 mmol/L MgCl2,0.2 mmol/L dNTP,1 U rTaq酶,0.2 μmol/L引物,20 ng DNA模板。PCR反应程序:95℃预变性3 min;95℃ 30 s,56℃ 30 s,72℃ 60 s,20个循环;72℃ 60 s延伸。PCR产物4℃保存。预扩增产物1∶15(V/V)稀释后,用于选择性扩增,选择性扩增引物3′端带有3个选择性碱基,选取6对引物进行扩增。PCR反应程序:95℃预变性3 min,95℃ 30 s,65℃ 30 s,降落PCR,每个循环退火温度降低0.7℃,12个循环后,95℃ 30 s,56℃ 30 s,72℃ 60 s,8个循环,72℃ 60 s延伸。取选择性扩增产物10 μL于PCR仪上95℃变性2 min,迅速取出置于冰上使其保持变性状态,在4.5%(V/V)的变性聚丙烯酰胺凝胶上电泳检测:电泳缓冲液为1×TBE,保持60 W恒定功率;在不加样品的情况下先预电泳30 min,然后将尿素吹净,在点样孔加入样品,电泳至第一条loading buffer指示剂到玻璃板底部时结束电泳。银染参考韩晓磊等[20]方法进行。
1.2.3RAPD扩增
用混合DNA模板从300条RAPD引物中筛选出多态性较高的引物,设计正交试验优化rTaq酶、dNTP、引物和Mg2+的浓度,确定PCR反应体系为25 μL,含有1.5 U rTaq酶,5% (V/V)DMSO,0.25 mmol/L dNTP,2 mmol/L MgCl2,0.2 μmol/L 引物,20 ng DNA模板;梯度PCR(33~43℃)优化每条引物的退火温度。PCR扩增程序:94℃预变性5 min;94℃ 45 s,最佳退火温度 45 s,72℃ 90 s,40个循环;然后72℃延伸10 min。选择多态性高的引物对每个样品基因组DNA进行扩增,产物用1.5%(W/V)琼脂糖凝胶电泳,凝胶成像仪观察结果并拍照记录。
1.2.4图谱分析
根据琼脂糖凝胶或者聚丙烯酰胺凝胶电泳图谱,将图谱上某一位置出现的条带记为1,缺失的条带记为0,强带和弱带均记为1,只记录重复性好的条带,得出0/1原始数据矩阵。研究使用的遗传学参数主要有:
多态位点比率P=多态位点数/位点总数×100%,
遗传相似性系数Sxy=2Nxy/(Nx+Ny),
遗传距离D=1-S,
其中:ni为i位点上有带的品系数,n为总品系数;Nxy为品系x和品系y共有的位点数,Nx和Ny分别为x和品系y的总位点数;S为相似系数。
利用PopGen32计算遗传相似度、遗传距离和遗传多样性;利用Arlequin进行AMOVA分析;利用MEGA5.0构建UPGMA系统树。
2 结果与分析
2.1ISSR分子标记结果
2.1.1ISSR扩增结果
本试验筛选出7个ISSR引物,对不同栽培品系DNA样品进行PCR扩增,7个ISSR引物扩增出位点数目为3~12,共扩增产生52个可统计的位点,其中31个位点为9个品系所共有的ISSR标记位点,共有位点百分率为59.62%(表2)。
表2ISSR引物在栽培品系间的扩增情况
Table 2Amplification pattern of ISSR between different cultivars
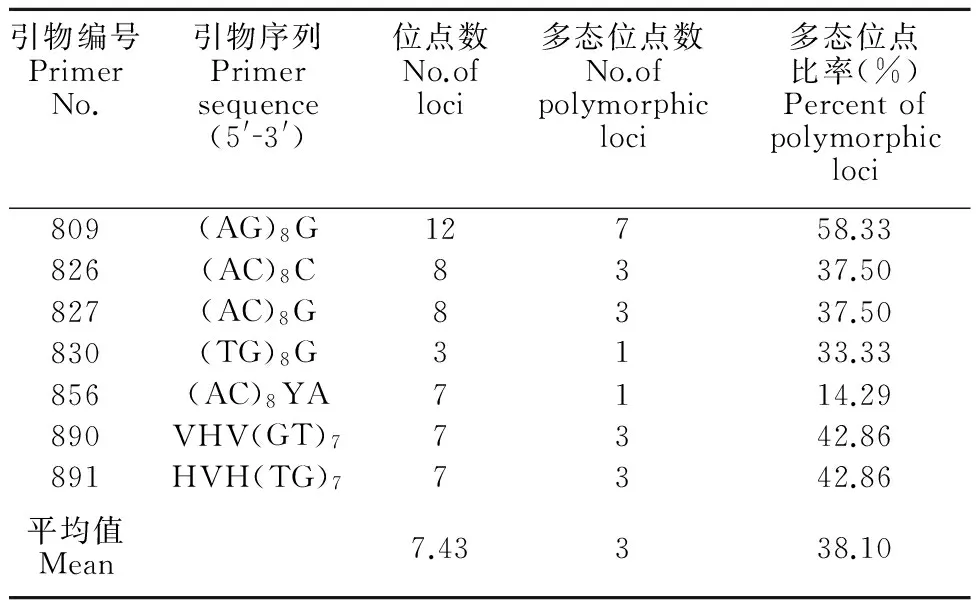
引物编号PrimerNo.引物序列Primersequence(5'3')位点数No.ofloci多态位点数No.ofpolymorphicloci多态位点比率(%)Percentofpolymorphicloci809(AG)8G12758.33826(AC)8C8337.50827(AC)8G8337.50830(TG)8G3133.33856(AC)8YA7114.29890VHV(GT)77342.86891HVH(TG)77342.86平均值Mean7.43338.10
2.1.2品系间的遗传多样性
在52个扩增位点中,多态位点为21条,多态位点比率为40.38%。不同品系间的平均遗传距离为0.1785,平均Shannon’s指数为0.1143,平均杂合度不大(0.2164)。条斑紫菜不同栽培品系两两间的遗传距离为0.0594~0.3403(表3)。
表3不同栽培品系两两间的遗传距离
Table 3Pairwise genetic distance between different screened cultivars
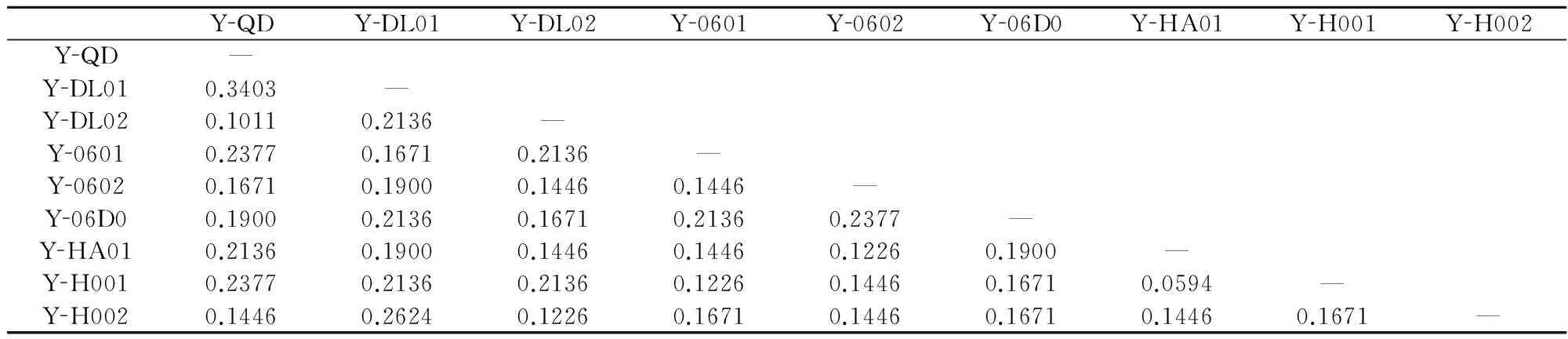
YQDYDL01YDL02Y0601Y0602Y06D0YHA01YH001YH002YQD—YDL010.3403—YDL020.10110.2136—Y06010.23770.16710.2136—Y06020.16710.19000.14460.1446—Y06D00.19000.21360.16710.21360.2377—YHA010.21360.19000.14460.14460.12260.1900—YH0010.23770.21360.21360.12260.14460.16710.0594—YH0020.14460.26240.12260.16710.14460.16710.14460.1671—
2.1.3聚类分析
基于ISSR遗传距离,采用MEGA5.0软件构建9个栽培品系的UPGMA系统树(图1)。从聚类结果可以看出,Y-QD、Y-DL02、Y-H002和Y-06D0聚在一个分支内,Y-0601、Y-HA01、Y-H001和Y-0602聚为另一个分支,Y-DL01单独聚为一支。

图1基于ISSR遗传距离构建的栽培品系UPGMA系统树
Fig.1UPGMA dendrogram of 9 screened cultivars reconstructed by ISSR genetic distance
2.2AFLP结果
2.2.1AFLP扩增结果
使用6对不同引物对,从9个栽培品系的DNA样品中共检出190个不同长度的位点(表4)。对190个位点进行统计发现,9个栽培品系共有的AFLP标记位点有116个(共有位点百分比为61.05%)。不同引物的扩增结果存在差异,产生的位点从24到42不等,扩增出的多态位点为4~17条,多态位点比率为16.67%~53.57%。另外,从表4可见各引物组合的总位点数差异不显著(P>0.05)。
表4不同AFLP引物对的扩增结果
Table 4Number of bands generated by AFLP primer combinations
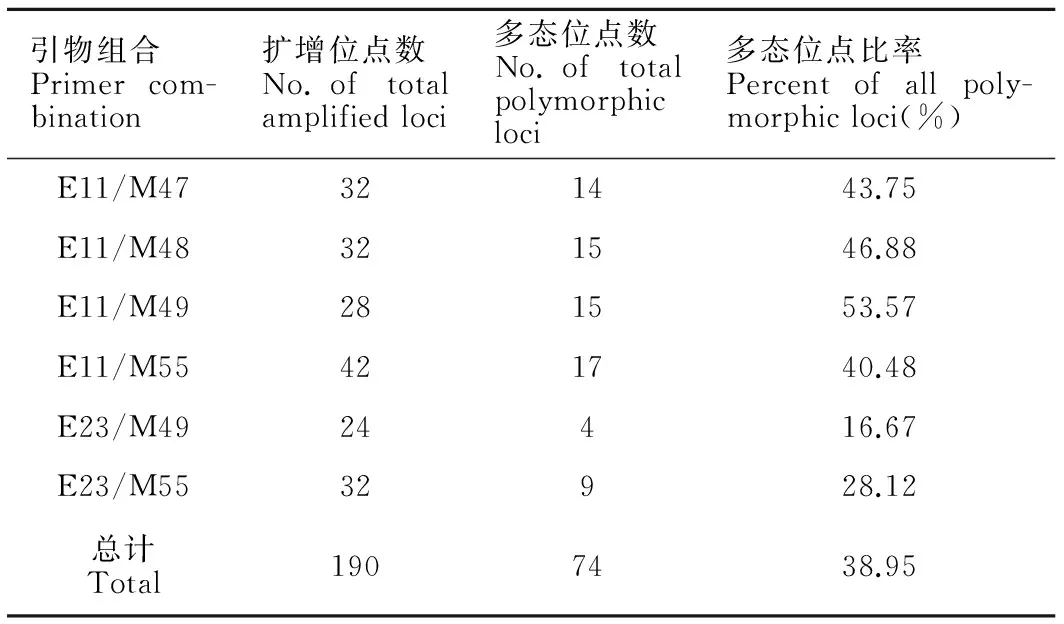
引物组合Primercom-bination扩增位点数No.oftotalamplifiedloci多态位点数No.oftotalpolymorphicloci多态位点比率Percentofallpoly-morphicloci(%)E11/M47321443.75E11/M48321546.88E11/M49281553.57E11/M55421740.48E23/M4924416.67E23/M5532928.12总计Total1907438.95
Note:E11:5′-GACTGCGTACCAATTCAA-3′;E23:5′-GACTGCGTACCAATTCTA-3′;M47:5′-GATGAGTCCTGAGTAACAA-3′;M48:5′-GATGAGTCCTGAGTAACAC-3′;M49:5′-GATGAGTCCTGAGTAACAG-3′;M55:5′-GATGAGTCCTGAGTAACGA-3′
2.2.2品系间的遗传多样性
在190个扩增位点中,多态位点为74个,多态位点比率为38.95%。不同栽培品系间遗传相似度和遗传距离分别为0.8971和0.1029,品系间的Shannon’s指数为0.2101,平均杂合度为0.1406。条斑紫菜不同栽培品系两两间遗传距离为0.0402~0.1571(表5)。
表5不同栽培品系两两间的遗传距离
Table 5Pairwise genetic distance between different screened cultivars
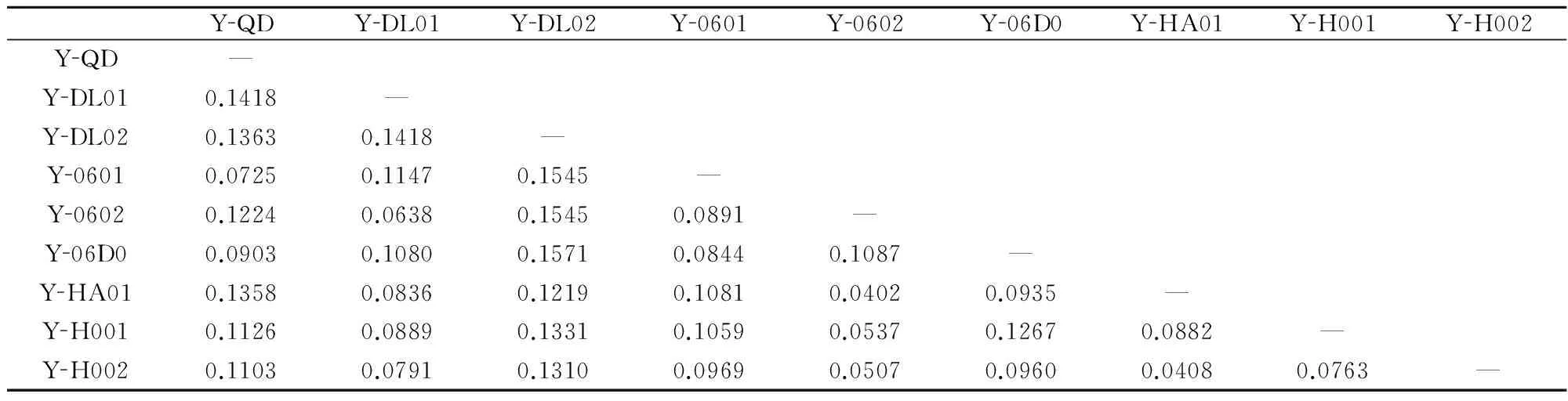
YQDYDL01YDL02Y0601Y0602Y06D0YHA01YH001YH002YQD—YDL010.1418—YDL020.13630.1418—Y06010.07250.11470.1545—Y06020.12240.06380.15450.0891—Y06D00.09030.10800.15710.08440.1087—YHA010.13580.08360.12190.10810.04020.0935—YH0010.11260.08890.13310.10590.05370.12670.0882—YH0020.11030.07910.13100.09690.05070.09600.04080.0763—
2.2.3聚类分析
基于AFLP遗传距离,利用MEGA5.0软件构建栽培品系的UPGMA系统树(图2)。从聚类结果可以看出,Y-DL02单独聚类,Y-QD、Y-0601、Y-06D0聚为一个分支,Y-DL01、Y-0602、Y-HA01、Y-H001和Y-H002聚类在一起。

图2基于AFLP遗传距离构建的栽培品系UPGMA系统树
Fig.2UPGMA dendrogram of screened cultivars reconstructed by AFLP genetic distance
2.3RAPD结果
2.3.1RAPD扩增结果
本试验筛选出27个RAPD引物,对9个栽培品系的DNA样品进行PCR扩增,27个RAPD引物扩增出5~18位点,共扩增产生274个可统计的位点,其中不同栽培品系共有的RAPD标记位点有102条(共有位点百分比为37.23%)(表6)。
2.3.2品系间遗传多样性
在274个扩增位点中,多态位点为172条,多态位点比率为62.77%;栽培品系间的平均遗传距离、Shannon’s指数和平均杂合度分别为0.2845,0.3281和0.2174。条斑紫菜不同栽培品系两两间的遗传距离为0.1535~0.5072(表7)。
2.3.3聚类分析
基于RAPD遗传距离,采用MEGA5.0软件构建条斑紫菜9个栽培品系的UPGMA系统树(图3)。从图中可以看出,Y-DL02与其他品系分开聚类,Y-0601、Y-0602、Y-06D0、Y-HA01、Y-H001和Y-H002聚类在一起。
表6RAPD引物在栽培品系间的扩增情况
Table 6Amplification pattern of RAPD primers between different cultivars
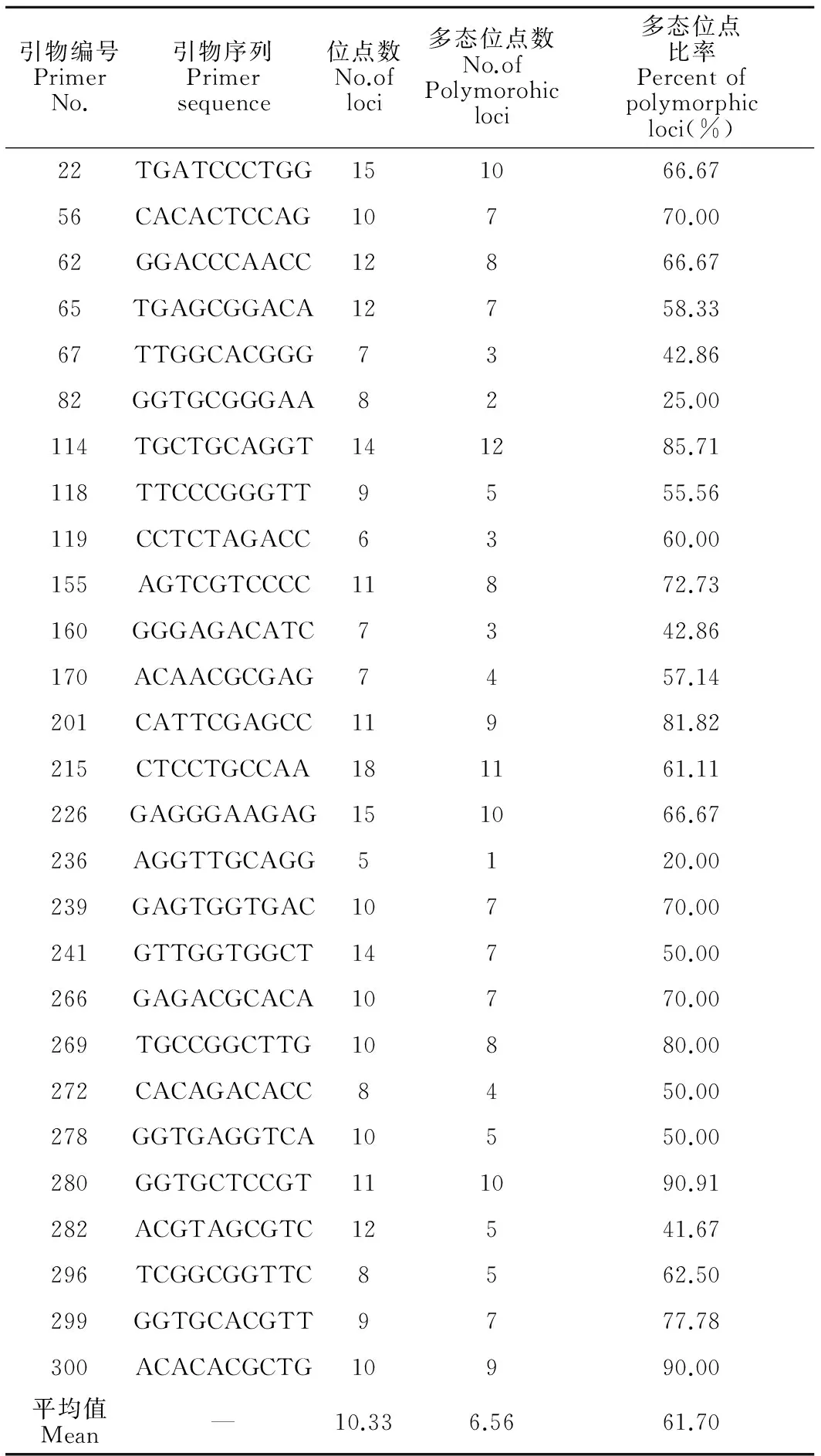
引物编号PrimerNo.引物序列Primersequence位点数No.ofloci多态位点数No.ofPolymorohicloci多态位点比率Percentofpolymorphicloci(%)22TGATCCCTGG151066.6756CACACTCCAG10770.0062GGACCCAACC12866.6765TGAGCGGACA12758.3367TTGGCACGGG7342.8682GGTGCGGGAA8225.00114TGCTGCAGGT141285.71118TTCCCGGGTT9555.56119CCTCTAGACC6360.00155AGTCGTCCCC11872.73160GGGAGACATC7342.86170ACAACGCGAG7457.14201CATTCGAGCC11981.82215CTCCTGCCAA181161.11226GAGGGAAGAG151066.67236AGGTTGCAGG5120.00239GAGTGGTGAC10770.00241GTTGGTGGCT14750.00266GAGACGCACA10770.00269TGCCGGCTTG10880.00272CACAGACACC8450.00278GGTGAGGTCA10550.00280GGTGCTCCGT111090.91282ACGTAGCGTC12541.67296TCGGCGGTTC8562.50299GGTGCACGTT9777.78300ACACACGCTG10990.00平均值Mean—10.336.5661.70
表7不同栽培品系两两间的遗传距离
Table 7Pairwise genetic distance between different screened cultivars
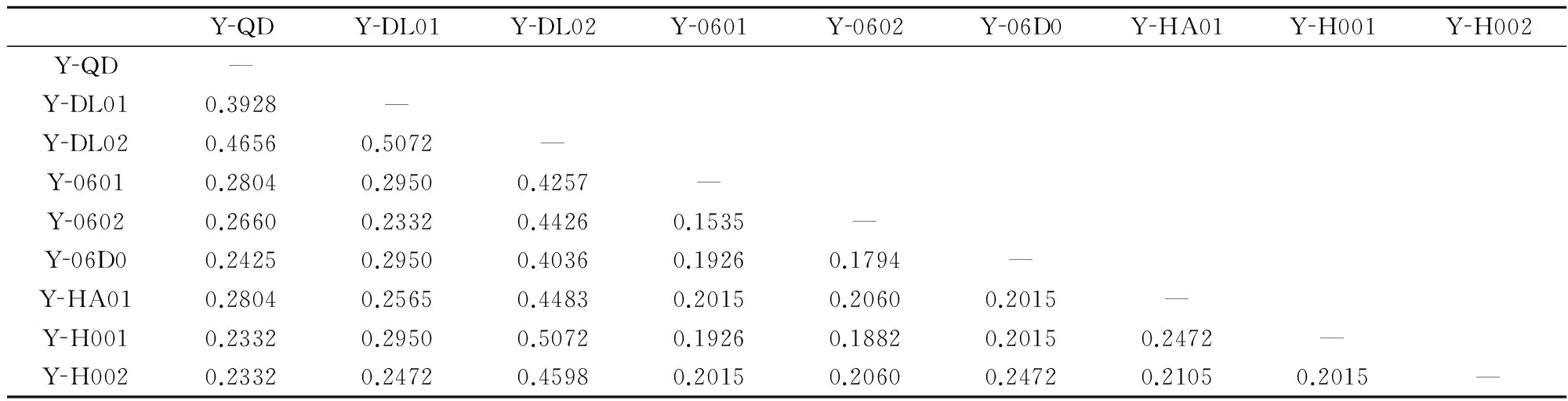
YQDYDL01YDL02Y0601Y0602Y06D0YHA01YH001YH002YQD—YDL010.3928—YDL020.46560.5072—Y06010.28040.29500.4257—Y06020.26600.23320.44260.1535—Y06D00.24250.29500.40360.19260.1794—YHA010.28040.25650.44830.20150.20600.2015—YH0010.23320.29500.50720.19260.18820.20150.2472—YH0020.23320.24720.45980.20150.20600.24720.21050.2015—

图3基于RAPD遗传距离构建的栽培品系UPGMA系统树
Fig.3UPGMA dendrogram of cultivars reconstructed by RAPD genetic distance
3 讨论
ISSR、AFLP和RAPD都是在PCR的基础上发展出来的分子标记技术,之前的研究证明这3种不同的分子标记均可用于紫菜品系鉴定、遗传多样性分析等[7,15]。其中ISSR标记因其随机引物末端带有锚定碱基,既有高多态性又有较高稳定性; AFLP虽然实验成本高、实验步骤繁琐复杂、技术要求高等,然而实验结果稳定可靠、重复性好;RAPD技术是发展较早的分子标记,因其多态性高、简单快捷等特点,被认为适用于种质库鉴定、管理工作。陈淑吟等[21]认为通过多个分子标记组合使用即能得到可靠的结论。本研究用ISSR、AFLP和RAPD 3种分子标记研究紫菜不同栽培品系遗传多样性,结果显示不同品系之间平均遗传距离分别为0.1785,0.1029和0.2845。造成这一结果的原因可能与不同的分子标记所表现出来的多态性不同有关,另一个可能原因是引物组合的多寡也会引起一定的遗传距离变化。因此,使用不同的分子标记虽然会在具体数据上表现出一定差异,但得出的一致结论可能更加可靠。
本研究ISSR分子标记得出的不同条斑紫菜栽培品系之间遗传距离为0.0594~0.3403(表3),这一结果比陈昌生等[8]所得出的野生坛紫菜种群间遗传距离(0.0414~0.052)和陈淑吟等[21]所得出的条斑紫菜不同丝状体种质间遗传距离(0.0392~0.0981)大,但比谢潮添等[15]所得出的坛紫菜不同色泽丝状体栽培品系间的遗传距离(0.4410~0.7655)和袁昭岚等[18]所得出的条斑紫菜不同栽培品系之间遗传距离(0.3897~0.4469)小。这一结果可能说明本实验所研究的不同条斑紫菜栽培品系,包括条斑紫菜和坛紫菜“杂交”选育的Y-H001、Y-H002和诱变选育的Y-0601、Y-0602、Y-06D0等品系,在基因水平上仍然属于条斑紫菜,经过诱变选育,提高种质遗传多样性,形成不同品系,但仍然需要进一步选育以阻止栽培种质退化。本实验AFLP结果得出条斑紫菜不同栽培品系间遗传距离为0.0402~0.1571(表5),比陈奕欣等[7]得出的福建海区坛紫菜不同栽培种群之间遗传距离(0.264~0.398)和杨锐等[17]得出的野生坛紫菜不同地理种群和表型种群之间遗传距离(0.2318~0.6023)小。这一结果不仅证明条斑紫菜不同栽培品系仍需进一步选育以继续增大种质遗传多样性,也反应出条斑紫菜和坛紫菜两个物种之间的区别[6]。本实验RAPD结果得出条斑紫菜不同栽培品系之间的平均遗传距离为0.2845,这一结果与徐涤等[16]得出的条斑紫菜两个品系(0.32)和坛紫菜两个品系之间(0.31)的遗传距离相似,但比陈骁等[6]得出的条斑紫菜两个品系(0.029)和坛紫菜不同品系之间的遗传距离(0.174)大。综合3种分子标记所得的遗传距离分析,本实验所研究的不同选育栽培品系,在遗传角度仍然属于条斑紫菜,但经过杂交或诱变选育后,遗传距离介于种内和品系间,已形成不同的栽培品系,在为生产提供良种确保栽培生产稳定的同时,提高条斑紫菜种质遗传多样性,确保条斑紫菜栽培种质不退化。同时通过比较发现,条斑紫菜不同品系(种群)间遗传距离与坛紫菜不同品系(种群)间遗传距离相比较小。
ISSR、AFLP和RAPD对不同条斑紫菜栽培品系的聚类分析结果显示,3个聚类树并不严格一致(图1~3),一方面表明不同分子标记之间的差异,另一方面也为所研究的不同品系亲缘关系较近,仍属条斑紫菜提供证据。从聚类分析的结果中可以看出,品系Y-0602、Y-HA01和Y-H001总是聚在一起,而Y-DL02更倾向于聚类在独立分支,可能与各个栽培选育品系亲本来源有关系。
[1]胡传明,王丹青,王锡昌,等.条斑紫菜与坛紫菜挥发性风味的电子鼻分析[J].广西科学,2016,23(2):138-143.
HU C M,WANG D Q,WANG X C,et al.Odors analysis of Pyropia yezoensis and Pyropia haitanensis by electronic nose[J].Guangxi Sciences,2016,23(2):138-143.
[2]NIWA K,KIKUCHI N,HUWANG M S,et al.Cryptic species in the Pyropia yezoensis complex (Bangiales,Rhodophyta):Sympatric occurrence of two cryptic species even on same rocks[J].Phycological Research,2014,62:36-43.
[3]SONG L S,DUAN D L,LI X H,et al.Use of RAPD for detecting and identifying Porphyra (Bangiales,Rhodophyta)[J].Chinese Journal of Oceanology and Limnology,1998,16(3):237-242.
[4]SUN J W,JIN D M,ZHOU C J,et al.Identification of Porphyra lines (Rhodophyta) by AFLP DNA fingerprinting and molecular markers[J].Plant Molecular Biology Reporter,2005,23(3):251-262.
[5]WENG M L,LIU B,JIN D M,et al.Identification of 27 Porphyra lines (Rhodophyta) by DNA fingerprinting and molecular markers[J].Journal of Applied Phycology,2005,17:91-97.
[6]陈骁,左正宏,姚继承,等.几种紫菜种质资源遗传多样性的RAPD分析[J].海洋科学,2005,29(4):76-80.
CHEN X,ZUO Z H,YAO J C,et al.Analysis of genetic diversity of Porphyra by random amplified polymorphic DNA[J].Marine Science,2005,29(4):76-80.
[7]陈奕欣,左正宏,陈骁,等.坛紫菜种质资源遗传多样性的AFLP分析[J].厦门大学学报:自然科学版,2007,46(6):831-835.
CHEN Y X,ZUO Z H,CHEN X,et al.Analysis of genetic diversity of Porphyra haitanensis using AFLP [J].Journal of Xiamen University:Nature Science,2007,46(6):831-835.
[8]陈昌生,谢潮添,纪德华,等.野生坛紫菜种群遗传多样性的ISSR分析[J].水产学报,2008,32(5):717-724.
CHEN C S,XIE C T,JI D H,et al.Genetic diversity of wild population of Porphyra haitanensis based on ISSR analysis[J].Journal of Fisheries of China,2008,32(5):717-724.
[9]JIA J H,WANG P,JIN D M,et al.The application of RAPD markers in diversity detection and variety identification of Porphyra[J].Acta Botanica Sinica,2000,42(4):403-407.
[10]梅俊学,金德敏,贾建航,等.条斑紫菜不同栽培品系的RAPD研究[J].山东大学学报:自然科学版,2000,35(2):230-234.
MEI J X,JIN D M,JIAN J H,et al.DNA polymorphism of Porphyra yezzoensis and its application to cultivar discrimination[J].Journal of Shandong University,2000,35(2):230-234.
[11]乔利仙,翁曼丽,孔凡娜,等.RSAP标记技术在紫菜遗传多样性检测及种质鉴定中的应用[J].中国海洋大学学报,2007,37(6):951-956.
QIAO L X,WENG M L,KONG F N,et al.The application of RSAP markers technique in diversity detection and germplasms identification of Porphyra[J].Journal of Ocean University of China,2007,37(6):951-956.
[12]石金锋,贾建航,王萍,等.紫菜无性系特异分子标记的获得[J].高技术通讯,2000,10:1-3.
SHI J F,JIA J H,WANG P,et al.Development of specific molecular markers for Porphyra lines[J].High Technology Communication,2000,10:1-3.
[13]石金锋,贾建航,金德敏,等.紫菜无性系特异SCAR标记的获得[J].海洋学报,2003,25(1):128-131.
SHI J F,JIA J H,JIN D M,et al.Conversion of RAPD marker to SCAR marker in Porphyra line[J].Acta Oceanologica Sinica,2003,25(1):128-131.
[14]孙雪,骆其君,杨锐,等.紫菜(Porphyra)遗传差异的ISSR分析[J].海洋与湖沼,2007,38(2):141-145.
SUN X,LUO Q J,YANG R,et al.ISSR analysis on genetic variation in Porphyra[J].Oceanologia et Limnologia Sinica,2007,38(2):141-145.
[15]谢潮添,纪德华,陈昌生,等.ISSR标记在坛紫菜不同色泽丝状体种质鉴定中的应用[J].水产学报,2007,31(1):105-111.
XIE C T,JI D H,CHEN C S,et al.Application of ISSR markers in germplasm identification of different color’s Porphyra haitanensis filament strains[J].Journal of Fisheries of China,2007,31(1):105-111.
[16]徐涤,宋林生,秦松,等.五个紫菜品系间遗传差异的RAPD分析[J].高技术通讯,2001,12:1-4.
XU D,SONG L S,QIN S,et al.RAPD analysis of genetic variation among cultivated Porphyra[J].High Technology Communication,2001,12:1-4.
[17]杨锐,刘必谦,骆其君,等.利用扩增片段长度多态性(AFLP)研究坛紫菜的遗传变异[J].高技术通讯,2002,1:83-86.
YANG R,LIU B Q,LUO Q J,et al.Genetic variation of Porphyra haitanensis by applying AFLP[J].High Technology Communication,2002,1:83-86.
[18]袁昭岚,黄鹤忠,沈颂东,等.条斑紫菜5个栽培品系的ISSR分析[J].海洋科学,2006,30(7):9-14.
YUAN Z L,HUANG H Z,SHEN S D,et al.Inter-simple sequence repeat (ISSR) analysis of five cultivars in Porphyra yezoensis[J].Marine Science,2006,30(7):9-14.
[19]YANG L E,JIN Q P,XIAO Y,et al.Improved methods for basic molecular manipulation of the red alga Porphyra umbilicalis(Rhodophyta:Bangiales)[J].Journal of Applied Phycology,2013,25:245-252.
[20]徐建荣,韩晓磊,李宁,等.松江鲈群体遗传多样性的AFLP分析[J].大连水产学院学报,2008,23(6):437-441.
XU J R,HAN X L,LI N,et al.Analysis of genetic diversity in roughskin sculpin Trachidermus fasciatus by AFLP markers [J].Journal of Dalian Fisheries University,2008,23(6):437-441.
[21]陈淑吟,陆勤勤,张美如,等.紫菜丝状体种质特性的ISSR分析[J].江苏农业科学,2015,43(7):17-20.
CHEN S Y,LU Q Q,ZHANG M R,et al.ISSR analysis of characteristics of Pyropia conchocelis germplasms [J].Jiangsu Agriculture Science,2015,43(7):17-20.
(责任编辑:米慧芝)
Genetic Diversity of Different Cultivars of Pyropia yezoensis
YANG Li’en1,HAN Xiaolei2,ZHOU Wei1,DENG Yinyin1,XU Guangping1,HU Chuanming1,ZHU Jianyi2,LU Qinqin1,XU Jianguo3
(1.Jiangsu Institute of Oceanology & Marine Fisheries,Nantong,Jiangsu,226007,China;
【Objective】Different cultivars were screened and bred by mutation or hybridization,and their genetic diversity was determined.【Methods】Molecular markers ISSR,AFLP and RAPD were employed to analyze the genetic diversity of screened cultivars.【Results】The polymorphism ratio shown by ISSR,AFLP and RAPD was 38.10%,38.95% and 61.75%,respectively.The genetic distance shown by ISSR,AFLP and RAPD between different cultivars of Pyropia yezoensis was 0.1785,0.1029 and 0.2845,respectively.Although the clustering results were not consistent,the cultivars Y-0602,Y-HA01 and Y-H001 always clustered together,whereas Y-DL02 tended to cluster as outgroup.【Conclusion】After being screened and bred by mutation or hybridization,the cultivars studied in the present paper are genetically the same species as P.yezoensis but essentially different cultivars with certain genetic diversity.
Pyropia yezoensis,genetic distance,molecular markers,cultivars
2016-05-10
2016-06-15
杨立恩(1983-),男,助理研究员,主要从事紫菜分子生物与生理学研究。
S326,S968.43+1
A
1005-9164(2016)03-0241-07
*国家自然科学基金面上项目(31272664),国家海洋局海洋公益性行业科研专项项目(201105023),南通市科技计划项目(MS22015026)和江苏省水产三新工程重大项目(D2015-18)资助。
**通讯作者:陆勤勤(1964-),男,研究员,主要从事条斑紫菜育种与栽培学研究,E-mail:jsntlqq@163.com。
广西科学Guangxi Sciences 2016,23(3):241~247
网络优先数字出版时间:2016-07-13【DOI】10.13656/j.cnki.gxkx.20160713.012
网络优先数字出版地址:http://www.cnki.net/kcms/detail/45.1206.G3.20160713.0859.024.html

