铜与浓、稀硝酸连续反应演示实验的再改进
叶永谦 张贤金 吴新建
摘要:针对铜与浓、稀硝酸的反应演示实验存在现象不够明显、装置过于复杂等不足,从药品和仪器的选择两方面进行探索,设计了一套可用于铜与浓、稀硝酸连续反应的演示装置,并介绍了实验的步骤和现象。该演示装置具有构思巧妙、简约明了、安全环保等特点。
关键词:铜与硝酸;连续反应;药品和仪器选择;演示装置设计;实验改进
文章编号:1005–6629(2016)7–0060–03 中图分类号:G633.8 文献标识码:B
铜与浓、稀硝酸反应分别生成红棕色的二氧化氮气体和无色的一氧化氮气体,因气体均有毒性,且硝酸具有腐蚀性,对于该实验的改进,一般都是从绿色化、微型化方向进行研究。但是,微型化可能由于演示装置过于微小或者现象不够明显,影响观察的效果;为了做到铜既和浓硝酸反应,又和稀硝酸反应,并保证安全环保,装置设计往往过于复杂。本改进实验通过使用固体与多种液体连续反应制备气体演示装置,进行铜与浓、稀硝酸的连续反应,使该实验操作简单、现象明显、安全环保。
1 药品的选择
由于实验产生的氮氧化合物气体需吸收处理,所用到的硝酸具有腐蚀性,为了达到绿色化要求,本实验除了使用氢氧化钠溶液吸收氮氧化合物气体外,还就铜片的规格、数量,硝酸的浓度进行研究。
1.1 铜片的选择
实验室的单质铜一般有铜粉、铜箔和铜片三种,前两种由于反应太快,一般遇到浓硝酸短时间就全部溶解掉,无法再设计与稀硝酸的反应,且实验难以控制,瞬间产生大量的有毒气体无法全部处理。因此,本实验采用长3cm、宽1cm、厚0.2cm的铜片三块,保证有足够的量与浓硝酸反应后再与稀硝酸反应,且反应较温和,产生有毒气体气流平稳有利于吸收和处理。
1.2 硝酸浓度的选择
浓硝酸与铜反应若要观察到红棕色的气体,必须达到一定浓度,但是浓度太高有可能因反应过于剧烈而无法控制造成危险,产生的有毒气体也无法及时处理。同时,铜片短时间内全部溶解,无法观察到其与稀硝酸反应的现象;如果硝酸浓度不够,则无法观察到红棕色气体[1]。经过对照反应,本实验最终选择的硝酸浓度在6 mol·L-1左右,有利于控制反应平稳进行并能观察到明显现象。
2 仪器的选择
2.1 可视化、简约化角度的选择
化学学科的演示实验,不仅要为学生提供正确而有说服力的感性知识,还要激发学生学习化学的兴趣,培养学生的观察能力和思维能力,提高科学素养。为了提高演示实验的效果,设计时必须关注现象的清晰性和操作的简练性[2],方便教师在几分钟内将实验目的、实验原理、仪器药品、操作步骤、实验结果等讲解清楚。因此,为了使学生在演示实验过程中既“看得清”又“看得懂”,仪器的选择要满足现象可视化、装置简约化的要求。佃武杰等在“铜与浓、稀硝酸反应微型实验设计”[3]一文中的装置(图1)设计巧妙,能实现铜与浓、稀硝酸反应,但在课堂演示过程中,可视度方面略显不足。张泽志等在“铜与硝酸反应的实验创新设计”[4]一文中的装置(图2),能明显对比铜与浓、稀硝酸反应的差别,但装置设计过于复杂,不利于学生直观理解实验过程。基于以上原因,不宜选用注射器、点滴管、小试管等进行仪器设计,将简单实验复杂化。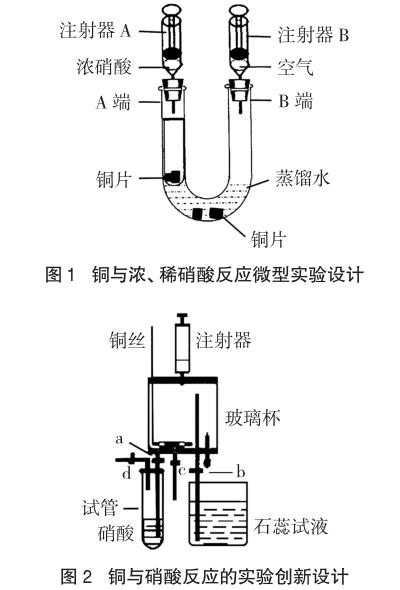
2.2 连续反应角度的选择
本实验属于块状固体与液体作用产生难溶性气体的反应,启普发生器及其简易装置也是选择的方向之一。但要使铜与浓硝酸反应后继续与稀硝酸反应,必须在反应一段时间后流出浓硝酸,再注入蒸馏水得到稀硝酸,启普发生器类装置无法实
现这个功能。因此,固体与多种液体连续反应制备气体演示装置[5]是较为合理的选择。为了防止反应产生的毒气吸收不够完全导致环境污染,在本实验装置中改装后的筒形恒压漏斗下管口处增加一个倒扣的塑料漏斗,以确保实验安全。具体实验装置如图3所示。
在上述装置中,改装的恒压漏斗是反应的发生装置,三角漏斗用于注入浓硝酸和承装反应后被压出的液体,n形弯管及外玻璃管用于导出反应产生的气体,内玻璃管及玻璃活塞1用于控制浓硝酸的流出,玻璃活塞2用于控制气体的导出,倒扣的塑料漏斗用于防止因氢氧化钠吸收氮氧气体不完全而导致毒气泄漏。
3 实验步骤与现象
3.1 铜与浓硝酸反应及二氧化氮处理
3.1.1 浓硝酸的配制
往恒压漏斗中加入铜片后,量取40mL 65%~69%浓硝酸溶解在60mL蒸馏水中稀释配制成浓度为6 mol·L-1左右的硝酸,从三角漏斗中倒入恒压漏斗至充满,关闭弯管玻璃活塞2。
3.1.2 二氧化氮的生成
铜片接触浓硝酸后,表面立即有气泡产生,溶液变浅绿色,反应较为缓慢。一段时间后,反应加快,恒压漏斗上端有红棕色气体产生,将溶液压入三角漏斗中,在液面上滴加适量植物油覆盖,防止溶液中溶有的二氧化氮气体逸出。
3.1.3 二氧化氮的吸收
观察到明显的红棕色二氧化氮气体生成后,打开弯管玻璃活塞2,三角漏斗中的液体下降。控制流速,让恒压漏斗中红棕色气体形成缓慢气流全部被氢氧化钠溶液吸收。
3.2 铜与稀硝酸反应和氮氧化合物气体处理
3.2.1 稀硝酸的配制
当恒压漏斗中红棕色气体全部被排出后,打开漏斗下方玻璃活塞1,使溶液流出,烧杯中有蓝色沉淀生成。溶液流出过程中可能伴有氮氧化合物气体,由于恒压漏斗下口浸在氢氧化钠溶液中且设计有倒扣的漏斗,可以有效吸收该气体。待溶液流出大约30mL左右,关闭玻璃活塞1,往三角漏斗中加入蒸馏水,打开弯管玻璃活塞2,使蒸馏水顺利流入并充满恒压漏斗形成浓度为4 mol·L-1左右的稀硝酸。
3.2.2 一氧化氮的生成和检验
硝酸被稀释后,溶液颜色变为浅蓝色,铜片表面气泡继续产生。一段时间后,恒压漏斗上部产生无色气体,并将溶液压入三角漏斗中。接着,打开玻璃活塞1,使恒压漏斗中稀硝酸全部流出,随着空气的进入,恒压漏斗中无色气体立即变为红棕色。通过以上现象,可以证明铜与稀硝酸反应产生的无色气体是一氧化氮。
3.2.3 有毒气体的吸收
当恒压漏斗中液体全部流出后,关闭玻璃活塞1,打开弯管玻璃活塞2,往三角漏斗中加蒸馏水,将恒压漏斗中有毒气体全部排到氢氧化钠溶液中吸收,实验完成。
4 设计亮点
通过以上设计,可以明显地观察到铜与浓硝酸反应产生红棕色气体,与稀硝酸反应产生无色气体,该无色气体遇空气后又变为红棕色气体。在有效提高实验演示的可视化程度的同时,还具有以下亮点。
4.1 构思巧妙
本实验巧妙地运用浓、稀硝酸产生二氧化氮和一氧化氮的界限进行设计,通过浓硝酸的流出和蒸馏水的加入实现硝酸浓度从6 mol·L-1到4 mol·L-1的变化,从而观察到明显的红棕色气体和无色气体,且该无色气体可再转化为红棕色气体。
4.2 简约明了
本实验所用的仪器方便易得,且价格便宜,便于推广使用。操作步骤简练,实验一气呵成,时间在7分钟左右,适合课堂上演示,使实验“看得清”和“看得懂”。
4.3 安全环保
本实验使用氢氧化钠处理有毒的气体,使用大容积外管确保毒气充分吸收,并使用植物油、倒扣的塑料漏斗防止毒气外逸。在确保实验安全的同时,有利于培养学生绿色环保的意识。
参考文献:
[1]罗宿星,伍远辉,孙东来.铜与硝酸反应实验中硝酸浓稀界限的研究[J].实验室科学,2012,(5):67~69.
[2]沈伟艺.试论如何提高化学课堂演示实验效果的途径[J].厦门大学学报(自然科学版),2011,(9):192~194.
[3]张玉征,李先栓.铜与硝酸反应的绿色化设计[J].当代化工,2011,(8):792~797.
[4]张泽志,韩春亮.铜与硝酸反应的实验创新设计[J].河南教育学院学报(自然科学版),2013,(2):30~31.
[5]叶永谦,张贤金,吴新建,叶燕珠.铝与水反应演示实验装置的设计[J].化学教学,2016,(1):74~76.

