谈探究氢氧化钠性质实验的五个误区
摘要:以案例形式剖析了探究氢氧化钠性质实验中存在的认识误区,指出了问题所在,提出了相关的建议和改进措施,避免在初中化学教学中步入实验误区。倡导重视实验设计的科学性和严密性,帮助学生通过实验获得知识、理解知识和巩固知识。
关键词:氢氧化钠;性质实验;实验误区;实验探究;实验教学
文章编号:1005–6629(2016)7–0062–03 中图分类号:G633.8 文献标识码:B
氢氧化钠是初中化学学习的一种重要物质,是碱类物质的典型代表物之一。氢氧化钠溶于水放出热量、氢氧化钠溶液显碱性、氢氧化钠能与二氧化碳反应、氢氧化钠与酸发生中和反应等都是氢氧化钠的重要性质,也是课堂教学的重点。笔者在听课调研中发现,有些教师在设计实验方案探究氢氧化钠的上述性质时,存在原理不正确、方案不科学、结论欠精准等种种问题,步入了实验探究的误区,导致学生对知识的理解产生了偏差。现将相关探究案例整理并分析如下,供同行们参考,以期得到指正。
1 探究氢氧化钠溶于水的热效应
“氢氧化钠是白色固体,易溶于水,溶解时放出热量”。这是教材对氢氧化钠物理性质的简单描述。
为了验证固体氢氧化钠溶于水放出热量这一事实,教师没有利用传统的“用温度计测量固体物质溶于水前后的温度变化”这一实验方案,而是创新性地设计了如下趣味实验方案:
向试管内倒入5mL水,先在酒精灯外焰上进行预热,再集中加热,直至试管内的水沸腾;移开试管,试管内的水停止沸腾,向刚沸腾过的水中加入些许固体氢氧化钠,观察到试管内的水重新沸腾了起来。
学生兴致勃勃地观察、饶有兴致地讨论,脸上带着惊喜。经过一番议论之后,教师最终给出了结论:水的重新沸腾是固体氢氧化钠溶于水时放出了热量所致。由于学生亲眼目睹了实验现象,便心悦诚服地接受了教师给出的结论。
“水的再次沸腾”果真如教师所说是氢氧化钠溶解放热所致吗?带着疑问,笔者进行了如下三个实验:取三支试管,分别向试管内倒入5mL蒸馏水,先在酒精灯外焰上进行预热,再集中加热,直至试管内的水沸腾;移开试管,向刚沸腾过的热水中分别加入少许氯化钠、硝酸铵、碎瓷片,均观察到试管内的水重新沸腾起来[1]。
众所周之,碎瓷片不溶于水;氯化钠溶于水时,溶液温度不会有明显变化,固体硝酸铵溶于水时吸收热量,溶液温度应该降低,但把这三种物质分别加入刚沸腾过的水中时,都观察到水重新沸腾了起来。显然,“水的重新沸腾是由固体氢氧化钠溶于水时放出热量所致”的说法有所欠缺、站不住脚。因此教师设计的实验方案是不科学的、不可取的。
事实上,给蒸馏水加热时,由于液体里缺乏形成气泡的核心,容易导致形成过热液体,过热液体是亚稳定状态。当向过热液体中加入固体时,会侵入气泡,提供了气化中心,所以会看见水重新沸腾起来。
2 探究氢氧化钠溶液与指示剂作用
氢氧化钠是一种可溶性碱,它的水溶液能与酸碱指示剂作用,使无色酚酞变红色。验证氢氧化钠溶液显碱性时,一位教师向试管内倒入少量氢氧化钠溶液,并滴入几滴酚酞,学生观察到试管里的液体瞬间由无色变为红色,但稍一振荡,红色彻底消失。学生观察到的现象与课本中描述的现象截然不同,于是该教师赶忙又连续滴入了几滴酚酞,最终观察到溶液还是无色,为了结束这一“尴尬”局面,便勉强向学生解释:实验中所用的氢氧化钠变质了,导致实验现象产生了意外。
溶液最终呈现无色,果真是由于氢氧化钠变质所致吗?其实,氢氧化钠变质后往往变成碳酸钠,碳酸钠溶液显碱性,同样可以使酚酞变红色。溶液刚上来显示红色,说明酚酞并未变质,产生意外现象的主要因素是该教师选用的氢氧化钠溶液浓度偏大[2]。事实上,使酚酞变红的碱溶液pH范围是8.2~10.0,当遇到较浓的碱溶液,酚酞的结构发生改变,因此看不到红色出现[3]。课后用pH试纸测得所用氢氧化钠溶液的pH是13,果然不在酚酞变红范围内。
3 探究氢氧化钠与二氧化碳的反应
氢氧化钠能够跟酸性氧化物(如二氧化碳、二氧化硫等)发生反应生成盐和水。为了探究NaOH溶液与CO2之间是否发生反应,教师演示了如下实验:向一个盛满二氧化碳气体的矿泉水瓶里加入少量氢氧化钠溶液,立即盖紧瓶塞,振荡,观察到矿泉水瓶变瘪,由此得出“NaOH溶液与CO2能够发生反应”这一结论。
教师明白这一结论是不确切的。实验中矿泉水瓶变瘪,不足以证明二氧化碳和氢氧化钠溶液发生了化学反应,因为二氧化碳溶解在水中也能产生类似的现象。
为了便于对比,教师又补充了一个对比实验:另取一个矿泉水瓶,倒入少量水,振荡,通过比较两个矿泉水瓶变瘪的程度不同,重新得出“NaOH溶液与CO2能够发生反应”这一结论。
事实上,该教师设计的对比实验是不完美的,是存在缺憾的。原因在于,他并没有进行变量控制,要充分证明氢氧化钠与二氧化碳之间确实发生了反应,对比实验中所使用的矿泉水瓶的材质、形状大小要相同,倒入水的体积理应与氢氧化钠溶液的体积相同。但教师恰好忽略了这一点,因此设计的对比实验方案有瑕疵,无法证明所得结论的真实性。
为证实可溶性碱与二氧化碳之间确实发生化学反应,笔者设计了以下实验:
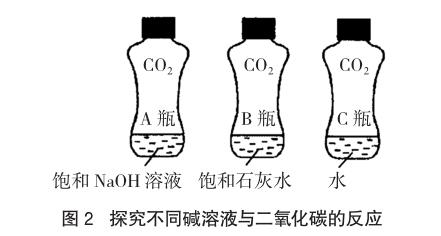
取三个同材质、大小形状相同的均充满二氧化碳气体的软矿泉水瓶,分别向其中倒入等体积的饱和氢氧化钠溶液、饱和石灰水及水,加盖振荡同样次数,比较三者变瘪的程度,可以明显观察到A瓶变瘪程度最大,B瓶次之,C瓶变瘪程度最小。该实验不仅证明二氧化碳能够与碱溶液发生反应,还能够比较氢氧化钠、氢氧化钙与二氧化碳反应程度的不同,是由于二者的溶解能力不同所致。由此提示我们,检验二氧化碳气体时用澄清石灰水,除去二氧化碳时选择氢氧化钠溶液,这样的实验设计可谓一举多得,效果更好。
4 探究中和反应的热效应
酸与碱之间能够发生中和反应,为验证氢氧化钠与盐酸之间发生中和反应并放出热量,教师设计了以下实验方案:
室温下,取10份相同体积质量分数均为10%的NaOH溶液于10支试管中,分别滴加一定体积10%盐酸,并测定溶液温度的最高值,数据记录如下:
表中数据表明:加入盐酸的量在2~10mL之间时溶液的温度逐渐升高,说明中和反应放出热量;当加入盐酸的体积在12~20mL之间,溶液温度逐渐降低。对此,有教师仅解释为中和反应停止,不再放出热量,热量散失,导致溶液温度降低。
表中数据告诉我们:当滴加稀盐酸的体积达到10mL时,温度最高,说明此时是氢氧化钠溶液和盐酸恰好完全反应,当反应结束不再放出热量,随着稀盐酸的继续加入,盐酸不断吸收溶液的热量,导致溶液的温度逐渐降低,过量盐酸起到冷却的作用,才是使溶液的温度明显降低。
5 探究氢氧化钠的变质
氢氧化钠暴露于空气中会与空气中的二氧化碳发生反应而变质,为验证久置于空气中的NaOH固体是否变质,某教师设计了如下实验方案:
取少量固体于试管中,加适量水充分溶解,向试管中滴加几滴稀盐酸,没有观察到气泡产生,于是得出结论:该氢氧化钠固体没有变质。
实验中的固体氢氧化钠一定没有变质吗?
其实,酸、碱、盐之间发生的反应一般是复分解反应,在复分解反应中,酸碱中和反应优先反应,也就是说,当向氢氧化钠和碳酸钠的混合液中滴入稀盐酸时,首先发生中和反应:NaOH+HCl= NaCl+H2O,然后发生反应:Na2CO3+HCl=NaHCO3+NaCl,最后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑。在上述实验方案中,虽然盐酸与氢氧化钠、碳酸钠都能发生反应,但是盐酸与氢氧化钠之间的中和反应优先发生,待反应完成之后,盐酸再与碳酸钠发生反应,先生成碳酸氢钠,生成的碳酸氢钠再与盐酸发生反应才产生二氧化碳气体。因此刚上来没有看到气泡产生,并不能说明固体中一定不含碳酸钠,还可能是由于盐酸用量较少所致[4]。若教师使用足量的稀盐酸进行探究,实验方案就严密了,说服力就更强了。
科学探究是学习化学的重要而有效的方式,化学实验是进行科学探究的重要途径,只有设计科学、规范、合理的实验,才能真正增强学生的实证意识,引导学生养成严谨、求实的科学态度,达到理解知识、获得知识、巩固知识之目的。
参考文献:
[1]张伟,李路路.对一则实验改进的探讨[J].中学化学教学参考,2013,(11):72.
[2]张贤金,汪肖楠.三种物质使变红酚酞褪色机理的再探讨[J].化学教学,2009,(4):73~75.
[3]吕秀丽.过氧化钠与水反应过程中酚酞褪色的新释疑[J].化学教学,2005,(3):7~8.
[4]王荣桥.浅析对氢氧化钠变质问题的处理[J].中学化学教学参考,2012,(6):54.

