食管鳞癌组织中程序性死亡分子1表达变化及意义
张锋,韦海涛,王作培,胡宝利,张海峰,王晓龙
(河南大学淮河医院,河南开封475000)
·临床研究·
食管鳞癌组织中程序性死亡分子1表达变化及意义
张锋,韦海涛,王作培,胡宝利,张海峰,王晓龙
(河南大学淮河医院,河南开封475000)
目的观察食管鳞癌组织中程序性死亡分子1(PD-1)的表达变化,并探讨其临床意义。方法 采用免疫组化方法检测102例食管鳞癌组织、36例癌旁不典型增生组织及33例远癌正常组织中PD-1表达,分析PD-1与临床病理参数及生存期的关系。结果 PD-1在癌组织、癌旁组织、远癌正常组织中的阳性表达率分别为56.9%、22.2%、3.0%,P<0.05。PD-1阳性表达率与食管癌患者肿瘤大小、淋巴结转移有关(P均<0.05),与年龄、性别、浸润深度、临床分期、病理分级无关。PD-1阳性患者中位生存时间为23.2个月,显著低于阴性患者的38.9个月(P<0.05)。结论食管鳞癌组织中PD-1表达显著增加,其对患者的肿瘤转移及预后判断有一定价值。
食管癌;程序性死亡分子1;生存期
程序性死亡分子1(PD-1)是由程序性细胞死亡因子1(PDCD1)基因编码的一种负性共刺激受体蛋白,参与调节T细胞的激活、失活,属于B7/CD28家族[1,2]。文献报道,PD-1参与多种自身免疫性疾病的发生、发展,包括肾炎和风湿免疫性疾病等[3]。PD-1在多种肿瘤组织中呈高表达,如肺癌[4]、胃癌[5]及结直肠癌等。但是,目前关于PD-1与食管癌的关系少见报道。2009年1月~2015年6月,我们观察了食管癌组织中PD-1表达变化,并探讨其与食管癌发生发展及预后的关系。现报告如下。
1 资料与方法
1.1临床资料选取2009年1月~2015年6月在我院接受手术治疗的食管鳞癌患者102例,其中男70例、女32例,年龄(68.6±11.2)岁。均经术后病理学检查证实。病理分级G1/2期82例,G3期20例;淋巴结转移49例,无转移53例。患者均接受标准的食管癌根治术;有完整的临床资料和随访数据;术前未进行放化疗。取102例患者的食管癌组织、36例患者癌旁食管组织(距肿瘤组织5 cm内)、33例患者远癌食管组织(距肿瘤组织5 cm及以外)待测。
1.2PD-1表达检测方法采用免疫组化法。将标本切成4~7 μm厚切片,二甲苯浸泡10 min,无水乙醇浸泡5 min,95%、80%、79%乙醇各浸泡5 min脱蜡。用3% H2O2避光孵育15 min灭活内源性过氧化物酶。加入0.01 mol/L枸橼酸钠,于95 ℃行抗原修复15 min。然后封闭抗原,加入一抗,用10%血清于4 ℃ 孵育过夜;加入二抗,室温孵育1 h;然后进行显色并用dH2O洗涤2次后封片,干燥后光镜下观察拍照。每张切片选取5个视野,计数每个视野中细胞总数及PD-1阳性的细胞数。染色强度方面不着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分;阳性细胞所占的百分比方面无着色计0分,阳性细胞所占百分比<25%计1分,25%~50%计2分,>50%计3分。两项得分相乘结果>3则判定为PD-1表达阳性。
1.3随访方法患者随访开始时间为接受手术治疗后,随访结束时间为患者死亡,末次随访时间为2015年11月20日。随访方式为电话或门诊随访,根据美国国立综合癌症网络(NCCN)指南需要进行术后辅助化疗者住院接受治疗并按指南随访。
1.4统计学方法采用SPSS13.0统计软件。计数资料以百分数表示,组间比较采用χ2检验或Fisher确切概率法;生存资料采用中位数表示,组间比较采用Kaplan-Meier生存曲线Log-Rank法。P<0.05为差异有统计学意义。
2 结果
2.1PD-1表达情况PD-1主要表达于癌组织、癌旁组织和远癌组织中浸润的淋巴细胞的细胞膜和细胞质,为棕黄色颗粒。在癌组织、癌旁组织和远癌组织中PD-1阳性表达率分别为56.9%(58/102)、22.2%(8/36)和3.0%(1/33),癌组织PD-1阳性表达率显著高于癌旁组织和远癌组织,P均<0.05。
2.2PD-1表达与临床病理参数的关系 PD-1阳性表达与食管癌患者肿瘤大小和淋巴结转移有关(P均<0.05),而与患者年龄、性别及肿瘤浸润深度、临床分期、病理分级无关。详见表1。
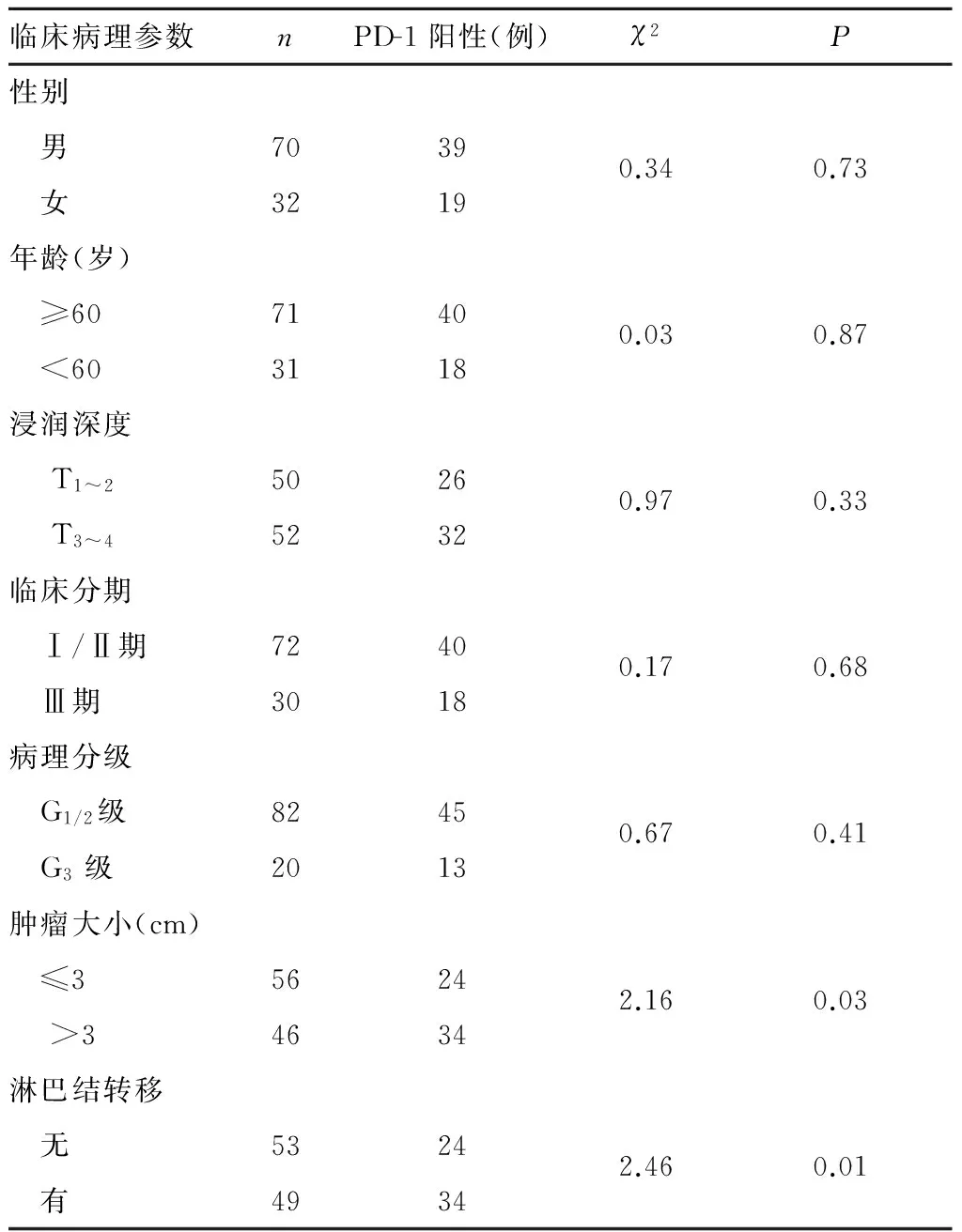
表1 PD-1表达与食管癌患者临床病理参数的关系
2.3食管癌组织PD-1表达与患者预后的关系PD-1阳性患者中位生存时间为23.2个月,显著低于阴性患者38.9个月,P<0.05。
3 讨论
食管癌在全球范围内呈现明显的地区分布,不同地区的发病率及病死率差异明显[6]。我国是食管癌的高发国家之一,尤其是河南河北交界地区及燕山山脉一带的食管癌发病率明显高于其他地区[7,8]。食管癌中约90%为鳞状细胞癌,其发病原因被认为与先天遗传背景和后天饮食生活习惯有较大关系[9,10]。但是,目前食管癌发生发展的分子机制并不十分清楚[11,12]。
近年来有研究发现,PD-1在多种恶性肿瘤组织阳性表达率较高,高于相应的癌旁不典型增生组织,但在远癌的正常组织中表达率较低,提示PD-1可能在实体恶性肿瘤的发生发展中发挥了重要分子生物学功能。宗云辉等[13]报道了胃癌患者外周血、癌旁组织和肿瘤组织中PD-1的表达状况及临床意义,认为PD-1可能与胃癌的恶性转变有关,单克隆抗体靶向阻断程序性死亡分子通路有希望成为胃癌免疫治疗的新方法。马薇等[14]采用免疫组化方法检测了47例非小细胞肺癌患者肿瘤组织中PD-1的表达情况,同时分析其与患者各项临床指标及预后的关系。结果显示,PD-1在非小细胞肺癌组织中的阳性表达率为48.93%,且与肿瘤临床分期及淋巴结转移呈正相关,与患者预后呈负相关。
我们检索了相关数据库,未发现关于PD-1表达与食管鳞癌患者临床病理参数和预后关系的文献报道。因此,我们检测了食管癌组织中PD-1的表达情况,并分析其与患者临床病理参数和预后的关系。本研究结果显示,远癌组织、癌旁不典型增生组织及食管癌组织中PD-1的阳性表达率呈现递增趋势,这与He等[15]在肺癌中的研究结果一致。PD-1在癌组织、癌旁组织及远癌正常组织中表达的差异,表明PD-1在食管癌及肺癌等实体肿瘤的发生发展中发挥重要作用。本研究结果显示,PD-1阳性表达与食管癌患者肿瘤大小和淋巴结转移有关,而与患者年龄、性别、浸润深度、临床分期、病理分级无关。表明PD-1与食管癌病情发展和转移有关。同时,我们对阳性和阴性表达的患者生存数据进行了分析,结果提示PD-1阳性患者中位生存期显著降低,说明PD-1阳性表达是食管癌患者预后不良的危险因素。上述结果均说明PD-1在食管鳞癌的发生发展中起到重要作用。目前,调控PD-1参与食管癌及其他实体恶性肿瘤发生发展过程的分子机制并不清楚,下一步应加强这方面的研究。
[1] Sunshine J, Taube JM. PD-1/PD-L1 inhibitors[J]. Curr Opin Pharmacol, 2015,23(3):32-38.
[2] Chen L, Han X. Anti-PD-1/PD-L1 therapy of human cancer: past, present, and future[J]. J Clin Invest, 2015,125(9):3384-3391.
[3] Xu Z, Cao C, Sun Z, et al. Construction of a genetic system for streptomyces albulus PD-1 and Improving poly(epsilon-L-lysine) production through expression of vitreoscilla hemoglobin[J]. J Microbiol Biotechnol, 2015,25(11):1819-1826.
[4] Zhong A, Pan X, Shi M. Expression of PD-1 by CD4(+)CD25(+)CD127(low) Treg cells in the peripheral blood of lung cancer patients[J]. Onco Targets Ther, 2015,8(3):1831-1833.
[5] Saito H, Kuroda H, Matsunaga T, et al. Increased PD-1 expression on CD4+ and CD8+ T cells is involved in immune evasion in gastric cancer[J]. J Surg Oncol, 2013,107(5):517-522.
[6] Siegel R, DeSantis C, Virgo K, et al. Cancer treatment and survivorship statistics, 2012[J]. CA Cancer J Clin, 2012,62(4):220-241.
[7] Gao QY, Fang JY. Early esophageal cancer screening in China[J]. Best Pract Res Clin Gastroenterol, 2015,29(6):885-893.
[8] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-32
[9] Song Y, Du Y, Zhou Q, et al. Association of GSTP1 Ile105Val polymorphism with risk of esophageal cancer: a meta-analysis of 21 case-control studies[J]. Int J Clin Exp Med, 2014,7(10):3215-3224
[10] Tan X, Chen M. Association between glutathione S-transferases P1 Ile105Val polymorphism and susceptibility to esophageal cancer: evidence from 20 case-control studies[J]. Mol Biol Rep, 2015,42(2):399-408
[11] Matejcic M, Iqbal PM. Gene-environment interactions in esophageal cancer[J]. Crit Rev Clin Lab Sci, 2015,52(5):211-31.
[12] Wang AH, Liu Y, Wang B, et al. Epidemiological studies of esophageal cancer in the era of genome-wide association studies[J]. World J Gastrointest Pathophysiol, 2014,5(3):335-343.
[13] 宗云辉,何宋兵,游凤涛,等.PD-1和TIM-3在胃癌病人免疫组织CD3+T细胞中的表达分析[J].免疫学杂志,2014,23(10):902-905.
[14] 马薇,罗殿中,陈源,等.PD-L1和PD-1在非小细胞肺癌中的表达及其临床意义[J].实用医学杂志,2011,21(9):1551-1554.
[15] He J, Hu Y, Hu M, et al. Development of PD-1/PD-L1 pathway in tumor immune microenvironment and treatment for non-small cell lung cancer[J]. Sci Rep, 2015,25(5):13110.
河南省科技发展计划项目(152300410066)。
10.3969/j.issn.1002-266X.2016.26.012
R751
B
1002-266X(2016)26-0041-03
2015-03-22)

