不同时间给予去铁胺对大鼠实验性颅脑创伤的疗效观察*
张礼均,肖 虹,周 玮,刘 科(重庆市急救医疗中心神经外科400014)
不同时间给予去铁胺对大鼠实验性颅脑创伤的疗效观察*
张礼均,肖虹,周玮,刘科△(重庆市急救医疗中心神经外科400014)
目的探讨不同时间给予去铁胺对大鼠实验性颅脑创伤的治疗作用。方法选取健康成年雄性SD大鼠39只,体质量210~310 g,随机分为致伤组、早期治疗组和延期治疗组,每组13只。制备颅脑创伤模型,早期治疗组模型制备2 h即给予去铁胺100 mg/kg(1 mL生理盐水稀释),延期治疗组在模型制备3 d后给予等量去铁胺,而致伤组仅给予等量生理盐水,均治疗至28 d。分别于伤后56 d处死前完成Morris水迷宫实验,处死动物后完成病理学检查,包括大体标本、苏木精-伊红(HE)和尼氏染色。结果(1)Morris水迷宫实验:早期治疗组大鼠平台搜索策略和搜索时间[分别为(3.25±0.16)分、(36.58±9.27)s]与致伤组[分别为(2.13±0.30)分、(110.00±16.74)s]比较,差异均有统计学意义(P<0.05);而延期治疗组大鼠平台搜索策略和搜索时间[分别为(2.50±0.27)分、(96.08±10.66)s]与致伤组比较,差异均无统计学意义(P>0.05)。(2)大体标本:去铁胺早期治疗组大鼠大脑缺损体积[(126.68±15.23)mm3]较致伤组[(212.36±18.43)mm3]明显缩小,差异有统计学意义(P<0.05);延期治疗组[(178.71±30.36)mm3]与致伤组大鼠大脑缺损体积与比较,差异无统计学意义(P>0.05)。(3)HE及尼氏染色:早期治疗组伤区残腔周围残留片状细胞皱缩带较窄,皱缩带可见较多皱缩神经元分布;延期治疗组该皱缩带较早期治疗组有所增宽;致伤组该皱缩带最明显,且残留神经元鲜见。结论大鼠大脑打击伤后早期(2 h)给予去铁胺,能显著改善其空间学习记忆能力、缩小大脑缺损体积及减少致伤灶周围神经元死亡,从而起到神经保护作用,而延期治疗(3d)则无效。
颅脑损伤;创伤和损伤;去铁胺;时间因素;迷宫学习;大鼠;神经保护
近年来,神经外科发展迅速,颅脑创伤认识水平和监测技术不断进步,但颅脑创伤的致残率和死亡率始终居高不下。目前挽救“半暗带”区域脑组织依然是神经外科关注的焦点。颅脑创伤后直接血肿清除和去骨瓣减压技术的成熟,对挽救患者生命起到关键作用,但继发脑损害的问题一直困扰着神经外科医生。有研究发现,颅脑创伤后存在大鼠空间学习记忆能力下降和大脑缺损体积扩大,而早期予以去铁胺治疗,能改善大鼠空间学习记忆能力,缩小大鼠大脑缺损体积[1-3],但延期治疗(3 d)是否有效,目前尚缺乏相关研究。本研究旨在探讨去铁胺治疗颅脑创伤的时效关系,明确延期去铁胺治疗颅脑创伤是否有效。
1 材料与方法
1.1材料选取体质量为210~310 g的健康成年雄性SD大鼠(第三军医大学大坪医院动物中心提供)39只,随机分为早期治疗组、延期治疗组和致伤组,每组13只。
1.2方法
1.2.1动物模型制备及实验方法参照文献[1-3]建立大鼠颅脑创伤模型,并参照Okauchi等[4]方法给药。致伤组大鼠于致伤后2 h开始给予生理盐水(1 mL),每12小时1次,持续28 d;早期治疗组大鼠给予100 mg/kg去铁胺,给药间隔和时间与致伤组一致;延期治疗组大鼠则从致伤开始连续3 d给予等量生理盐水,3 d后给予100 mg/kg去铁胺。三组大鼠分别于伤后56 d处死前完成Morris水迷宫实验,处死后完成实验动物大体标本缺损体积测定、苏木精-伊红(HE)和尼氏染色。
1.2.2观察指标(1)Morris水迷宫实验:于56 d大鼠处死前,从致伤后51 d开始对各组大鼠进行Morris水迷宫实验训练,每天2次,经5 d训练后,完成Morris水迷宫实验,以评估实验大鼠的空间学习记忆力。该装置主要由直径180 cm、高60 cm的水池组成,安放的房间要保持一定的暗度,并保持环境不变,平台可以放置在水池的任何一个假想象限内(本研究将平台放置在第Ⅱ象限),具体步骤参照文献[1]。评价方式包括平台搜索时间(s)和平台搜索策略(边缘式1分、随机式2分、趋向式3分、直线式4分)。(2)大脑缺损体积测定:于56d实验结束时处死各组大鼠,完整保留大脑组织,采用多田公式计算大鼠大脑缺损体积,并切片观察大脑缺损情况。(3)HE和尼氏染色:于56 d实验结束时处死各组大鼠,取各组致伤灶周围相应部位组织进行HE和尼氏染色,采用光镜(400×)观察致伤灶周围脑组织损伤情况。
1.3统计学处理应用SPSS18.0统计软件进行数据分析,计量资料以±s表示,采用方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1Morris水迷宫实验致伤组大鼠平台搜索时间为(110.00±16.74)s,平台搜索策略基本为边缘式或随机式,评分(2.13±0.30)分;早期治疗组大鼠平台搜索时间为(36.58±9.27)s,平台搜索策略以趋向式为主,评分(3.25± 0.16)分;延期治疗组大鼠平台搜索时间为(96.08±10.66)s,平台搜索策略以随机式为主,评分(2.50±0.27)分。早期治疗组大鼠无论是平台搜索时间还是搜索策略与致伤组比较,差异均有统计学意义(P<0.05),而延期治疗组与致伤组比较,差异均无统计学意义(P>0.05)。见图1。

图1 Morris水迷宫实验
2.2大体标本致伤组大鼠大脑缺损体积为(212.36± 18.43)mm3,早期治疗组为(126.68±15.23)mm3,延期治疗组为(178.71±30.36)mm3。与致伤组比较,早期治疗组大脑缺损体积明显缩小,差异有统计学意义(P<0.05);而延期治疗组则无明显变化,差异无统计学意义(P>0.05)。各组大鼠致伤侧大脑半球致伤区域脑组织缺损严重,缺损直径(5~7 mm)较打击杆直径(4.5 mm)明显扩大,挫裂伤脑组织大部分坏死、吸收,残腔均可见少量黄色沉积物。致伤组大鼠致伤侧半球残留额叶和枕叶少量脑实质(图2A);早期治疗组、延期治疗组大鼠致伤侧半球脑组织较致伤组多,早期治疗组残留脑实质最多(图2B、C)。

图2 各组大鼠大脑缺损体积大体标本形态
2.3HE及尼氏染色致伤组(图3A、4A):伤侧半球残留脑组织少,残腔周围损伤带较宽,结构疏松,残留皱缩神经元鲜见,残腔可见脉络丛,对侧大脑实质变薄。早期治疗组(图3B、4B):伤侧半球残留脑组织较多,残腔周围损伤带较窄,结构疏松不明显,残留皱缩神经元多见,核浓缩(图中箭头所示),残腔可见脉络丛。延期治疗组(图3C、4C):损伤带损伤程度介于致伤组、早期治疗组之间。

图3 致伤灶周围脑组织HE染色(400×)
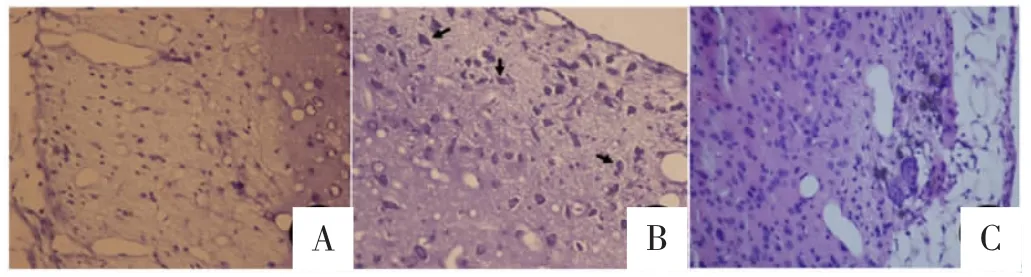
图4 致伤灶周围脑组织尼氏染色(400×)
3 讨 论
铁螯合剂去铁胺是一种金属络合物,对铁离子有高度特异性亲和力,能快速与铁离子形成无活性或活性很弱的复合物排出体外,可减少局部铁离子浓度,全身给药后能快速透过血-脑脊液屏障,在脑组织局部高浓度聚集[5]。同时,去铁胺能降低血红蛋白诱导的脑组织Na+-K+-ATP酶抑制作用和神经毒性作用[6]。有研究发现,在实验性脑出血中,铁离子螯合剂去铁胺能减少神经元损伤和神经功能缺损,具有神经保护作用[7]。有研究发现,去铁胺可减轻白质水肿、降低肿瘤坏死因子α和蛋白激酶1水平[8],认为是潜在治疗脑出血的有效药物。有研究采用脑室注血方法制备脑积水模型,结果发现,去铁胺能降低脑积水发生率[9]。颅脑创伤后存在血红蛋白分解产生铁离子的病理过程,同样存在铁离子对脑组织的继发性损害过程。有研究发现,颅脑创伤后28 d,实验动物大脑缺损体积增大和空间学习记忆能力下降,早期给予去铁胺治疗后,能减轻这种毒性作用,提示铁离子在颅脑创伤中具有神经毒性作用[1]。
在临床上,颅脑创伤患者往往不能在2 h内到达有救治条件的专科医院。那么,延期(3 d)给予去铁胺是否具有神经保护作用呢?本研究发现,致伤组大鼠大体标本可见伤侧半球残留少量额叶和枕叶脑组织,而早期治疗组、延期治疗组大鼠伤侧半球残留脑组织较致伤组明显增加,且早期治疗组更明显;计算大脑缺损体积发现,与致伤组比较,早期治疗组大鼠大脑缺损体积明显缩小,差异有统计学意义(P<0.05),而延期治疗组大鼠大脑缺损体积缩小不显著,差异无统计学意义(P>0.05);进一步采用Morris水迷宫实验检测大鼠空间学习记忆能力发现,早期治疗能显著提高实验大鼠空间学习记忆能力,但延期治疗改善不明显。有研究发现,去铁胺能诱导神经元样细胞增加缺氧耐受能力[10]。而本研究HE和尼氏染色发现,早期治疗组残腔周围脑组织皱缩细胞带明显变窄,而致伤组损伤带最宽,延期治疗组介于致伤组、早期治疗组之间,推测这可能与去铁胺能增加神经缺氧耐受有关,使“半暗带”脑组织存活下来,而且早期给予去铁胺效果好,延期给药效果差。上述结果提示,去铁胺延期(3 d)给药疗效与致伤组比较,差异无统计学意义(P>0.05),而早期给予去铁胺效果显著,与致伤组比较,差异有统计学意义(P<0.05),能显著缩小大脑缺损体积,改善实验动物空间学习记忆能力,减少致伤灶周围细胞损伤带。
因此,作者认为,去铁胺可能是一种治疗颅脑创伤的有效药物。从时效关系上看,早期(2 h)给予去铁胺疗效好,延期(3 d)给药则无效,当然还需进一步在其他实验和临床上加以验证。本研究结果提示,早期使用去铁胺可能是治疗创伤性颅脑损伤的一种有效方法。
[1]Zhang L,Hu R,Li M,et al.Deferoxamine attenuates iron-induced longterm neurotoxicity in rats with traumatic brain injury[J].Neurol Sci,2013,34(5):639-645.
[2]张礼均,胡荣,李飞,等.去铁胺对大鼠大脑冲击伤的治疗作用[J].第三军医大学学报,2012,34(23):2349-2352.
[3]张礼均,胡荣,李飞,等.瞬时受体电位通道6在大鼠大脑冲击伤后铁代谢中的作用[J].第三军医大学学报,2012,34(23):2353-2356.
[4]Okauchi M,Hua Y,Keep RF,et al.Effects of deferoxamine on intracerebral hemorrhage-induced brain injury in aged rats[J].Stroke,2009,40(5):1858-1863.
[5]Palmer C,Roberts RL,Bero C.Deferoxamine posttreatment reduces ischemic brain injury in neonatal rats[J].Stroke,1994,25(5):1039-1045.
[6]Regan RF,Rogers B.Delayed treatment of hemoglobin neurotoxicity[J].J Neurotrauma,2003,20(1):111-120.
[7]Hatakeyama T,Okauchi M,Hua Y,et al.Deferoxamine reduces neuronal death and hematoma lysis after intracerebral hemorrhage in aged rats[J]. Transl Stroke Res,2013,4(5):546-553.
[8]Xie Q,Gu Y,Hua Y,et al.Deferoxamine attenuates white matter injury in a piglet intracerebral hemorrhage model[J].Stroke,2014,45(1):290-292.
[9]Zhao J,Chen Z,Xi G,et al.Deferoxamine attenuates acute hydrocephalus after traumatic brain injury in rats[J].Transl Stroke Res,2014,5(5):586-594.
[10]Nouri F,Salehinejad P,Nematollahi-Mahani SN,et al.Deferoxamine preconditioning of neural-like cells derived from human wharton′s jelly mesenchymal stem cells as a strategy to promote their tolerance and therapeutic potential:an in vitro study[J].Cell Mol Neurobiol,2015-08-05[2015-09-01]. http://www.ncbi.nlm.nih.gov/pubmed.
Effect observation of giving deferoxamine at different time on experimental craniocerebral traumatic injury in rats*
Zhang Lijun,Xiao Hong,Zhou Wei,Liu Ke△(Department of Neurosurgery,Chongqing Municipal Emergency Medical Centre,Chongqing 400014 China)
ObjectiveTo explore the effects of giving deferoxamine at different time on experimental traumatic brain injury(TBI)in rats.Methods39 healthy male adult Sprague-Dawley rats,weighted 210~310 g,were selected and divided into the injury group,early treatment group and delayed treatment group,13 cases in each group.The TBI model was prepared.The early treatment group was given deferoxamine100 mg/kg(dilution by 1mL of normal saline)at 2 h after TBI model preparation,the delayed treatment group was given the same volume of deferoxamine on 3 d after model preparation,while the injury group was given the same volume of normal saline,the treatment lasted for 28 d.Before the rats were killed on 56 d,the Morris water maze test was completed,and then the pathological examination was performed after killing rats,including the gross samples,HE staining and Nissl staining.Results(1)The Morris water maze test:the time of platform search strategy and search time in the early treatment group were(3.25±0.16)scores and(36.58±9.27)s,respectively,which in the injury group were(2.13±0.30)scores and(110± 16.74)s,respectively.The difference was statistically significant(P<0.05),while which in the delayed treatment group were(2.50± 0.27)scores and(96.08±10.66)s,respectively,showing no statistical difference compared with the injury group(P>0.05);(2)the gross samples:the brain defect volume in the early treatment group was(126.68±15.23)mm3,which was significantly decreased compared with the injury group(212.36±18.43)mm3,the difference was statistically significant(P<0.05),the brain defect volume (178.71±30.36)mm3 in the delayed treatment group showed no statistical difference compared with the injury group(P>0.05);(3)the HE and Nissl staining:flaky cellular shrinkage band around residual cavity in the injury area in the early treatment group was relatively narrow,more shrinkage neurons distribution could be found in the shrinkage band;this shrinkage band in the delayed treatment group was somewhat broadened compared with the early treatment group;the shrinkage band in the injury was most obvious,moreover residual neurons were rare.ConclusionEarly given deferoxamine(2 h)after blow injury in rats could significantly improve the ability of space learning and memory,reduces the brain defect volume and peripheral neuron death around injury area,thus plays a neuroprotective effect,while the delayed treatment(3 d)is ineffective.
Craniocerebral trauma;Wounds and injuries;Deferoxamine;Time factors;Maze learning;Rats;Nerve protection
10.3969/j.issn.1009-5519.2016.01.002
A
1009-5519(2016)01-0005-03
国家自然科学基金青年科学基金资助项目(30901545);重庆市自然科学基金资助项目(cstc2015jcyjA1061);重庆市卫生局医疗特色专科资助项目[渝卫科教(2010)52号]。
张礼均(1975-),博士研究生,主治医师,主要从事颅脑创伤及重症监护工作。
△,E-mail:liudaoqi@tom.com。
(2015-09-08)

