siRNA抑制HMGA1基因表达对甲状腺乳头状癌K1细胞增殖的影响
周大新,周 锐,李德群,董慧明,张 晖,朱金海,马小开,陈春春,马桂凯,陈海龙,王志军
siRNA抑制HMGA1基因表达对甲状腺乳头状癌K1细胞增殖的影响
周大新1,2,周锐1,李德群1,董慧明1,张晖1,朱金海1,马小开1,陈春春1,马桂凯1,陈海龙1,王志军1
目的 研究HMGA1-siRNA基因对甲状腺乳头状癌K1细胞增殖的影响。方法 HMGA1-siRNA组转染HMGA1的小干扰RNA(siRNA);阴性对照组转染HMGA1的无关序列,并转染甲状腺乳头状癌K1细胞。采用CCK-8法检测转染HMGA1-siRNA基因后对K1细胞增殖的影响;RT-PCR法检测正常组、HMGA1-siRNA组和阴性对照组的HMGA1-mRNA表达;Western blot法检测三组的HMGA1蛋白表达;Transwell侵袭实验检测三组HMGA1-siRNA基因转染后K1细胞的侵袭能力。结果 HMGA1-siRNA基因对K1细胞的抑制增殖作用明显,呈现时间-剂量依赖关系;HMGA1-siRNA基因在K1细胞中mRNA和蛋白的表达显著低于正常组和阴性对照组;HMGA1-siRNA组K1细胞侵袭能力显著低于正常组和阴性对照组。结论 siRNA可以沉默HMGA1基因,减缓甲状腺乳头状癌K1细胞增殖。
HMGA1-siRNA基因;甲状腺乳头状癌;K1细胞;干扰技术RNA
网络出版时间:2016-5-9 15:43:10 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160509.1543.010.html
高迁移率族蛋白A1(high mobility group A1,HMGA1)是一组非组蛋白染色质相关蛋白,属于高迁移率族蛋白(HMG)的成员,可作为真核生物转录因子的辅助因子参与转录过程。在正常情况下,HMGA1主要存在于胚胎发育阶段,而迅速增殖的细胞内和分化成熟的组织内几乎没有表达,已有国内外文献[1-3]报道HMGA1基因参与了不同胚胎起源的肿瘤相关基因的转录调控。目前,在甲状腺癌组织中HMGA1基因及其具体作用机制仍知之甚少,在K1细胞内运用HMGA1-siRNA研究HMGA1基因功能的应用尚未见报道。该研究构建HMGA1-siRNA基因并转染甲状腺乳头状癌K1细胞株,研究其对K1细胞抑制及侵袭力的影响。
1 材料与方法
1.1实验材料
1.1.1试剂及来源 兔抗人HMGA1单克隆抗体购自美国Santa Cruz生物公司;胎牛血清(FBS)购自杭州四季青公司;DMEM/F12培养液购自美国Gibco公司;CCK-8细胞计数试剂盒购自美国Sigma公司;RT-PCR AMV试剂盒购自立陶宛Fermentas公司。
1.1.2细胞株来源 人甲状腺乳头状癌K1细胞株购自上海美轩公司产品。
1.2实验方法
1.2.1HMGA1-siRNA基因的转染 本实验共分为3组:HMGA1-siRNA组;不加任何干预设为正常组;siRNA阴性对照进行干预设为阴性对照组。各组引物序列由上海美轩公司设计并合成,序列如下,HMGA1-siRNA上游引物:5′-GCCGGGGCAGGCCGCGCAATT-3′;下游引物:5′-UUGCGCGGCCUGCCCCGGCTT-3′;阴性对照上游引物:5′-UUCACUCCAAGUCUCUUCCTT-3′;下游引物:5′-GGAAGAGACUUGGAGUGAATT-3′,根据LipofectaminTM2000说明书进行转染。
1.2.2细胞培养 采用DMEM/F12培养基分组培养人甲状腺乳头状癌K1细胞至对数生长期,各组用0.25%胰蛋白酶消化,制成单细胞悬液,稀释至5 ×103细胞悬液,逐步分别接种于新的培养瓶继续传代培养,建立人甲状腺乳头状癌K1细胞株。
1.2.3测定细胞生长曲线 细胞悬液接种到细胞板,该板为96孔板,每孔置入1 000个细胞数,每组设3个复孔,每天定时加入10 μl的CCK-8试剂,连续3 d,待细胞贴壁后,培养板置入37℃条件下孵育4 h后,测定各孔在450 nm处的吸光度(optical density,OD)值。并计算KI细胞抑制率。细胞抑制率(%)=(1-实验组平均OD值/对照组平均OD值)×100%。
1.2.4RT-PCR定量分析 细胞培养建立人甲状腺乳头状癌K1细胞株。引物由上海生物工程公司合成,序列如下,HMGA1上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′;下游引物:5′-GAAGATGGTGATGGGATTTC-3′;GAPDH上游引物:5′-GGCACTGAGAAGCGGGGCCG-3′;下游引物:5′-CCCTTGTTTTTTGCTTCCCTT-3′。总RNA的提取和反转录严格按照说明书进行操作;PCR反应体系为20 μl,反应条件:预变性4 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环。在琼脂糖凝胶中观察PCR产物。并计算mRNA表达抑制率。mRNA表达抑制率:抑制率(%)=(1-对照组平均相对灰度值/正常组平均相对灰度值)×100%。
1.2.5Western blot法检测 同上,建立人甲状腺乳头状癌K1细胞株。测定各样品蛋白浓度使用BCA法,将漂洗后的凝胶转移到NC膜上(4℃、1 h)。将膜置于5%的脱脂奶粉封闭液,设置37℃恒温封闭2 h,β-actin抗体(1∶1 000)/HMGA1抗体(1∶400)加入,4℃摇床上一抗孵育过夜,加入5%脱脂奶粉稀释的辣根过氧化物酶标记的第二抗体(1∶4 000),设置37℃恒温摇床上温育1.5 h二抗孵育。将膜置于ECL显色液中1~5 min曝光,显影,清洗后放入定影液中定影,最后用凝胶成像系统分析结果。根据以下公式计算蛋白表达抑制率:抑制率(%)=(1-实验组平均相对灰度值/对照组平均相对灰度值)×100%。
1.2.6Transwell侵袭实验 实验同上,建立人甲状腺乳头状癌K1细胞株。Transwell小室底部为8 μm孔径乙烯滤膜,预先铺上Matrigel凝胶(1 mg/ml)100 μl。细胞转染24 h后,常规收集细胞,5组均以无血清DMEM/F12制成1×105/ml细胞液,各取100 μl移入小室,小室外加入各200 μl的条件培养和完全培养液。置37℃的培养箱内孵育48 h后取出。侵袭并黏附至下室面的细胞以10%甲醛固定、HE染色。在400倍高倍镜下细胞计数。细胞侵袭力抑制率(%)=(1-实验组细胞数/对照组细胞数)×100%。
1.3统计学处理 采用SPSS 17.0软件进行分析,数据以±s表示。各组间比较用单因素方差分析法,数据间的两两比较采用LSD检验。
2 结果
2.1HMGA1-siRNA基因对K1细胞增殖的影响
各组细胞在处于对数生长期时细胞分裂增殖旺盛,形态正常,生长状态良好,均出现增殖,在干预后24 h开始出现差异,且作用时间增长,转染后K1细胞增殖的抑制率越明显,呈现时间-剂量依赖关系(72 h作用最明显),在各时间点HMGA1-siRNA组与阴性对照组比较差异均有统计学意义(F= 168.23,P<0.05);正常组与阴性对照组比较差异均无统计学意义。见图1。

图1 转染后HMGA1基因对K1细胞增殖的影响与正常组比较:*P<0.05;与阴性对照组比较:#P<0.05
2.2HMGA1-siRNA基因在K1细胞中mRNA的表达 HMGA1-siRNA处理72 h后,HMGA1-siRNA组mRNA表达水平、阴性对照组分别与正常组比较,均明显降低(正常组:1.000±0.00;HMGA1-siRNA组:0.247±0.02;阴性对照组:0.931±0.05)(F =388.72,P<0.05),抑制率分别为75.28%、6.90%。HMGA1基因的mRNA表达水平在正常组、阴性对照组之间差异无统计学意义。
2.3HMGA1-siRNA基因在K1细胞中蛋白的表达 Western blot检测转染72 h后,与正常组比较,HMGA1-siRNA组和阴性对照组K1细胞的抑制率分别为41.68%和2.1%,见图2。正常组和阴性对照组之间差异无统计学意义。
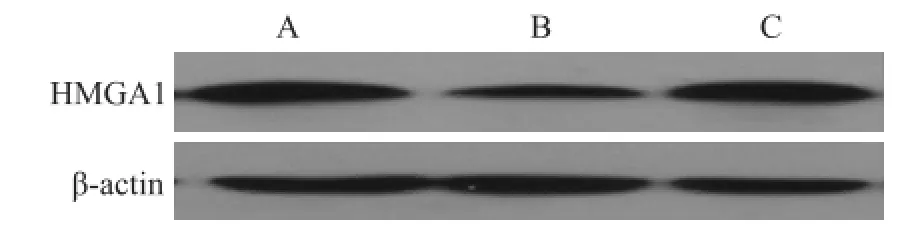
图2 转染后HMGA1基因在K1细胞中蛋白的表达A:正常组;B:HMGA1-siRNA组;C:阴性对照组
2.4Transwell侵袭实验 通过检测转染72 h后,HMGA1组的K1细胞,穿膜细胞数低于正常组、阴性对照组的细胞,侵袭力抑制率分别为36.32%、1.23%,差异有统计学意义(F=263.85,P<0.05)。见图3。正常组与阴性对照组比较,细胞侵袭数的差异无统计学意义。

图3 Transwell侵袭实验 ×300A:正常组;B:HMGA1-siRNA组;C:阴性对照组
3 讨论
目前,基因沉默主要通过干扰RNA(siRNA)、反义寡脱氧核苷酸和核酶等技术手段来实现[4]。研究[5-8]表明,由于siRNA失去了抑制基因表达的活性,其诱导的特定基因阻断技术具有高度的序列特异性。siRNA抑制基因表达的效率高,且具备高度的序列特异性,可以特异性抑制mRNA序列,达到阻断目的蛋白的表达作用,同时又具备防止长链dsRNA引发的非特异性基因降解和细胞死亡的功能。故siRNA已成为RNAi施展重要作用的中间效应分子。
临床研究[7]证明,HMGA1与肿瘤的侵袭转移能力密切相关,HMGA1基因在甲状腺癌、肺癌、宫颈癌、前列腺癌、大肠癌、乳腺癌等许多肿瘤中呈高水平表达,而癌旁正常组织不表达或微弱表达,推测其可能与肿瘤的发生、发展密切相关。正常细胞若转染HMGA1基因可导致正常细胞的恶化,肿瘤细胞转HMGA1基因,可导致细胞恶性程度的增加。研究[9]表明,不管在转基因动物身上的恶性肿瘤或应用致癌诱导剂导致的正常细胞恶变都可以检测到细胞内HMGA1水平迅速升高;可以设想,若抑制HMGA1的高表达,是否可以阻止细胞的恶化,HMGA1有望成为肿瘤治疗的新靶点。
本研究表明人甲状腺乳头状癌组织中有HMGA1蛋白异常表达,但还有许多关键性问题没有搞清楚,本课题通过设计并合成HMGA1 siRNA,然后转染甲状腺乳头状癌K1细胞,对照组以等量阴性对照siRNA转染K1细胞,实时荧光定量RT-PCR技术检测转染后K1细胞中HMGA1 mRNA的表达,HMGA1 mRNA的表达以PGR循环数阈值(Ct值)表示;Western blot法测定K1细胞中HMGA1蛋白的表达;显微镜观察并计数转染后存活的K1细胞数,筛选出有效的siRNA。用有效的siRNA重新转染K1细胞,选取稳定转染HMGA1 siRNA的甲状腺乳头状癌K1细胞,实时荧光定量PCR、Western blot法检测稳定转染HMGA1 siRNA的甲状腺乳头状癌K1细胞株中HMGA1 mRNA和蛋白的表达;CCK8、Transwell法分别检测转染后细胞的增殖、凋亡及迁移力。观察稳定转染HMGA1 siRNA对甲状腺乳头状癌细胞的生物学行为的影响,从而进一步了解HMGA1基因在甲状腺乳头状癌发生、发展中的作用,以期为甲状腺乳头状癌的治疗开辟新的途径。
本研究利用RNA干扰技术,制备HMGA1-siRNA基因,并植入甲状腺乳头状癌K1细胞,观察siRNA对HMGA1基因表达的影响。研究显示siRNA可以沉默HMGA1基因,减缓甲状腺乳头状癌K1细胞增殖。该研究结果对甲状腺乳头状癌的诊断、治疗具有一定的启示意义,有待进一步研究。
[1] Fusco A M,Fedele M.Roles of HMGA proteins in cancer[J].Nat Rev Cancer,2007,7(12):899-910.
[2] Chang Z G,Yang L Y,Wang W,et al.Determination of high mobility group A1 HMGA1 expression in hepatocellular carcinoma a potential prognostic marker[J].Dig Dis Sci,2005,50(10):1764 -70.
[3] Flohr A M,Rogalla P,Bonk U,et al.High mobility group protein HMGA1 expression in breast cancer reveals a positive correlation with tumour grade[J].Histol Histopathol,2003,18(4):999-1004.
[4] Matsui K,Sasaki Y,Komatsu T,et al.RNAi gene silencing using cerasome as a viral-size siRNA-carrier free from fusion and crosslinking[J].Bioorg Med Chem Lett,2007,17(14):3935-8.
[5] 寻庆英,王玲玲,周怀君.siRNA抑制RRM2表达对子宫内膜癌Ishikawa细胞增殖影响的研究[J].东南大学学报(医学版),2015,34(6):890-6.
[6] 卢燕军,付陆军,杨家进,等.siRNA介导BMP7基因沉默对人肝癌HepG2细胞增殖和迁移的影响[J].世界华人消化杂志,2016,24(1):10-8.
[7] 农晰婷,杨 光,张 昱.siRNA靶向抑制MACC1对结直肠癌细胞增殖和侵袭能力的影响[J].陕西医学杂志,2016,45(1):9-11.
[8] 张英芝,劳佩维,白延青.HMGA1在卵巢上皮性癌组织中的表达及临床意义[J].肿瘤学杂志,2014,20(1):51-4.
[9] 江振洲,刘晓昕,周 旺,等.我国疾病靶点研究最新进展[J].前沿与进展,2015,39(5):335-50.
Impact on proliferation of K1 cells in papillary thyroid carcinoma under the inhibition of siRNA on HMGA1 gene
Zhou Daxin1,2,Zhou Rui1,Li Dequn1,et al
(1Dept of Oncology,The First Affiliated Hospital of Bengbu Medical College,Hefei 233004;2Huaibei Clinical Institute of Anhui Medical University,Dept of General Surgery,Huaibei People's Hospital,Huaibei 235100)
Objective To study the effect of HMGA1-siRNA gene on proliferation of K1 cells in papillary thyroid carcinoma.Methods Experimental group was transfected with HMGA1 by small interfering RNA(siRNA);the negative contrast group was transfected with HMGA1 nonrelevant sequence,and transfected with K1 cells of thyroid papillary carcinoma.The impact on the proliferation of K1 cells after the transfection of HMGA1-siRNA was tested by CCK-8.The HMGA1-mRNA expression in the normal group was tested by RT-PCR.The HMGA1 protein expression in the three groups was tested by Western blot.The invasion of K1 cells transfected with HMGA1-siRNA gene was detected by Transwell invasion assay in three groups.Results The effect of HMGA1-siRNA gene on the proliferation of K1 cells was obvious,which was relevant to time and dosage.The expression of mRNA and protein in K1 cells was significantly lower than that in normal in HMGA1-siRNA cells.The expression of mRNA and protein in K1 cells was significantly lower than that in the normal group and the negative control group.The invasion ability of K1 cells in HMGA1-siRNA group was significantly lower than that in the normal group and the negative control group.Conclusion siRNA can silence HMGA1 gene,and slow down the proliferation of papillary thyroid carcinoma K1 cells.
HMGA1-siRNA gene;papillary thyroid carcinoma;K1 cell;RNA interference technology
R 739.91
A
1000-1492(2016)06-0783-04
2016-04-13接收
安徽省高等学校自然科学基金(编号:KJ2015B106by)
1蚌埠医学院第一附属医院肿瘤外科,蚌埠 2330042安徽医科大学淮北临床学院、淮北市人民医院普外科,淮北 235100
周大新,男,硕士研究生;周 锐,男,主治医师,硕士,责任作者,E-mail:zhourui19810120@126.com;李德群,男,教授,主任医师,硕士生导师,责任作者,E-mail:lidequn8888@163.com

