人参对胃癌SGC-7901侧群细胞裸鼠移植瘤生长及Bcl-2、Bax表达的影响
钱 军,刘 元,2,郭成旭,朱 超,承泽农
人参对胃癌SGC-7901侧群细胞裸鼠移植瘤生长及Bcl-2、Bax表达的影响
钱 军1,刘 元1,2,郭成旭1,朱 超1,承泽农3
目的 探讨人参对胃癌SGC-7901侧群(SP)细胞裸鼠移植瘤生长及Bcl-2、Bax表达的影响。方法 分选SP和非侧群(NSP)细胞;熬制人参汤剂,制备人参含药血清;Western blot法检测细胞中Bcl-2、Bax表达;建立裸鼠移植瘤模型,绘制瘤体生长曲线,计算抑瘤率;免疫组化法检测瘤体Bcl-2、Bax的表达。结果 SP细胞生理盐水(NS)组移植瘤体积明显大于NSP细胞NS组(P<0.05),NS组移植瘤体积明显大于相应人参组,差异有统计学意义(P<0.01),SP细胞人参组移植瘤体积与NSP细胞人参组差异无统计学意义;SP组和NSP组人参的抑瘤率分别为43.04%、31.55%;Western blot及免疫组化显示人参可抑制移植瘤Bcl-2、诱导Bax的表达,与相应NS组比较,差异有统计学意义(P<0.05,P<0.01)。结论 SP细胞的成瘤能力较NSP细胞强,人参可以抑制裸鼠移植瘤的生长,机制可能与诱导细胞凋亡相关。
侧群细胞;非侧群细胞;裸鼠移植瘤;人参
网络出版时间:2016-5-9 15:43:10 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160509.1543.006.html
胃癌是临床上较为常见的肿瘤,手术、化疗的治疗效果均不理想。研究[1-3]表明恶性肿瘤对化疗不敏感的主要原因是侧群细胞的高致瘤性以及对药物的抵抗,侧群细胞(side population,SP)是一类能通过ABC膜转运体将DNA结合的Hoechst 33342燃料外排出细胞的一群细胞[4]。现已在多种肿瘤细胞中发现SP细胞,并证明具有高增殖、高致瘤性及耐药特性[3,5]。因此有效的干预SP细胞,可以较好地控制肿瘤的发生发展。人参是我国较为常见的传统药材,是五加科人参属植物,其药理作用表现多样,研究[6-7]显示人参对胃癌是有一定的治疗作用并且能够提高胃癌患者术后的生存率,但人参对胃癌SP及非侧群(NSP)细胞的研究较少。该实验采用药物血清干预胃癌SGC7901分选细胞,观察细胞凋亡相关蛋白的变化;建立裸鼠移植瘤模型,应用免疫组化技术,来探究人参对SP细胞的移植瘤生长及Bcl-2、Bax表达的影响。
1 材料与方法
1.1实验动物 裸鼠购自维通利华实验动物技术有限公司,品种品系:BALB/c-nu,SPF级,4周龄,均为雌性。新西兰大白鼠由蚌埠医学院动物房提供。
1.2实验试剂及药材 RPMI-1640不完全培养液(含有双抗,青霉素:80 U/ml;链霉素:0.08 mg/ ml)、胰酶消化液、胎牛血清(FBS)、磷酸盐缓冲液(PBS)购自杭州四季青公司;Hocehst33342染料购自德国Sigma公司;维拉帕米购自上海医药集团有限公司;兔抗人Bcl-2一抗、兔抗人Bax一抗购自英国Abcam公司;辣根过氧化物酶标记山羊抗小鼠IgG二抗、辣根过氧化物酶标记山羊抗兔IgG二抗购自韩国BIOSHARP公司;人参由蚌埠医学院第一附属医院中药房提供。
1.3方法
1.3.1人参汤剂、含药血清的制备 取人参15 g,以去离子水煎煮,控制生药浓度在0.2 g/ml。4℃保存备用。选择纯种新西兰大白兔10只,约2.0 kg,随机分为生理盐水(NS)组和人参组,根据“人和动物体表面积折算的等效剂量比率表”用药剂量按如下公式计。家兔用药量[g/(kg·d)]=人日用剂量×0.007/1.5[g/(kg·d)]。每组动物按等体积灌胃,每天2次,连续灌胃2周,末次灌胃前禁食不禁水12 h。末次灌胃后1 h,水合氯醛催眠大白兔,无菌心脏采血,分离收集血清,过滤除菌,EP管分装,-20℃保存。
1.3.2细胞培养 细胞放入37℃、5%CO2、95%湿度恒温培养箱中培养。每2 d换液1次,细胞长至90%后予以1∶3传代。
1.3.3SP细胞的分选 取处于对数期生长的细胞,消化,4℃、1 000 r/min离心5 min,弃上清液,用4℃预冷的PBS(含2%FBS)将细胞重悬。取其中两只离心管作为加入维拉帕米的拮抗组,余下的离心管作为实验组,加Hoechst33342染料,培养箱中孵育、振荡。孵育后4℃、1 000 r/min离心5 min,继续用4℃预冷的PBS(含2%FBS)将细胞重悬至1×106/ml。流式细胞仪器中检测分选,在350 nm波长紫外激发Hoechst33342,得到荧光呈双重波长:蓝光402~446 nm,红光650~670 nm,分别收集SP细胞及NSP细胞。
1.3.4Western blot法检测SP及NSP细胞Bcl-2、Bax蛋白表达 将SP、NSP细胞消化、4℃、1 000 r/ min离心5 min,分4组,SP及NSP细胞NS组、SP及NSP细胞人参组,分别加入不含人参药物血清和含10%人参药物血清的细胞培养液,重悬计数后转入培养瓶,干预24、48 h后提取蛋白,BCA法定量后进行电泳、转膜,封闭液4℃封闭4 h,分别加入1∶200稀释的Bcl-2、Bax抗体,4℃孵育过夜,洗膜后再加入1∶6 000稀释的二抗,4℃孵育2 h后洗膜。应用Quantity One软件(Bio-Rad)分析扫描蛋白条带的光密度,取目的蛋白条带光密度值与相应β-actin光密度值之比为其相对表达量。
1.3.5裸鼠接种细胞悬液的制备 取对数期生长的SP细胞和NSP细胞,消化离心(4℃、1 000 r/ min离心5 min)后弃上清液;用PBS重悬细胞,取0.1 ml稀释10倍;用0.4%台盼蓝染色后,血球计数板记数活细胞,当活细胞比率>95%,稀释细胞浓度至5×106/ml。
1.3.6裸鼠移植瘤实验 取裸鼠20只,随机分为2组,SP细胞组和NSP细胞组,取相应的细胞悬液并混匀,取0.2 ml接种于裸鼠右腋部偏后方皮下,再随机分为SP细胞NS组、NSP细胞NS组和SP细胞人参组、NSP细胞人参组。于接种细胞24 h后,实验组予以0.5 ml人参,对照组予以0.5 ml NS灌胃,每日1次。观察裸鼠状态和移植瘤的生长情况,每3 d测量移植瘤的长/短径(a/b),计算瘤体体积V,V=a×b2/2;第32天处死裸鼠,剥离瘤体,称取重量,计算抑瘤率,抑瘤率(%)=(NS组相对重量-相应人参组相对重量)/NS组相对重量×100%。
1.3.7免疫组化法检测肿瘤组织中Bcl-2、Bax的表达 将瘤组织常规切片后脱蜡水化;抗原修复,用FBS代替一抗做阴性对照;加1滴3%H2O2溶液至每张切片,孵育10 min(常温、避光);PBS冲洗3次,每次5 min;滴加1滴一抗至每张切片,常温下孵育2 h;PBS洗3次,每次5 min;滴加1滴聚合物增强剂至每张切片,室温下孵育20 min,PBS洗3次,每次3 min;滴1滴酶标抗鼠/兔聚合物至每张切片,室温下孵育30 min,PBS洗3次,每次5 min;滴加1滴新配置的DAB液至每张切片,显微镜下控制发色,自来水冲洗终止显色;Mayer苏木精复染,脱水透明,中性树胶封片。结果判断:阳性细胞百分比(PP):在400倍的显微镜下,选取5个不同视野,每个视野数2遍,取其平均值,作为该视野的阳性细胞数,阳性细胞数与该视野中细胞总数的比为阳性细胞百分比。然后将5个视野的阳性细胞百分比求平均值,作为该片子的PP。无阳性细胞记为0分,PP在10%以下计1分;11%~50%计2分;51%~75%计3分;75%以上计4分。染色强度(SI):无色为0分,淡黄色为1分;棕黄色为2分;棕褐色为3分。将每张切片的PP×SI得到该免疫组化的评分(IRS)[8]。
1.4统计学处理 应用SPSS 20.0软件进行分析,数据以±s表示。单因素两均数的比较用t检验,多均数间的比较用单因素方差分析。
2 结果
2.1人胃癌细胞株SGC7901中SP细胞的分选流式细胞术检测胃癌细胞株SGC-7901中SP细胞的比例为(1.53±0.47)%,维拉帕米阻断后SP细胞的比例降为0.1%。见图1。
2.2含药血清对SP、NSP细胞中Bcl-2、Bax的蛋白表达影响 Western blot结果显示,与NSP细胞NS组比较,SP细胞NS组Bcl-2表达较高(P<0.05),Bax无明显差异。与SP细胞NS组比较,SP人参24 h/48 h组Bcl-2逐步降低,Bax仅在SP人参48 h组出现明显增高(P<0.05);较NSP细胞NS组,NSP人参24 h/48 h组Bcl-2无明显变化,Bax逐渐升高(P<0.05)。Bcl-2在含药血清干预24 h SP细胞组和NSP细胞组比较差异无统计学意义,在含药血清干预48 h SP细胞组和NSP细胞组比较差异有统计学意义(P<0.05),Bax含药血清干预24 h/48 h NSP细胞组明显高于SP细胞组(P<0.05)。见图2、表1。
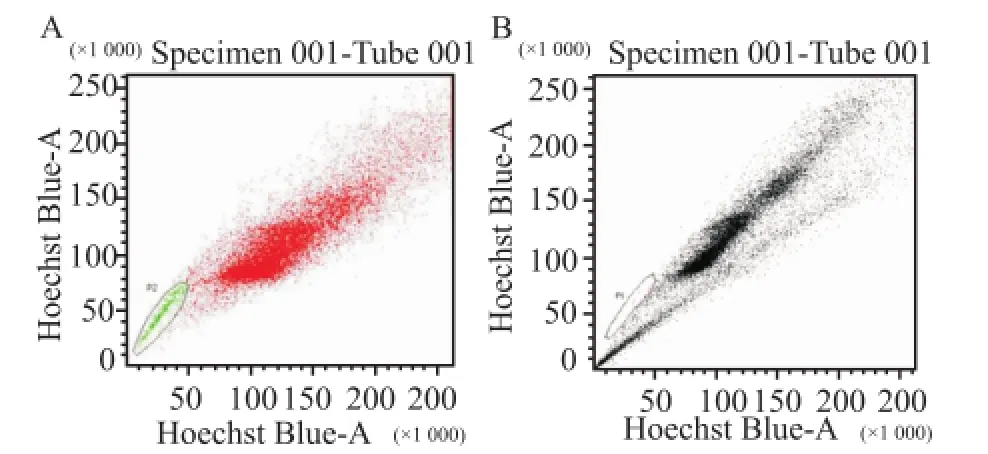
图1 胃癌细胞株SGC-7901 SP细胞检测图A:SP细胞;B:维拉帕米对照组
表1 含药血清干预细胞后Bcl-2、Bax的表达值(n=3±s)

表1 含药血清干预细胞后Bcl-2、Bax的表达值(n=3±s)
组别Bcl-2F值P值BaxF值P值SP细胞0.27±0.02 SP细胞人参(24 h)0.25±0.01417.26<0.0010.29±0.00763.00<0.001 SP细胞人参(48 h)0.05±0.020.48±0.01 NSP细胞NS0.31±0.050.29±0.04 NSP细胞人参(24 h)0.24±0.077.05<0.050.54±0.0453.51<0.001 NSP细胞人参(48 h)NS0.43±0.01 0.23±0.01 0.94±0.12

图2 含药血清干预细胞后Bcl-2、Bax的表达
2.3人参对裸鼠及移植瘤的影响 裸鼠情况均较好,实验过程中无裸鼠死亡。各组裸鼠于接种细胞后5 d可见移植瘤。在SP及NSP细胞组中,NS组移植瘤体积均大于相应人参组,SP细胞NS组瘤体体积明显大于NSP细胞NS组(P<0.01,P<0.05),SP细胞人参组与NSP细胞人参组比较差异无统计学意义,见图3。处死裸鼠后,称瘤体重量,SP细胞NS组、人参组瘤体重量分别为(3.09± 0.45)、(1.76±0.14)g,NSP细胞NS组、人参组瘤体重量分别为(2.06±0.06)、(1.41±0.35)g。SP细胞NS组瘤体重量大于NSP细胞NS组、SP细胞NS组,NSP细胞NS组的重量均大于相应人参组,差异有统计学意义(t=5.05、6.28、4.10,P<0.001);两人参组间的比较差异无统计学意义(t=2.09,P>0.05),计算得出SP细胞组及NSP细胞组人参的抑瘤率分别为43.04%、31.55%。见表2。

图3 人参对胃癌分选细胞裸鼠移植瘤生长的影响A:SP细胞NS组与NSP细胞NS组裸鼠移植瘤生长曲线间的比较;B:SP细胞NS组与SP细胞人参组裸鼠移植瘤生长曲线间的比较;C:NSP细胞NS组与NSP细胞人参组裸鼠移植瘤生长曲线间的比较;D:SP细胞人参组与NSP细胞人参组裸鼠移植瘤生长曲线间的比较
2.4移植瘤组织中Bcl-2、Bax的表达 免疫组化检测结果见图4,各蛋白染色为黄色、深棕黄色、棕褐色不等,均在胞质内着色。Bcl-2在SP细胞NS、NSP细胞NS组的表达均高于相应人参组,并且在SP细胞NS组的表达比NSP细胞NS组高,差异具有统计学意义(P<0.01,P<0.05),两人参组的表达差异无统计学意义。Bax在SP细胞NS组、NSP细胞NS组的表达均低于相应的人参组,在SP细胞NS组的表达比NSP细胞NS组低,差异有统计学意义(P<0.01,P<0.05),而两人参组的表达差异无统计学意义。见表3。
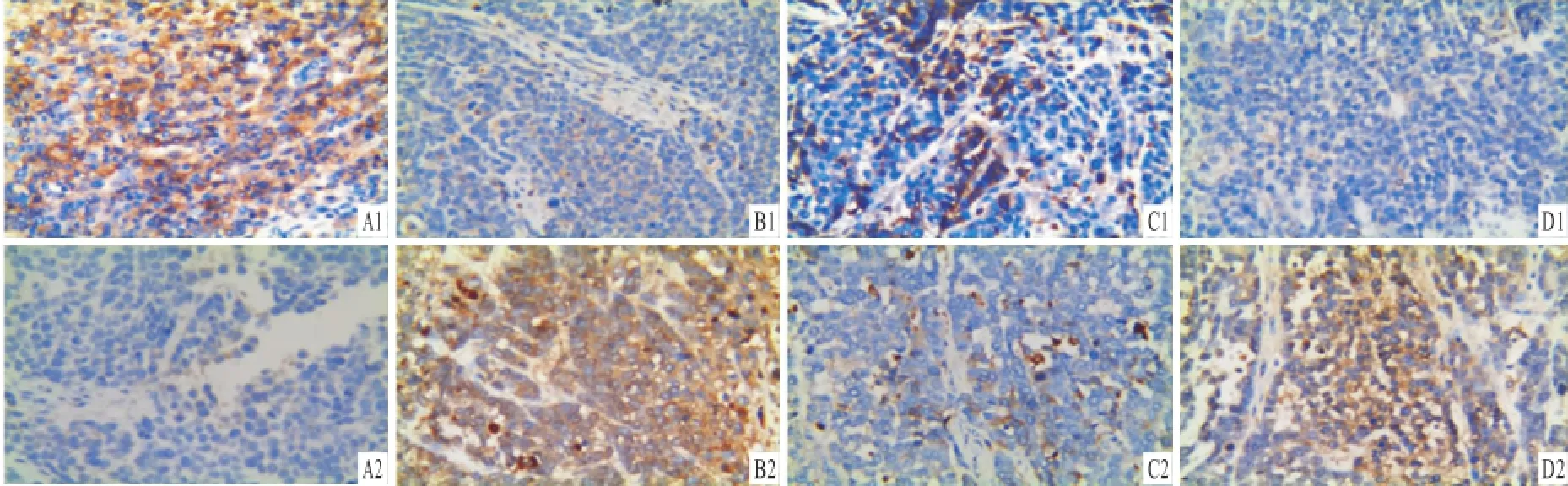
图4 人参对肿瘤组织中Bcl-2、Bax表达的影响 SP×400A:SP细胞NS组;B:SP细胞人参组;C:NSP细胞NS组;D:NSP细胞人参组;1:Bcl-2;2:Bax
表3 各组肿瘤组织Bcl-2、Bax的IRS平均分值(n=5,±s)

表3 各组肿瘤组织Bcl-2、Bax的IRS平均分值(n=5,±s)
组别Bcl-2t值P值Baxt值P值SP细胞NS7.4±1.348.22<0.0012.8±0.844.49<0.01 SP细胞人参2.2±0.458.0±2.45 NSP细胞NS5.6±0.898.53<0.0011.4±0.556.78<0.001 NSP细胞人参1.6±0.556.0±1.41
3 讨论
近些年来就中国传统药物对胃癌治疗的研究已成为研究热点,其原因归结于中药对肿瘤的治疗有效、药物副作用低、价廉等优点,随着对中药的不断研究,其抗肿瘤机制也有一定的了解,如对溶酶体的影响[9]、诱导肿瘤细胞凋亡[10]、激活免疫系统间接抑制肿瘤[11]等。人参被称为“百草之王”,是国内外著名的滋补类稀有药材。其对多种肿瘤细胞的增殖均具有抑制作用[12]。
本实验显示胃癌细胞SGC7901含有少量的SP细胞,灌胃后的兔血清中含有人参的有效成分,可以应用于细胞体外实验中;本实验结果表明相同数量的SP细胞较NSP细胞的成瘤能力强,与研究结果[3]相符。凋亡通路主要有线粒体通路、死亡受体通路和内质网通路,而最主要的是线粒体通路[13],由Bcl-2蛋白家族引起线粒体膜通透性增加,进而引起一系列级联反应[14],抗凋亡蛋白Bcl-2和促凋亡蛋白Bax是Bcl-2蛋白家族成员,其比例最终决定了细胞的存亡[11]。Fan et al[15]发现SP细胞较NSP细胞有更强的抗凋亡能力与其高表达Bcl-2有关,本研究Western blot实验结果表明SP细胞Bcl-2的表达较NSP细胞高。在人参作用于细胞不同的时间段,人参对SP细胞、NSP细胞均有一定的诱导凋亡的作用,总体表现在降低Bcl-2/Bax的比值,与实验[11]结果一致。但人参可以更明显地诱导NSP细胞Bax的表达,这可能与Hoechst 33342染料引起NSP细胞状态差有关。
在免疫组化结果中,SP细胞NS组与NSP细胞NS组比较,高表达Bcl-2,低表达Bax,经人参干预后,两细胞组Bcl-2的表达均较相应NS组低、Bax表达较NS组高,与Western实验结果基本相符,表明SP细胞在体内具有较强的成瘤与其抗凋亡能力有一定的关系,人参可以抑制肿瘤的生长与诱导细胞凋亡存在一定的联系。
在体外细胞层面,人参诱导NSP细胞Bax的表达较SP细胞强,而在体内实验却未见这种现象,这种差异可能与裸鼠的药物代谢及转运相关,就体内体外实验的区别将予以进一步研究。
综上所述,胃癌细胞SGC-7901中有少量的SP细胞,SP细胞在裸鼠成瘤方面要强于NSP细胞,这与SP细胞具有较强的抗凋亡能力有关。人参对SP、NSP细胞裸鼠成瘤具有一定的抑制作用,其机制与抑制肿瘤细胞Bcl-2,上调Bax的表达,从而诱导细胞凋亡存在一定的相关性。由于目前对于人参的研究尚处于基础实验阶段,确切机制尚待探讨,希望不久人参对胃癌的治疗可以应用于临床。
[1] Zhao Y,Bao Q,Schwarz B,et al.Stem cell-like side populations in esophageal cancer:a source of chemotherapy resistance and metastases[J].Stem Cells Dev,2014,23(2):180-92.
[2] Xie Z Y,Lv K,Xiong Y,et al.ABCG2-meditated multidrug resistance and tumor-initiating capacity of side population cells from colon cancer[J].Oncol Res Treat,2014,37(11):666-72.
[3] Zhang H H,Cai A Z,Wei X M,et al.Characterization of cancer stem-like cells in the side population cells of human gastric cancer cell line MKN-45[J].J Zhejiang Univ-Sci B,2013,14(3):216 -23.
[4] She J J,Zhang P G,Wang X,et al.Side population cells isolated from KATO III human gastric cancer cell line have cancer stem cell-like characteristics[J].World J Gastroenterol,2012,18(33):4610-7.
[5] Xing L L,Sha Y L,Wu Y M,et al.Preliminary analysis of stem cell-like cells in human neuroblastoma[J].World J Pediatr,2015,11(1):54-60.
[6] Suh S O,Kroh M,Kim N R,et al.Effects of red ginseng upon postoperative immunity and survival in patients with stage III gastric cancer[J].Am J Chin Med,2002,30(4):483-94.
[7] Lee J H,Kwon K R,Cho C K,et al.Advanced cancer cases treated with cultivated wild ginseng phamacopuncture[J].J Acupunct Meridian Stud,2010,3(2):119-24.
[8] 许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-31.
[9] Yang N D,Tan S H,Ng S,et al.Artesunate induces cell death in human cancer cells via enhancing lysosomal function and lysosomal degradation of ferritin[J].J Biol Chem,2014,289(48):33425-41.
[10]Zhang Y,Bao Y L,Wu Y,et al.Alantolactone induces apoptosis in RKO cells through the generation of reactive oxygen species and the mitochondrial pathway[J].Mol Med Rep,2013,8(4):967 -72.
[11]Wang Y,Huang M,Sun R,et al.Extraction,characterization of a Ginseng fruits polysaccharide and itsimmune modulating activities in rats with Lewis lung carcinoma[J].Carbohydr Polym,2015,127:215-21.
[12]Cichello S A,Yao Q,Dowell A,et al.Proliferative and inhibitory activity of siberian ginseng(Eleutherococcus senticosus)extract on cancer cell lines;A-549,XWLC-05,HCT-116,CNE and Beas-2b[J].Asian Pac J Cancer Prev,2015,16(11):4781-6.
[13]杜 雪,糜若然.VEGF-C对宫颈癌细胞增殖和凋亡信号传导通路的影响[J].现代妇产科进展,2011,20(11):877-85.
[14]Yuan S,Akey C W.Apoptosome structure,assembly,and procaspase activation[J].Structure,2013,21(4):501-15.
[15]Fan J,Li R,Zhang R,et al.Effect of Bcl-2 and Bax on survival of side opulation cells from hepatocellular carcinoma cells[J]. World J Gastroenterol,2007,13(45):6053-9.
Effect of Ginseng on human gastric cancer SGC-7901 side population cells xenograft tumor in nude mice and the expression of Bcl-2,Bax
Qian Jun1,Liu Yuan1,2,Guo Chengxu2,et al
(1Dept of The Third Tumor Surgical,The First Affiliated Hospital of Bengbu Medical College,Bengbu 233000;2Dept of Graduate,Bengbu Medical College,Bengbu 233000)
Objective To explore the affection of Ginseng on the growth of humangastric cancer SGC-7901 side population(SP)cells xenografts in nude mice and expression of Bcl-2,Bax.Methods Sorting out SP cells and non-side population(NSP)cells by flow cytometry;preparation of Ginseng decoction;tumor volume were measured to draw tumor growth curves and the tumor weight inhibition rates were calculated with tumor weight.The expressions of Bcl-2,Bax were detected by immunohistochemical technology,preparation containing Ginseng drug serum,Western blot technique was used to detect the expression of Bcl-2,Bax.Results The volume of transplanted tumors in SP cells NS group was bigger than group of NSP cells NS group(P<0.05).The tumor volume of NS was bigger than Ginseng group(P<0.01).The tumor inhibitory rates in the group of Ginseng in SP cells and NSP cells were 43.04%,31.55%,respectively.The results of Western blot and immunohistochemical staining showed that Ginseng could inhibit the expression of Bcl-2 and induce the expression of Bax,the difference was statistically significant(P<0.05,P<0.01).Conclusion The tumorigenicity of SP cells is stronger than NSP cells.Ginseng can restrain the growth of the nude mouse transplanted tumor,and the mechanism may be associated with inducing cell apoptosis.
side population cells;non-side population cells;nude mice transplantated tumor;Ginseng
R 965.2
A
1000-1492(2016)06-0773-05
2016-02-22接收
国家自然科学基金资助项目(编号:81173386)
蚌埠医学院第一附属医院1肿瘤外三科、3病理科,蚌埠2330002蚌埠医学院研究生部,蚌埠 233000
钱 军,男,主任医师,教授,硕士生导师,责任作者,E-mail:qianjun215036@sina.com

