高效液相法测定草鱼糜发酵过程中生物胺变化
曾 妮,江 勇,陈丽丽,赵 利,*,白春清,袁美兰,魏 颖
(1.江西科技师范大学 生命科学学院,江西南昌 330013;2.国家淡水鱼加工技术研发分析中心(南昌),江西南昌 330013)
高效液相法测定草鱼糜发酵过程中生物胺变化
曾妮1,2,江勇1,2,陈丽丽1,2,赵利1,2,*,白春清1,2,袁美兰1,2,魏颖1,2
(1.江西科技师范大学 生命科学学院,江西南昌 330013;2.国家淡水鱼加工技术研发分析中心(南昌),江西南昌 330013)
本文采用纳豆芽孢杆菌和戊糖片球菌组成的混合发酵剂对草鱼鱼糜进行发酵,建立了发酵鱼制品中六种生物胺(色胺、腐胺、尸胺、组胺、酪胺、亚精胺)的高效液相色谱分析方法,研究了鱼糜发酵过程中生物胺含量的变化以及微生物数量的变化。结果发现,在30 min内各种生物胺得到很好的分离,且线性关系良好(R2>0.999),回收率在97.35%~103.00%,精密度、重现性RSD均小于10%。添加混合发酵剂可以明显抑制金黄色葡萄球菌、假单胞菌和大肠杆菌等杂菌的生长,降低发酵过程中腐胺、尸胺、组胺和酪胺含量的积累;利用纳豆芽孢杆菌,戊糖片球菌组成的混合发酵剂以及一系列负控脱羧酶活动能有效抑制鱼糜发酵过程中生物胺的形成,抑制腐败菌和致病菌的生长,提高鱼糜发酵食品的品质。
高效液相色谱,生物胺,草鱼糜,混合发酵剂,微生物数量分析
水产品是世界上重要的食物之一,利用海水鱼或者淡水鱼发酵生产的鱼糜制品是一种传统的提高成品感官和卫生质量的方式[1],例如plaa-som[2]就是一种利用乳酸菌和酵母菌发酵制得的泰国食品。

本研究在国标的基础上进行修改,提高生物胺检出限为1000 mg/kg,通过简化流动相和改变梯度洗脱程序,得到了生物胺衍生物出峰时间短,杂峰干扰少,分离度好,且精密度、平均加标回收率和相对标准偏差都符合检测要求的生物胺的高效液相色谱-紫外检测方法。以混合发酵剂发酵的鱼糜为研究对象,检测其发酵过程中主要生物胺含量的变化,同时测定了微生物指标的变化,为淡水产品加工中生物胺的安全风险评估及食用淡水产品安全性提供理论支持。
1 材料与方法
1.1材料与仪器
草鱼鱼糜 新鲜草鱼肉-18 ℃冻藏30±3 d后绞碎;纳豆芽孢杆菌(n-3)江西农业大学食品学院提供;戊糖片球菌(x-4、x-5)南昌大学食品科学重点实验室提供;胶原蛋白肠衣 上海班泰食品肠衣厂。
组胺、腐胺、尸胺、色胺、酪胺、亚精胺美国Fluka公司;丹磺酰氯(99%)美国sigma公司;乙腈(色谱纯)美国天地公司;1,7-二氨基庚烷(98%)、高氯酸(优级纯)成都格雷西亚化学技术有限公司;水平板计数琼脂培养基、甘露醇高盐培养基、CN琼脂培养基、结晶紫中性红胆盐琼脂培养基等青岛高科园海博生物技术有限公司;丙酮、碳酸氢钠、氨水、氯化钠优级纯。
Agilent 1100高效液相色谱仪美国安捷伦公司;BHC 1000ⅡA/B3型生物安全柜苏州安泰空气技术有限公司;HA-300MD型高压灭菌器日本株式会社平山制作所;绞肉机 TJ12-H广东恒联食品机械有限公司;SPX-100B-Z型生化培养箱上海博讯实业有限公司医疗设备厂。
1.2实验方法
1.2.1发酵鱼糜的制备冷冻草鱼肉绞碎,5000 r/min离心10 min后弃去上清液→空擂混匀5 min→加入2%葡萄糖和2%NaCl斩拌10 min→加入3%由纳豆芽孢杆菌(n-3)、戊糖片球菌(x-4、x-5)组成的混合发酵剂(菌种比例为1∶1∶1)并斩拌10 min→灌肠→37 ℃恒温发酵36 h→制得发酵肠样品。
1.2.2生物胺的测定根据国标GB/T 20768-2006[15]中的生物胺检测法进行修改,将生物胺的检出限提高至1000 mg/kg,简化流动相,修改梯度洗脱程序,以缩短所有溶剂峰的出峰时间并减少杂峰的干扰。
1.2.2.1标准溶液的制备精确称取色胺、腐胺、尸胺、组胺、酪胺或者亚精胺标准品,用0.1 mol/L HCl溶液配制成质量浓度为1.0000 mg/mL的生物胺单标储备液。分别吸取相同体积各生物胺单标储备液,混匀后稀释成100 μg/mL的生物胺混标工作液。精确称取1,7-二氨基庚烷,用0.1000 mol/L盐酸溶液配制成1 mg/mL的内标使用液。所有溶液均4 ℃避光保存。
1.2.2.2样品预处理取5.0 g绞碎后的发酵鱼糜制品,加20 mL 0.4 mol/L高氯酸溶液,250 μL内标溶液后均质,振荡提取5 min,静置后5000×g离心35 min,将上清液移入50 mL容量瓶中,沉淀重复提取一次,上清液合并并定容至刻度。
1.2.2.3样品的衍生衍生过程参考Ben[16]等人的方法并稍作修改。取1 mL生物胺混标工作液或样品提取液至5 mL容量瓶中,依次加入200 μL 2 mol/L氢氧化钠溶液和300 μL饱和碳酸氢钠溶液,将溶液调整pH至10.5,再加入2 mL内标使用液,密封避光45 ℃反应45 min,加100 μL氨水终止反应,静置15 min后氮气吹去丙酮,乙腈定容,混匀后取上清液过0.22 μm微孔滤膜,供液相色谱使用。
1.2.2.4色谱条件色谱柱:Waters C18柱,4.6 mm×150 mm,5 μm;流动相:A为纯水,B为乙腈;柱温35 ℃;进样量10 μL;流速1 mL/min,梯度洗脱程序见表1;紫外检测器波长:254 nm;以峰面积内标法定量。

表1 生物胺衍生样品的分离洗脱梯度Table 1 Elution gradient of mobile phase for separation of benzyl derivertives of biogenic amines
1.2.2.5线性实验、精密度实验及加标回收率实验线性实验:将生物胺混标工作液用0.1 mol/L盐酸溶液分别稀释至100、80、60、40、20、10、5、1和0.5 μg/mL,按1.2.2.3节中衍生方法和1.2.2.4节色谱条件进行测定,以生物胺混标工作液的质量浓度为横坐标、生物胺与内标的峰面积比为纵坐标制作标准曲线,得到线性回归方程及其相关系数R2。
精密度实验:制备质量浓度为10 μg/mL的生物胺混标工作液,平行衍生2次,分别进样3次,采用上述方法进行处理和测定,计算相对标准偏差RSD%。
加标回收率实验:选取样品(添加混合发酵剂组发酵36 h)分别加入质量浓度为100 μg/mL的生物胺混标工作液,使其添加量分别相当于5 μg/mL和10 μg/mL,衍生后平行测定3次,计算各生物胺回收率及相对标准偏差。
1.2.3微生物数量分析无菌取样10 g置于均质袋内,加入90 mL无菌生理盐水,用拍击式均质器8000 r/min均质2 min,吸取1 mL上清液,依次进行10倍梯度稀释,用稀释平板法在不同的选择性培养基上培养计数:
细菌总数用PCA培养基(PlatecountAgar),37 ℃培养48 h;金黄色葡萄菌用甘露醇高盐(Mannitol Salt Agar)琼脂培养基,37 ℃培养48 h;假单胞菌用CN(CN Agar)琼脂培养基,30 ℃培养48 h;肠道菌用VRBA结晶紫中性红胆盐琼脂培养基(Violet Red Bile Agar),37 ℃双层培养24 h后挑取10个不同类型的红色典型菌落,分别移种于煌绿乳糖胆盐(Brilliant Green Lactose Bile,BGLB)肉汤管内,37 ℃培养48 h,观察产气情况,产气者可视为肠道菌,按所占比例计算样品肠道菌数;乳酸菌用MRS培养基,37 ℃厌氧培养48 h;芽孢杆菌用无菌取样样液在85 ℃处理15 min,冷却后用PCA培养基(PlatecountAgar),37 ℃培养24 h。
1.3数据处理
实验数据采用SPSS Statistics 17.0软件进行统计分析,采用Origin 7.5软件作图。
2 结果与分析
2.1生物胺的高效液相色谱检测法
2.1.1生物胺标准品图谱和实际样品图谱采用梯度程序洗脱,生物胺标准品衍生物图谱见图1。结果显示,使用该流动相及梯度洗脱程序可在前30 min内流出全部溶剂峰,在30 min内试样中所有待检生物胺可以全部洗脱出来。经计算相邻两种生物胺衍生物的分离度分别为20.60、7.55、3.62、15.94、19.90和9.76,均大于2,说明经该流动相及洗脱程序洗脱后,6种生物胺标准品及内标衍生物能有效得到分离且峰型良好。从图2实际样品色谱可以看出各生物胺衍生物峰型对称,杂质干扰少,因此该流动相梯度洗脱检测生物胺是可行的。

图1 生物胺标准品HPLC色谱图(100 μg/mL)Fig.1 HPLC chromatogram of biogenic amine standards(100 μg/mL)注:Tyr:色胺,Put:腐胺,Cad:尸胺,His:组胺, Tyr:酪胺,Spd:亚精胺,IS:内标,图2同。

图2 接种混合发酵剂样品A(MSC36h) 和未接种混合发酵剂样品B(NS36h)HPLC色谱图Fig.2 HPLC chromatogram of sample A(MSC36h)fermented with mixed starter cultures and sample B(NS36h) fermented without mixed starter cultures
2.1.2标准曲线回归方程、精密度及加标回收率将不同质量浓度的生物胺标准溶液依次进样,计算标准曲线的回归方程及相关系数。从表2中可知,各生物胺衍生物线性回归方程在0.5~100 μg/mL线性范围内的线性关系系数R2均大于0.999,说明峰面积与生物胺衍生物含量之间具有显著的线性关系,符合测定要求。从表3中可知,对10 μg/mL的生物胺混标工作液连续进样实验中,色胺、腐胺、尸胺、组胺、酪胺和亚精胺的测定结果RSD值分别为1.01%、1.86%、1.82%、1.85%、1.70%和1.20%,RSD值均小于2%,精密度符合检测要求。各添加水平的平均加标回收率和相对标准偏差如表4所示,6种生物胺标准品回收率在97.35%~103.00%,重现性RSD在1.70%~4.81%,均小于10%,因此该方法可以用来检测发酵鱼糜制品中的生物胺含量。
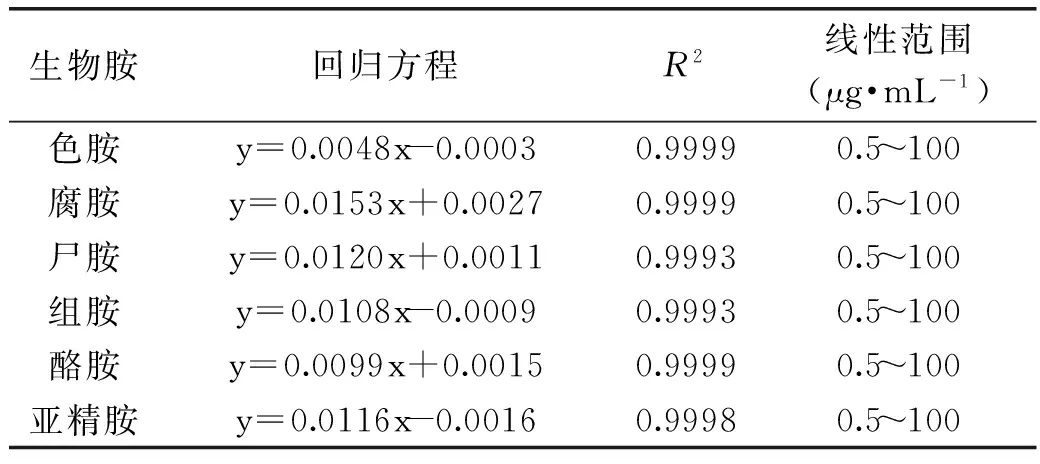
表2 标准曲线的回归方程及其他线性实验结果Table 2 Result of regression equations and other linear experiment

表3 精密度实验结果Table 3 Precision results

表4 发酵鱼糜样品中生物胺回收率实验结果Table 4 Recovery of biogenic amines in fermented with mixed starter cultures

表5 鱼糜发酵过程中生物胺的变化Table 5 Changes of biogenic amines in frozen grass crap surimi fermentation
注:NS(对照组)未添加发酵剂;MSC(发酵剂组),添加混合发酵剂。
2.2草鱼糜发酵过程中生物胺含量及微生物数量的变化
2.2.1生物胺含量表5是鱼糜发酵过程中生物胺的变化,比较了草鱼鱼糜分别在未接种混合发酵剂(对照组)和接种混合发酵剂(发酵剂组)后,在37 ℃发酵至36 h过程中6种生物胺含量的变化情况。从表5中可知,在0 h时,即新鲜草鱼肌肉组织中,生物胺的含量非常低,经检测最低的生物胺为腐胺0.1 mg/kg,最高的为酪胺10.09 mg/kg。
对照组中几种生物胺的含量随着发酵时间的延长急剧增加,部分生物胺类即使在初始原料中含量相对较低,但随着发酵时间的延长,逐渐产生并积累,如经37 ℃发酵12 h后,尸胺含量快速上升,从0.52 mg/kg上升至22.78 mg/kg,上升了22.26 mg/kg,酪胺含量从10.09 mg/kg上升至45.39 mg/kg,上升了35.3 mg/kg;经37 ℃发酵至24 h时,腐胺和组胺含量上升较慢,尸胺和酪胺含量快速上升;发酵36 h后,对照组中尸胺含量上升了258.84 mg/kg,为原料中尸胺含量的497.8倍,腐胺含量上升了16.68 mg/kg,为原料中腐胺含量的166.8倍,其后分别是酪胺、色胺、亚精胺、腐胺和组胺,生物胺的含量与发酵前相比有显著增加,特别是尸胺和酪胺。对照组在发酵后期腐胺含量接近20 mg/kg,有腐败和臭味[10]。
发酵剂组的草鱼鱼糜中,亚精胺含量上升最少,经37 ℃发酵至36 h时仅为14.75 mg/kg;酪胺含量上升至79.41 mg/kg;组胺含量上升至7.38 mg/kg;尸胺含量上升最多,由0.52 mg/kg上升至185.66 mg/kg,上升了356倍。总体来说,与对照组相比,发酵组的鱼糜中,色胺、腐胺、尸胺和组胺含量的累积速度变慢。对照组鱼糜中生物胺含量高度累积与几种微生物相关,如微球菌,肠道菌,假单胞菌和部分乳酸菌。多数肠道菌和假单胞菌具有组氨酸和赖氨酸等氨基酸脱羧酶活力,能分解产生尸胺、酪胺和组胺等[17]。对照组鱼糜中乳酸菌生长缓慢,不能抑制有害微生物的生长,蛋白酶和氨基酸脱羧酶活性较高,从而导致发酵过程中更易产生大量的生物胺。接种含有乳酸菌的混合发酵剂后,乳酸菌大量生长,鱼糜pH快速降低,发酵过程中的酸化环境能较好的抑制杂菌生长,抑制蛋白酶和氨基酸脱羧酶,同时经筛选的不具有氨基酸脱羧酶活性的菌种组成的混合发酵剂,能明显抑制生物胺的形成,提高产品的安全性,Zhong[1]等人的研究得到了类似的结论。

图3 发酵草鱼鱼糜过程中微生物的变化Fig.3 Microbiological changes in frozen grass crap surimi fermented with/without mixed starter cultures
2.2.2微生物数量分析由图3中可看出,发酵剂组在发酵过程中菌落总数、金黄色葡萄球菌数、假单胞菌数和大肠杆菌数均呈现先增加后降低的趋势;对照组中菌落总数、金黄色葡萄球菌数和假单胞菌数一直持续上升,大肠杆菌数在发酵后期有少量下降,但也明显高于发酵剂组。在发酵初期,鱼糜中含有丰富的营养物质,且水分含量高,适宜微生物的生长,接种混合发酵剂后,随着时间的延长,乳酸菌表现出较高的竞争性,由7.96 log CFU/g上升到10.48 log CFU/g,后稳定在8.6 log CFU/g以上。乳酸菌利用原料中的碳水化合物快速生长繁殖,产生乳酸,使得pH快速降低,较低的pH能有效抑制葡萄球菌、假单胞菌和肠科杆菌等杂菌的生长[18-19]。对照组中乳酸菌生长缓慢,产酸速率低,在36 h时菌落总数达到8.73 log CFU/g,金黄色葡萄球菌数为7.80 log CFU/g,假单胞菌数为3.41 log CFU/g,大肠杆菌数为7.30 log CFU/g,均高于发酵剂组。Yin等[18]认为乳酸菌产生有机酸或其他抑菌物质能抑制有害杂菌生长。在所选择的发酵时间范围内,乳酸菌数量都远高于其他几种微生物,发酵剂组和对照组中芽孢杆菌数之间无显著差异,故推断乳酸菌为草鱼鱼糜发酵过程中的优势菌,能有效抑制发酵过程中腐败菌和致病微生物的生长,抑制发酵鱼糜制品中的生物胺积累。
3 结论
以丹磺酰氯为衍生剂,1,7-二氨基庚烷为内标,在国标的基础上进行了修改,将检出限提高至1000 mg/kg,简化了流动相,并调整梯度洗脱程序,缩短了目标生物胺衍生物的出峰时间,建立了发酵草鱼鱼糜中生物胺的高效液相色谱-紫外检测方法。使用该方法可将目标生物胺在30 min内全部分离,各生物胺衍生物分离效果好,在0.5~100 μg/mL线性范围内的线性关系系数R2均大于0.999,生物胺回收率在97.35%~103.00%,重现性RSD均小于10%,各目标峰未受到杂峰干扰,方法灵敏可靠。
测定了接种混合发酵剂的草鱼鱼糜中生物胺含量和微生物数量变化,接种混合发酵剂的草鱼鱼糜在发酵过程中腐胺、尸胺、组胺、酪胺含量下降明显,亚精胺含量有少量下降,乳酸菌为发酵过程中的优势菌,且能有效抑制葡萄球菌、假单胞菌和肠科杆菌等杂菌的生长。
[1]Zhong-YiL,Zhong-Hai L,Miao-Ling Z,et al.Effect of fermentation with mixed starter cultures on biogenic amines in bighead carp surimi[J].International Journal of Food Science & Technology,2010,45(5):930-936.
[2]Pramuan Saithong,Wanchai Panthavee,Malai Boonyaratanakornkit,et al.Use of a starter culture of lactic acid bacteria in plaa-som,a Thai fermented fish[J].Journal of Bioscience and Bioengineering,2010,1105:553-557.
[3]Cinquina A L,Calì A,Longo F,et al.Determination of biogenic amines in fish tissues by ion-exchange chromatography with conductivity detection[J].Journal of Chromatography A,2004,1032(1-2):73-77.
[4]Santos C,Marin A,Rivas JC.Changes of tyramine during storage and spoilage of anchovies[J].Journal of Food Science,1986,51(3):512-513,515.
[5]Yeh C Y,Lin S J,Hwang D F.Biogenic amines,histamine and label of dressed fried fish meat products in Taiwan[J].Food Control,2006,17(6):423-428.
[6]Nout M J R.Fermented foods and food safety[J].Food Research International,1994,27(94):291-298.
[7]Mietz J L,Karmas E.Chemical quality index of cannel tuna as determined by HPLC[J].Journal of Food Science,1997,42(1):155-158.
[8]Rivas S B,Ruiz-capillas C,Carrascosa A V,et al.Biogenic amine production by bacteria isolated from Spanish dry-cured “chorizo” sausage treated with high pressure and kept in chilled storage[J].Meat Science,2008,80(2):271-277.
[9]Shalaby AR.Significance of biogenic amines to food safety and human health[J].Food Research International,1996,27(3):675-690.
[11]Lehane L,Olley J.Histamine fish poisoning revisited[J].International Joumal of Food Microbiology,2000,58(1-2):1-37.
[12]Shakila RJ,Vasundhara TS,Kumudavally KV.A comparison of the TLC-densitometry and HPLC method for the determination of biogenic amines in fish and fishery produets[J].Food Chemistry,2001,75(2):255-259.
[13]Lange J,Wittmann C.Enzyme sensor array for the determination of biogenic amines in food samples[J].Analytical and Bioanalytical Chemistry,2002,372:276-283.
[14]Østergaard A,Embarek PKB,Wedell-Neergaard C,et al.Characterization of anti-listerial lactic acid bacteria isolated from Thai fermented fish products[J].Food Microbiol,1998,15(2):223-233.
[15]GB/T 20768-2006,中华人民共和国国家标准 鱼和虾中有毒生物胺的测定[S].
[16]Ben-Gigirey B,De Sousa J.Changes in biogenic amines and microbiological analysis in albacore(Thunnus alalunga)muscle during frozen storage[J].Journal of Food Protection,1998,61(5):608-615.
[17]Ozogul Y,Ahmad JI,Hole M,et al.The effects of partial replacement of fish meal by vegetable protein sources in the diet of rainbow trout(Onchorynchus mykiss)on postmortem spoilage of fillets[J].Food Chemistry,2006,96(4):549-561.
[18]Yin LJ,Pan CL,Jiang ST.Effect of lactic acid bacterial fermentation on the characteristics of minced mackerel[J].Journal of Food Science,2002,67(2):786-792.
[19]Hu YJ,Xia WS,Liu XY.Changes in biogenic amines in fermented silver carp sausages inoculated with mixed starter cultures[J].Food Chemistry,2007,104(1):188-195.
Determination of biogenic amines in the fermentation process of grass carp surimi by a high-performance liquid chromatography method
ZENG Ni1,2,JIANG Yong1,2,CHEN Li-li1,2,ZHAO Li1,2,*,BAI Chun-qing1,2,YUAN Mei-lan1,2,WEI Ying1,2
(1.College of Life Science,Jiangxi Science and Technonlgy Normal University,Nanchang 330013,China;2.National Freshwater Fish Processing Technology Research and Development Branch,Nanchang 330013,China)
The effects of one group mixed starter cultures,combined withBacillusnattoandLactobacilluspentosus,and a batch without starter as control on biogenic amines accumulation in the grass carp surimi during fermentation were investigated.Methods of simultaneous determination of six biogenic amines(tryptamine,putrescine,cadaverine,histamine,tyramine,spermine)by high-performance liquid chromatography were developed.The method had a good resolution in 30 minutes and good linearity(R2>0.999),the recovery rate was between 97.35%~103.00%,and the RSD of precision,repeatability were all lower than 10%.Fermentation inoculated with mixed starter cultures can inhibited the growth of contaminant microoroganisms,such asStaphylococcusaureus,EnterobacteriaceaeandPseudomonas, and suppressed the accumlation of putrescine,cadaverine,histamine,tyramine.In order to improve hygienic quality of fermented surimi,Bacillusnatto,Lactobacilluspentosuswere added to activate the function of negative-decarboxylase which can prevent biogenic amine formation,inhibited the spoilage bacteria and pathogens.
high-performance liquid chromatography;biogenic amines;grass carp surimi;mixed starter cultures;microbiological analysis
2015-10-16
曾妮(1990-),女,硕士研究生,研究方向:微生物学,E-mail:15170071552@163.com。
赵利(1967-),女,博士,教授,研究方向:食品化学,E-mail:lizhao618@hotmail.com。
江西省高等学校科技落地计划项目(KJLD12009);国家农业科技成果转化项目(国科办农[2014]42号);江西省现代农业产业技术体系建设专项资金资助。
TS254
B
1002-0306(2016)09-0117-06
10.13386/j.issn1002-0306.2016.09.015

