灵芝菌丝体破碎处理方法的比较
秦可欣,石彦国,孙冰沁,陈 浩,何国庆,*
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076;2.浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
灵芝菌丝体破碎处理方法的比较
秦可欣1,石彦国1,孙冰沁2,陈浩2,何国庆2,*
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076;2.浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
灵芝是一种珍贵的药用真菌,含有多种生物活性物质,如灵芝多糖、三萜类化合物,同时具有较高的产β-葡萄糖苷酶活性。为了提高灵芝菌丝体中β-葡萄糖苷酶的利用效率,需要对菌丝进行破碎处理而使酶释放出来。本文研究了通过打浆处理、升温自溶、反复冻融和超声破碎的方式来提取灵芝菌丝体中的β-葡萄糖苷酶,并比较了不同方法的提取效果。结果表明,以匀浆和超声破碎结合的组合方法最佳,先在冰浴中匀浆处理1 min,在200 W下再以每超声1 min间歇1 min的方式超声破碎5次,β-葡萄糖苷酶的总活力可以达到3.116 U/mL,比直接提取提高了112.26%。显微镜观察到匀浆后菌丝球可全部分散开,同时菌丝被不同程度的切断,再经超声破碎处理,菌丝几乎全部破碎。
灵芝菌丝体,β-葡萄糖苷酶,提取,匀浆,超声破碎
灵芝(Ganodermalucidum(Leyss.ex Fr.)Karst)是一种珍贵的药用真菌,含有多种生物活性物质,如灵芝多糖、灵芝三萜以及各种酶类,具有多种生理功能和宝贵的药用价值[1-2]。液体培养的菌丝体可以发挥与子实体相同的生物活性,通过液体深层发酵培养可加速菌丝生成,缩短生长周期[3]。研究表明灵芝、香菇等担子菌具有较好的产β-葡萄糖苷酶活性[4]。大豆异黄酮(Soybeanisoflavone)是大豆中多酚化合物的总称,分为游离型苷元和结合型糖苷两类,具有与雌激素相同的生物活性[5]。其中苷元占总量的2%~3%,结合型糖苷占总量的97%~98%。研究发现,糖苷形式的大豆异黄酮在体内不能直接被小肠壁吸收,必须将其转化为游离型的苷元才能被吸收,因而发挥生物活性的是游离型的苷元。β-葡萄糖苷酶是一种纤维素酶类,其特性是可水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-葡萄糖和相应的配基,因此可用于大豆异黄酮糖苷的生物转化[6]。利用含有β-葡萄糖苷酶的菌丝体进行异黄酮的生物转化,形成黄酮苷元,大幅提高异黄酮的生物活性及其生物利用度,是开发多因子保健功能食品的新途径。目前在日本、美国等国家已有研究者利用灵芝、灰树花等食用菌发酵转化大豆异黄酮糖苷,并与食用菌多糖相结合制成了一种有效的抗肿瘤药物,在日本和美国被广泛的用于肿瘤的预防和治疗,取得了很好的疗效[7]。浙江大学的崔美林博士对灵芝发酵转化大豆异黄酮的条件进行了优化,最终大豆苷和燃料木苷的转化率均可达到98%以上,经过体外抗氧化性实验可以看出转化后产品具有较好的体外抗氧化作用[8]。
为了提高灵芝菌丝体中β-葡萄糖苷酶的利用效率,需要对灵芝菌丝体进行破壁处理,使酶释放出来,提高其酶活力。目前的研究中一般只是通过离心直接提取粗酶液或对菌丝体简单的匀浆处理[9]。细胞破碎的方式有很多,例如高压匀浆、研磨、反复冻融、超声破碎、渗透压冲击、酶溶、化学渗透等[10-12],实际操作过程要根据所需胞内物质的性质而选择相适应的破碎方法。本实验采用匀浆处理、升温自溶、反复冻融和超声破碎的方式来对菌丝进行破壁处理,并通过多种方法组合处理的方式来增加β-葡萄糖苷酶的释放。
1 材料与方法
1.1材料与仪器
赤芝(G.lucidum·karst)河南省科学院食用菌工程技术中心;磷酸二氢钾,无水硫酸镁,维生素B1,琼脂,柠檬酸,十二水磷酸氢二钠,碳酸钠,乳酸,分析纯国药集团化学试剂有限公司;对硝基苯酚(pNP)、对硝基苯基-β-D-葡萄糖苷(pNPG)阿拉丁试剂(上海)有限公司;斜面培养基:PDA 4.5%、琼脂 1.7%、KH2PO40.3%、MgSO40.15%、VB10.005%;种子培养基:PDB 3.5%、蛋白胨 0.5%、酵母浸粉 0.3%、KH2PO40.3%、MgSO40.15%、VB10.005%、pH6.0;发酵培养基:麦芽汁(20o)30%、豆粕粉 6%、KH2PO40.3%、MgSO40.15%、VB10.005%、pH6.0。
MULTISKAN GO新一代全波长酶标仪Thermo,USA;JY96-IIN超声波细胞粉碎机宁波新芝生物科技股份有限公司;ZKU-L362-40 ℃超低温冷冻贮存箱中科生命科技股份有限公司;MDF-U53V-80 ℃超低温冰箱Sanyo,Jpan;V-5000多可必食品加工器青岛埠元电子有限公司。
1.2实验方法
1.2.1菌种培养方法斜面菌种活化:将灵芝菌种接种至斜面培养基上,放置28 ℃生化培养箱中培养(6~8 d)至斜面长满菌丝为止。
种子制备:250 mL三角瓶中装100 mL液体种子培养基,用接种铲刮取法接入经活化的斜面灵芝两试管,置28 ℃摇床中,摇床转速180 r/min,培养7 d,供实验作种子用。
菌种发酵:250 mL三角瓶中装100 mL发酵培养基,接种量为10%,摇床转速180 r/min,培养温度28 ℃,培养时间8 d。
1.2.2菌丝体分离将发酵结束后的发酵液进行抽滤,分离菌丝体和发酵液;其中,发酵液用比色法测定胞外β-葡萄糖苷酶酶活,菌丝体经无菌水多次洗涤后,进行β-葡萄糖苷酶的提取。
1.2.3菌丝体破碎处理方法
1.2.3.1匀浆处理向菌丝体中加入蒸馏水,在冰水浴中用“多可必”食品加工器以转速22000 r/min进行匀浆处理,为了防止持续长时间处理导致液体升温较高而引起酶活的损失,此方法采用每匀浆1 min间歇1 min的方式,匀浆次数设置为1、3、5、7次,得到粗酶液。
1.2.3.2升温自溶及与匀浆组合处理升温自溶:该方法不进行菌丝体与发酵液的分离,当菌种发酵结束时,将培养温度分别调到28、34、40、46 ℃继续培养2 d,发酵上清液即为粗酶液。
升温自溶+匀浆处理:上述升温自溶发酵结束样品,将菌丝和发酵液分离,发酵液直接测定胞外酶活,菌丝体用水稀释后,在冰水浴中用“多可必”食品加工器以转速22000 r/min匀浆处理5次。
1.2.3.3反复冻融及与匀浆组合处理反复冻融:向菌丝体中加入蒸馏水,分别置于-20、-40、-80 ℃下冷冻8 h,然后常温解冻1 h,反复三次,得粗酶液。
匀浆处理+反复冻融:向菌丝体中加入蒸馏水,在冰水浴中以转速22000 r/min进行匀浆处理1 min,再放置-20、-40和-80 ℃反复冻融三次处理。
1.2.3.4超声破碎及与匀浆组合处理超声破碎:向菌丝体中加入蒸馏水,在冰水浴中进行超声破碎,超声功率200 W,为了防止持续长时间超声导致液体升温较高而引起酶活的损失,采用每匀浆1 min间歇1 min的方式破碎,超声次数为1、5、10、15、20次,得粗酶液。
匀浆处理+超声破碎:向菌丝体中加入蒸馏水,在冰水浴中以转速22000 r/min进行匀浆处理1 min,再进行超声破碎处理,超声次数分别设置为1、5、8、10次,得粗酶液。
1.2.4酶活测定方法本实验采用比色法,以对硝基苯基-β-D-葡萄糖苷(pNPG)为底物进行酶解,底物水解后释放出来的对硝基苯酚在400~420 nm可见光范围内有特征吸收峰,可直接在400~420 nm之间比色测定[13]。
酶活定义:β-葡萄糖苷酶酶活力单位(U)定义为,在pH5.0、50 ℃反应条件下,一分钟时间内底物被水解释放出1 μmol的pNP所需要的酶量。

表1 匀浆处理对酶活的影响Table 1 The effect of homogenate on enzyme activity
注:同一行,上标字母不同表示在p<0.05水平时差异显著。
2 结果与讨论
2.1匀浆处理对β-葡萄糖苷酶提取的影响
表1列出了菌丝体经匀浆处理后β-葡萄糖苷酶总活力的变化情况。由表1可以看出,匀浆处理可以有效提取菌丝中的β-葡萄糖苷酶,随着匀浆次数的增多,酶活不断增加,当匀浆次数增加到5次时提取效果达到最佳,比直接提取增加了57.36%。
2.2升温自溶与匀浆组合处理对β-葡萄糖苷酶提取的影响
在灵芝发酵过程中,适当的升高发酵温度会使灵芝菌丝体发生自溶,导致胞内的某些产物释放。图1为采用升温的方式来促进胞内酶的释放以及升温后结合匀浆处理的提取结果对比。结果显示,单一靠升温来增加菌丝中β-葡萄糖苷酶的释放效果并不理想,当温度升为34 ℃发酵时,酶活仅比初始的1.468 U/mL增加了6.40%,温度控制在40 ℃以上时,酶活会明显的降低;发酵过程中温度升高的越多,生物量减少越明显,温度升高到46 ℃时生物量由28 ℃时的20.18 g/L降低到10.02 g/L,减少了50.35%。说明发酵过程升高温度,菌体会发生自溶,但胞内酶的释放并不显著,较高的温度不利于菌丝的生成,因此酶的形成也受到很大的阻碍。当升温发酵后与匀浆处理组合处理则表现出较显著的效果,灵芝在28 ℃发酵结束后将温度升至34 ℃再继续发酵2 d,结合匀浆处理酶活可达2.427 U/mL,比直接提取提高了65.33%,比上述单一匀浆处理的方法提高了5.06%。

图1 升温自溶及与匀浆组合处理结果对比Fig.1 Comparison of heating autolysis extraction and the combination with homogenate processing
2.3反复冻融与匀浆组合处理对β-葡萄糖苷酶提取的影响
采用反复冻融以及与匀浆组合处理的提取结果如图2所示,反复冻融可以有效提取菌丝体中β-葡萄糖苷酶,且匀浆和反复冻融组合处理的提取效果更加显著。当冷冻温度选择在-40 ℃时对酶的提取最有效,与匀浆组合提取后酶活可达3.003 U/mL,比直接提取提高了104.56%。
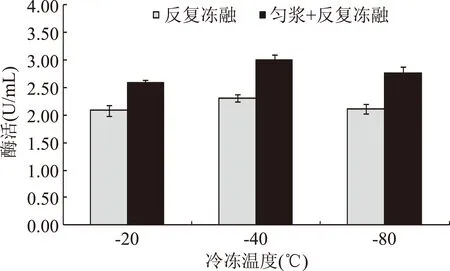
图2 反复冻融及与匀浆组合处理结果对比Fig.2 Comparison of repeated freezing-thawing and the combination with homogenate processing
2.4超声破碎与匀浆组合处理对β-葡萄糖苷酶提取的影响
超声破碎处理较其他几种方法都表现出更好的效果,当超声次数增加到10次时,酶活达到最高为3.094 U/mL,比直接提取提高了110.76%,超声次数继续增加,由于酶的敏感性,会有更多的酶活损失。对菌丝先匀浆处理1 min再进行超声破碎,与单独进行超声破碎处理的结果进行比较,结果见图3。当匀浆处理与超声破碎组合处理时,酶活明显高于单独进行超声破碎处理,且当匀浆与超声组合时,仅需超声5次就具有显著的效果,虽然与单独超声10次的酶活无显著差异,但节省了一半的处理时间。
由此得出灵芝菌丝体中β-葡萄糖苷酶的最佳提取方法是匀浆处理与超声破碎的组合,即先对菌丝以22000 r/min匀浆处理1 min,再进行超声破碎,超声功率200 W,每超声1 min间歇1 min,超声次数为5次,此时可得β-葡萄糖苷酶的总活力为3.116 U/mL,比直接提取提高了112.26%。
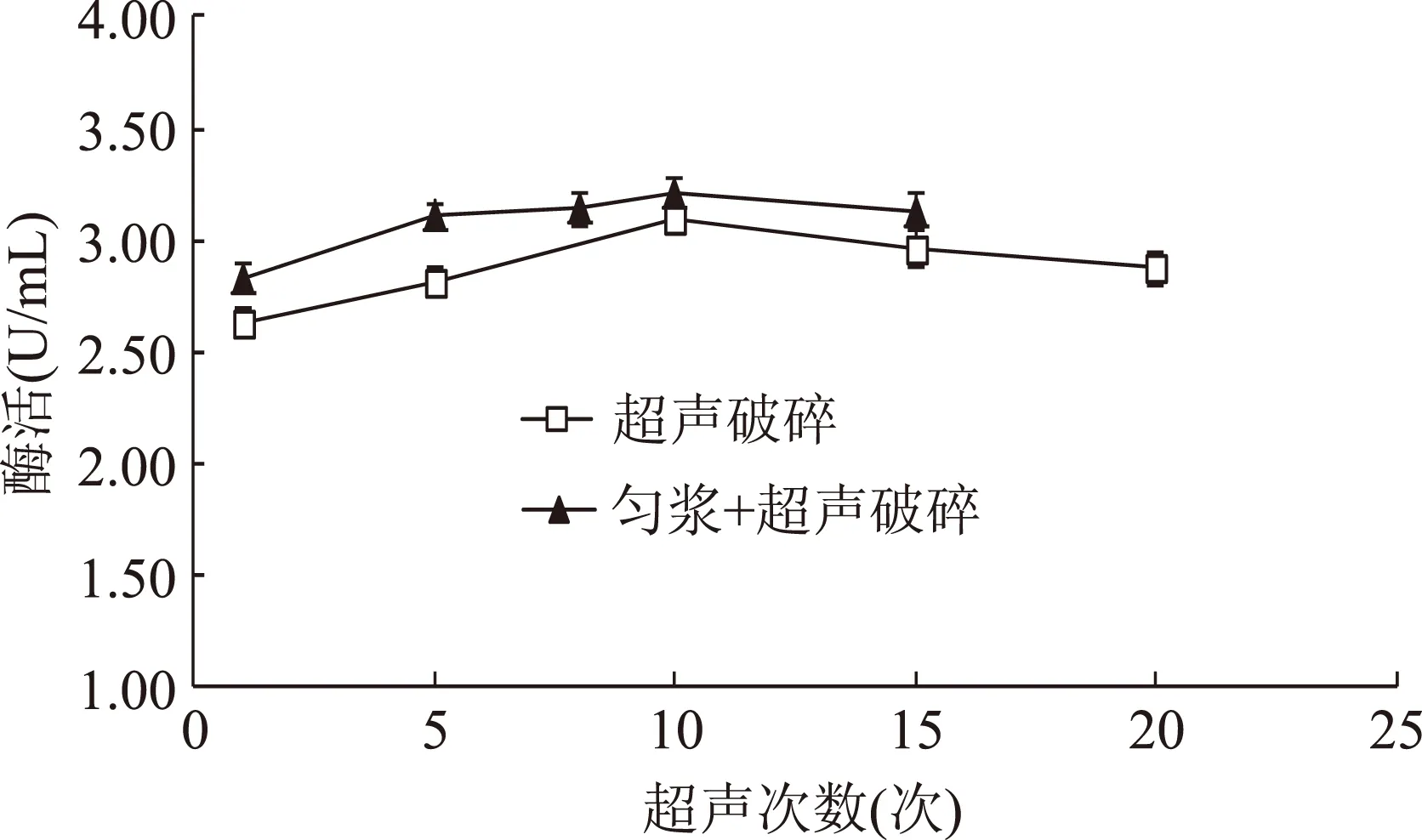
图3 超声破碎及与匀浆组合处理结果对比Fig.3 Comparison of ultrasonic crushing and the combination with homogenate processing
2.5不同方式处理后菌丝形态变化
对不同方式处理后菌丝的形态进行观察、比较,可以看出菌丝最初是成团分布的,大大小小的菌丝互相缠绕形成或大或小的菌丝球,如图4-a。匀浆处理可使菌丝团均匀分散并断裂;升温自溶实验菌丝的状态与处理前并无明显的区别,只是通过生物量的测定可以判断菌丝明显减少;经冻融处理后,肉眼所见菌丝状态已完全改变,呈蜂窝状,冷冻过程中由于水分由液态迅速变为冰晶形式而使菌体破裂,因此有利于酶的释放;超声处理可以更进一步破碎菌丝。
图4中b、c为菌丝在匀浆和超声破碎组合提取后通过普通光学显微镜观察到的形态。我们可以看到,匀浆处理可以将菌丝球全部打散,并将菌丝切割成段,而使菌丝分散开来,但菌丝并没有完全的破碎。因此本实验选择先通过简单的匀浆处理,分散并切割菌丝,再进行超声破碎,使菌丝断裂的更彻底,更进一步的破碎菌丝,提高酶的提取效果。不过考虑酶活的损失问题,不能无限量的增加超声破碎时间,因此依然还会有极少量的菌丝不能被彻底破碎掉。

图4 采用匀浆和超声破碎组合处理时菌丝的显微形态变化Fig.4 Microscopic morphological changes of mycelium in the combination of homogenate and ultrasonic crushing
3 结论
通过以上几种灵芝菌丝体破碎处理方法来提取β-葡萄糖苷酶的对比,得到最佳处理方法是先对菌丝匀浆1 min,然后进行超声破碎,超声功率200 W,以每超声1 min间歇1 min的方式超声5次,此时可得β-葡萄糖苷酶的总活力为3.116 U/mL。这种方法操作简单,酶活损失少。通过显微形态观察可知先对菌丝打浆处理,可将菌球打散、菌丝打断,再进行超声破碎,进一步的破碎菌丝,提高酶的释放。通过这种方法来提高酶的提取效率,不仅有助于食品工业上β-葡萄糖苷酶的分离纯化,提高其产量,更为灵芝发酵转化大豆异黄酮糖苷开发多因子保健食品提供了有利基础。由于酶的不稳定性,我们无法通过不断的增加超声时间和次数来达到所有菌丝完全彻底破碎的效果,因此,在以后的研究中有必要探寻出一种破碎效果更好,对酶活影响极小,而对酶的提取更加有效的方法。
[1]Tang Ya-Jie,Zhang Wei,Liu Rui-Sang,et al.Scale-up study on the fed-batch fermentation of Ganoderma lucidum for the hyperproduction of ganoderic acid and Ganoderma polysaccharides[J].Process Biochemistry,2011,46:404-408.
[2]Rosa′lia Rubel,Herta S.Dalla Santa,Luiz Cla′udio Fernandes,et al.Hypolipidemic and antioxidant properties of Ganoderma lucidum(Leyss:Fr)Karst used as a dietary supplement[J].World Journal of Microbiology Biotechnology,2011,27:1083-1089.
[3]Erkel E.Iclal.Yield performance of Ganoderma lucidum(Fr.)Karst cultivation on substrates containing different protein and carbohydrate sources[J].African Journal of Agricultural Research,2009,4(11):1331-1333.
[4]余伟,王宏勋,张晓昱.高产β-葡萄糖苷酶药用真菌菌株的筛选[J].食品科技,2008,(7):10-13.
[5]Zhang Jingying,Ge Yinan,Han Fenxia,et al.Isoflavone content of soybean cultivars from maturity group 0 to VI grown in northern and southern China[J].Journal of the American Oil Chemists Societs,2014,91:1019-1028.
[6]Jamie L.McCall,Rebekah A.Burich,Philip C.Mack.GCP,a genistein-rich compound,inhibits proliferation and induces apoptosis in lymphoma cell lines[J].Leukemia Research,2010,34:69-76.
[7]Yuan Lan,Chihiro Wagatsuma,Sun Bu-xiang,et al.The role ofβ-glucuronidase in induction of apoptosis by genistein combined polysaccharide(GCP)in xenogeneic mice bearing human mammary cancer cells[J].Annals New York Academy of Science,2003,1010:347-349.
[8]崔美林.高产三萜灵芝菌株液体发酵及生物转化大豆异黄酮的研究[D].杭州:浙江大学,2015:66-81.
[9]Cui Mei-lin,He Guo-qing.Enhanced production of mycelia biomass and bioactive metabolite of the American Ganoderma lucidum in submerged culture. IEEE Xplore.2012,5:252-255.
[10]Magdalena Klimek-Ochab,Magorzata Brzezińska-Rodak,Ewaymańczyk-Duda,et al.Comparative study of fungal cell disruption-scope and limitations of the methods[J].Folia Microbiol,2011,56:469-475.
[11]Sebastien Jubeau,Luc Marchal,Jeremy Pruvost,et al.High pressure disruption:a two-step treatment for selective extraction of intracellular components from the microalga Porphyridium cruentum[J].J Appl Phycol,2013,25:983-989.
[12]Vivek D.Farkade,Susan T.L.Harrison,Aniruddha B.Pandit.Improved cavitational cell disruption following pH pretreatment for the extraction ofβ-galactosidase from Kluveromyces lactis[J].Biochemical Engineering Journal,2006,31:25-30.
[13]马腾臻,杨学山,张莉,等.红佳酿酵母β-葡萄糖苷酶活性测定及产酶特性[J].食品与发酵工业,2014,10:37-40.
Comparison crushing methods ofGanodermalucidumMycelium
QIN Ke-xin1,SHI Yan-guo1,SUN Bing-qin2,CHEN Hao2,HE Guo-qing2,*
(1.Food Science and Engineering College,Harbin University of Commerce,Harbin 150076,China;2.College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China)
Ganodermalucidumis a precious medicinal fungi,which contains a variety of biological active substances,such asganodermalucidumpolysaccharide,triterpene compounds and has highβ-glucosidase activity.In order to improve the utilization efficiency of theβ-glucosidase,it is necessary to break theganodermalucidummycelium and release the enzyme to the full extent.Therefore,four methods of homogenate processing,heating autolysis extraction,repeated freezing-thawing,and ultrasonic crushing were used to extract theβ-glucosidase from theganodermalucidummycelia,and the extraction effect of different methods was compared.The results exhibited the best extraction method forβ-glucosidase extraction was the combination of homogenate processing and ultrasonic crushing.The mycelia form the fermented liquids needed to be treated by homogenate processing for 1 min in the ice bath,and then be treated 1 min intermittent 1 min for 5 times by ultrasonic crushing in 200 W.In this case,the total enzyme activity of theβ-glucosidase reached 3.116 U/mL,which increased by 112.26% than that of non-broken treatment.Through microscope it can be observed that the mycelium ball was dispersed completely,the hyphae were cut off in varying degrees by homogenate and almost all were broken by ultrasonication.
Ganodermalucidummycelia;β-glucosidase;extraction;homogenate;ultrasonic crushing
2015-10-16
秦可欣(1988-),女,硕士,研究方向:大豆加工技术,E-mail:460040223@qq.com。
何国庆(1957-),男,博士,教授,研究方向:食品生物技术及发酵工程,E-mail:gqhe@zju.edu.cn。
国家自然科学基金资助项目(31271816)。
TS201.3
A
1002-0306(2016)09-0146-04
10.13386/j.issn1002-0306.2016.09.020

