沉默GLUT-1表达对食管鳞癌细胞株TE-TE-1313增殖和迁移的影响△
陈涛 刘小兴 陈虞梅 施一平 万良荣 刘建军上海交通大学医学院附属仁济医院核医学科,放疗科,上海007
沉默GLUT-1表达对食管鳞癌细胞株TE-TE-1313增殖和迁移的影响△
陈涛1*#刘小兴2*陈虞梅1施一平1万良荣1刘建军1
上海交通大学医学院附属仁济医院1核医学科,2放疗科,上海200127
目的研究沉默葡萄糖转运蛋白-1(glucose transporter protein-1,GLUT-1)的表达对食管鳞癌TE-13细胞增殖、周期及迁移的影响及可能的作用机制。方法采用慢病毒转染的方法将特异性针对GLUT-1基因的GLUT-1-shRNA转入TE-13细胞,建立稳定干扰GLUT-1表达的TE-13细胞株,分成GLUT-1-shRNA组和阴性对照组进行对比研究。采用实时荧光定量PCR和蛋白质印迹法检测GLUT-1-shRNA对TE-13细胞GLUT-1 mRNA及其蛋白表达的影响。CCK-8法、FCM法和Transwell小室迁移实验分别检测沉默GLUT-1表达后对TE-13细胞增殖、细胞周期和迁移的影响;同时采用蛋白质印迹法检测细胞迁移以及乏氧相关蛋白的表达情况。结果采用慢病毒将GLUT-1-shRNA转入TE-13细胞后,可明显下调GLUT-1蛋白(t=6.713,P<0.01)和mRNA的表达水平(t= 4.181,P<0.05)。与阴性对照组相比,GLUT-1干扰后细胞的增殖至72 h(t=3.097,P<0.05)和96 h(t=3.497,P<0.05)明显被抑制,同时细胞的迁移能力可见下降,但是细胞周期至24 h未见影响;基质金属蛋白酶的MMP-9(t= 6.895,P<0.01)和缺氧诱导因子HIF-1α(t=13.74,P<0.001)的表达明显下调,但是MMP-2的表达没有变化(t= 2.582,P>0.05)。结论沉默GLUT-1的表达可抑制食管磷癌细胞株TE-13细胞的增殖和迁移,并明显下调细胞内MMP-9和HIF-1α蛋白的表达,为寻找靶向治疗食管癌新靶点提供了初步的实验基础。
食管鳞癌;GLUT-1;增殖;细胞周期;迁移
Oncol prog,2016,14(1)
食管癌是常见的消化系统的恶性肿瘤,其发病率在世界上排名恶性肿瘤的第七位[1]。中国是世0界上食管癌的高发地区,发病率位列恶性肿瘤的第四位[2]。食管癌恶性程度高、预后差,尽管随着手术方式以及放、化疗等治疗模式的不断改进,其远期生存率有所提高,但是经过几次大样本的调查之后发现,总的术后5年生存率仍旧为25%~40%[3-4]。近年来各种分子靶向治疗方法有效地控制了肿瘤的生长和扩散,在延长肿瘤患者生存期、降低患者病痛方面取得了一定的效果[5]。但是,关于食管癌的分子靶向治疗的研究甚少。因此,寻求新的食管癌分子靶向治疗方法迫在眉睫。
恶性肿瘤组织生长速度快,对能量的需求远大于正常组织,即使是在有氧状态下,恶性肿瘤细胞仍以活跃的葡萄糖酵解这一特征性生化代谢模式作为其能量的主要提供者[6]。然而,1分子葡萄糖经无氧糖酵解产生的三磷酸腺苷(ATP)仅为有氧三羧酸循环的1/18[7],因此,为了满足肿瘤细胞的这种代谢特征,需要摄取大量的葡萄糖[8-9]。大多数哺乳动物组织细胞摄取葡萄糖的过程都需要膜结合糖蛋白家族即易化葡萄糖转运载体家族(facilitates glucose transporters,GLUT)的参与[10]。
GLUT的功能是摄取和转运葡萄糖进入胞质,到达细胞葡萄糖代谢的主要场所——线粒体,它是关键的细胞能量代谢调节器[10]。目前发现GLUT家族共有14种亚型,其中GLUT-1在人类不同来源的恶性肿瘤中表达水平明显升高[11-12]。应用食管癌术后的组织病理免疫组化分析研究表明[13-14],肿瘤细胞膜表面GLUT-1过度表达与食管癌的生长、侵袭、转移及预后生物学行为密切相关。Kato等[15]通过正电子发射断层显像(PET)与术后病理比较发现,食管鳞癌氟化去氧葡萄糖(FDG)摄取程度与GLUT-1密切相关,且FDG高摄取及GLUT-1高表达的食管癌患者预后明显差于FDG低摄取及GLUT-1低表达者。因此,调低或抑制食管癌细胞膜表面GLUT-1蛋白的表达,是否能够降低或抑制食管癌细胞的生长增殖以及侵袭迁移成为我们关注的焦点。
本研究选择食管鳞癌细胞株TE-13作为恶性肿瘤研究对象,采用以慢病毒为载体介导的RNA干扰(RNAi)技术,通过控制肿瘤细胞内调节细胞膜表面GLUT-1蛋白合成的靶基因,抑制或调低肿瘤细胞膜表面GLUT-1蛋白的表达,进而观察RNA干扰GLUT-l蛋白表达对食管鳞癌细胞株TE-13的生长增殖、迁移以及相关蛋白如基质金属蛋白酶-9 (matrix metalloproteinase-9,MMP-9)、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)等表达的影响,寻找抑制食管鳞癌细胞生长和侵袭的新路径和方法。
1 材料与方法
1.1细胞、试剂及仪器
人食管鳞癌细胞株TE-13购自上海美轩生物科技有限公司。携带有针对GLUT-1基因的shRNA(GLUT-1-shRNA)和阴性对照(negative control,NC)的shRNA(NC-shRNA)的重组慢病毒载体购自上海吉玛制药技术有限公司。GLUT-1-shRNA序列为5´-GCATCAACGCTGTCTTCTATT-3´;NC-shRNA序列为5´-TTCTCCGAACGTGTCACGT-3´。达尔伯克必需基本培养基(Dulbecco’s modified Eagle’s medium,DMEM)和胎牛血清购自美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO)和CCK-8试剂盒购自日本株式会社同仁化学研究所;RNA抽提试剂TRIzol购自美国Invitrogen公司。兔抗人β-actin、HIF-1α、MMP-9和MMP-2单克隆抗体均购自美国Cell Signaling Technology公司;小鼠抗人GLUT-1多克隆抗体购自美国Proteintech公司;ECL试剂盒购自美国Millipore公司;反转录试剂盒购自美国Thermo公司;嘌呤霉素购自美国Sigma公司;细胞组织快速裂解液(RAPI裂解液)购自美国Thermo公司。聚合酶链反应(polymerase chainReaction,PCR)引物由生工生物工程(上海)股份有限公司设计并合成。其他试剂均为国产分析纯。PCR扩增仪为美国Applied Biosystems公司产品,酶标仪为美国Bio Tek公司产品;流式细胞仪为美国Becton-Dickinson公司产品;凝胶成像仪为美国Bio-Rad公司产品。
1.2实验方法
1.2.1细胞培养将食管鳞癌TE-13细胞接种于含10%胎牛血清、100 U/ml青霉素和100µg/ml链霉素的DMEM培养液中,置于37℃、CO2体积分数为5%的培养箱培养、传代。取对数生长期的细胞进行后续实验。
1.2.2病毒转染接种对数生长期的细胞,按5× 104/孔的密度接种于12孔板中,分别于接种后次日更换培养液并向各组细胞中分别加入病毒液进行转染,感染复数(multiplicity of infection)为20。实验分为2组:①GLUT-1-shRNA组,以携带有GLUT-1-shRNA的慢病毒转染TE-13细胞;②阴性对照组,以携带有NC-shRNA的慢病毒转染TE-13细胞。病毒转染24 h后更换培养液,72 h后加入嘌呤霉素(终质量浓度为2 μg/ml)筛选细胞。待细胞生长至融合度为80%,行常规传代培养。
1.3检测方法
1.3.1实时荧光定量PCR检测TE-13细胞中GLUT-1 mRNA的表达将稳定转染shRNA后的GLUT-1-shRNA组和阴性对照组TE-13细胞,按1× 105/孔的密度接种于6孔板,培养24 h后收集细胞,弃培养液,预冷的磷酸盐缓冲液(PBS)漂洗细胞2遍,加入Trizol提取总RNA,用紫外分光光度计测定波长比值为260 nm/280 nm的光密度(optical density,OD)值为1.8~2.0,检测总RNA的浓度和纯度。采用反转录试剂盒将提取获得的总RNA反转录合成cDNA,取转录获得的cDNA 1 mg进行实时荧光定量PCR反应。GLUT-1基因上游引物序列为5´-TGTGGATTGAGGGTAGGAGGT-3´,下游引物序列为5´-TGAGCAAGAGGACACTGATGA-3´,内参照GAPDH上 游 引 物 序 列 为 5´-ATGACATCAAGAAGGTGGTG-3´,下游引物序列为5´-CATACCAGGAAATGAGCTTG-3´,每组样品均设3个重复孔。PCR反应条件如下:第一步,95℃预变性30 s;第二步,95℃5 s、60℃30 s,共40个循环。以每个反应管内的荧光信号到达设定域值时所经历的循环数为Ct值,用2-δδCt法计算目的基因的mRNA相对表达水平。实验重复3次。
1.3.2蛋白质印迹法检测细胞中GGLLUUTT-- 11、MMMMPP-- 22、MMMMPP-- 99和HHIIFF-- 11 α蛋白的表达将稳定转染shRNA后的GLUT-1-shRNA组和阴性对照组TE-13细胞,按1×105/孔的密度接种于6孔板,培养24 h后收集细胞,预冷的PBS漂洗细胞2遍,用RAPI提取细胞蛋白,取裂解好的蛋白样品上样,进行10%SDSPAGE电泳,经湿转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),丽春红染色观察各电泳带的蛋白表达量。以5%脱脂奶粉室温封闭1.5 h,分别加入小鼠抗人GLUT-1多克隆抗体和兔抗人MMP-2、MMP-9、HIF-1α单克隆抗体(稀释比例均为1∶1000)以及内参照β-actin单克隆抗体(稀释比例为1∶1000),4℃孵育过夜,TBST漂洗4次,每次10 min,再加入二抗(辣根过氧化物酶标记的山羊抗鼠IgG或山羊抗兔IgG,均按1∶3000稀释),室温孵育1 h,TBST漂洗6次,每次10 min,最后以化学发光液显色,凝胶成像仪显像。使用Image J软件进行图像分析,以目的蛋白条带的灰度值与内参照βactin蛋白条带灰度值的比值表示目的蛋白的相对表达水平。实验均重复3次。
1.3.3CCK- 8检测细胞增殖取对数生长期的GLUT-1-shRNA组和阴性对照组细胞,以3000/孔接种于96孔板。待细胞贴壁后,分别在24、48、72 和96 h时间点,每孔加入CCK-8 10 μl继续培养1 h,在酶标仪450 nm波长下检测各孔OD值,以此反映细胞增殖能力。每组设3个复孔。实验重复3次。
1.3.4FCM法检测细胞周期将稳定转染shRNA后的GLUT-1-shRNA组和阴性对照组TE-13细胞制备单细胞悬液,分别于12、24 h收集细胞,用预冷的70%的乙醇溶液于-20℃固定细胞3 h,离心收集细胞,PBS漂洗1次,加入500µl含50µg/ml碘化丙啶及100µg/mlRNase A的PBS,4℃避光染色30 min,流式细胞仪上机检测。实验重复3次。
1.3.5Transwell迁移实验检测细胞迁移能力收集GLUT-1-shRNA组和阴性对照组对数期细胞,用无血清的DMEM培养液重悬后按6×104/孔的密度将细胞悬液加入Transwell小室的上室,下室加入1ml含10%FBS的高糖DMEM培养液。培养72 h后取出小室,PBS漂洗2次,4%的多聚甲醛溶液固定15 min,用棉签擦去上层细胞,加入0.1%结晶紫染色液染色15 min。自来水冲洗3次,显微镜拍照。实验重复3次。
1.4统计学方法
采用Graphpad Prism 5软件对所有的实验数-据进行统计学分析,计量资料以均数±标准差()表示,两组间的比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1shRNA慢病毒转染后TE-13细胞GLUT-1表达明显降低
实时荧光定量PCR检测结果显示,稳定转染GLUT-1-shRNA的TE-13细胞中GLUT-1 mRNA的表达水平较阴性对照组明显下调(t=4.181,P<0.05;图1A)。
蛋白质印迹法检测结果显示,稳定转染GLUT-1-shRNA的TE-13细胞中GLUT-1蛋白表达水平明显低于阴性对照组(t=6.713,P<0.01;图1B)。
2.2沉默GLUT- 1表达对食管鳞癌细胞TE-13增殖的影响
24、48、72、96h时CCK-8法检测结果显示,与阴性对照组细胞相比,稳定转染GLUT-1-shRNA的TE-13细胞在24、48 h的增殖水平未见明显变化,但是在72、96 h时GLUT-1-shRNA组细胞的增殖水平表现为明显抑制(t=3.097,P<0.05;t=3.497,P< 0.05)。(图2)
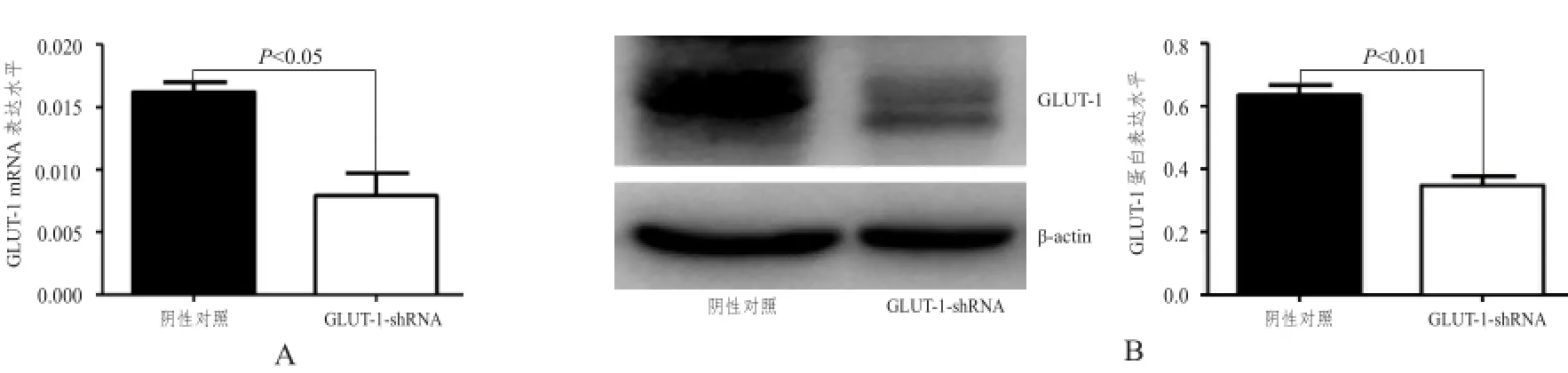
图1 shRNA慢病毒转染后TE-TE-1313细胞GLUT-GLUT-1 1表达
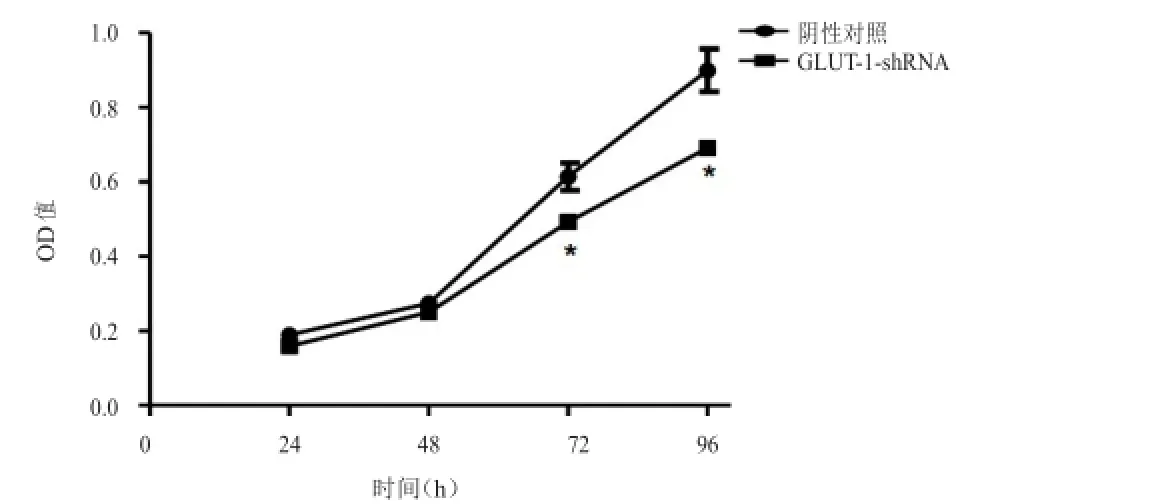
图2 CCK-8法检测阴性对照组与GLUT-1-shRNA组TE-13细胞增殖的比较
2.3沉默GLUT-1表达对食管鳞癌TE-13细胞周期分布的影响
FCM法检测结果显示,沉默GLUT-1的表达对食管鳞癌细胞TE-13细胞周期在12、24 h时均无影响。(图3)
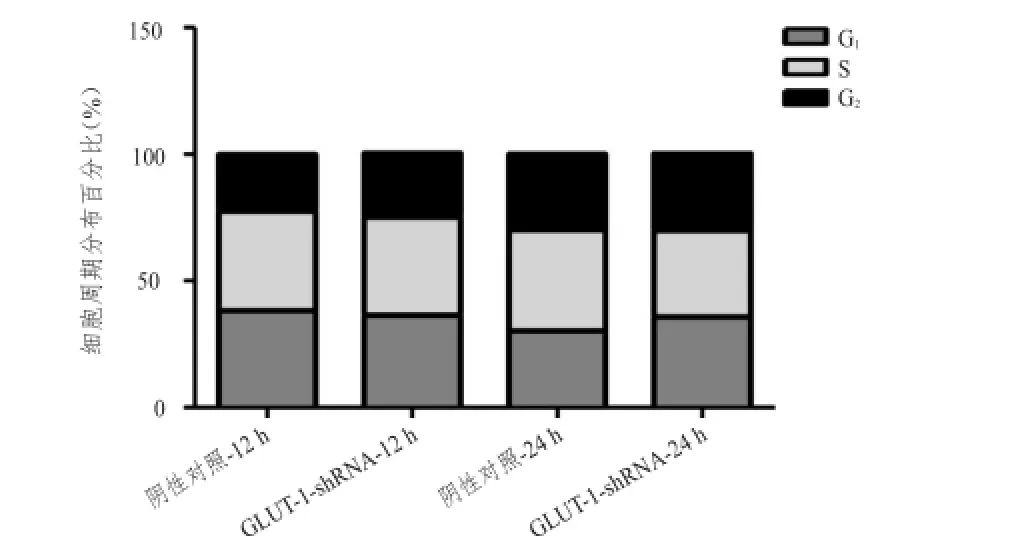
图3 FCM检测阴性对照组与GLUT-1-shRNA组TE-1313细胞周期的比较
2.4沉默GLUT- 1表达对食管鳞癌TTEE--1133细胞迁移能力的影响
Transwell小室迁移实验检测结果显示(图4),直观评价见GLUT-1-shRNA组细胞较阴性对照组穿过小室膜的细胞数减少。
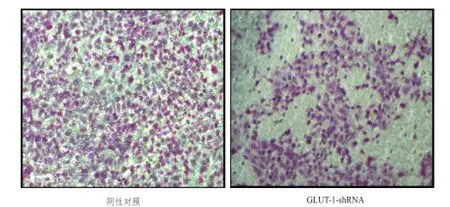
图4 4 Transwellswell法检测阴性对照组与GLUT-1-shRNAshRNA组TE-13细胞迁移的比较(×100100)
2.5沉默GLUT- 1表达对食管鳞癌TE-13细胞中MMP- 2、MMP- 9和HIF-1α蛋白表达的影响
蛋白质印迹法检测结果见图5。与阴性对照组相比,沉默GLUT-1表达后对TE-13细胞中MMP-2蛋白的表达无影响(t=2.582,P>0.05),而MMP-9和HIF-1α蛋白的表达水平则均被明显下调(t=6.895,P<0.01;t=13.74,P<0.001),详见图6。
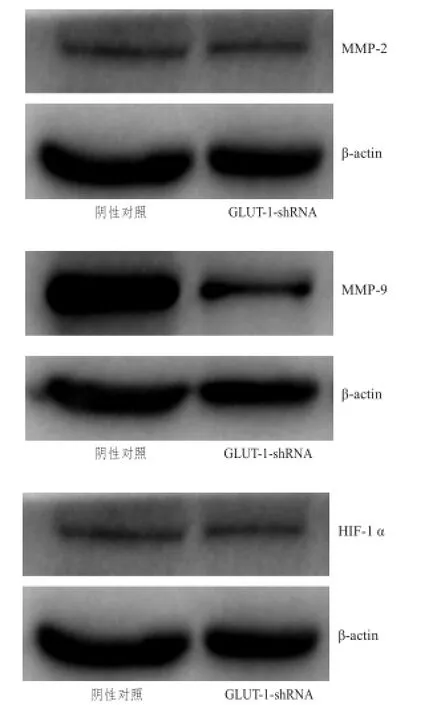
图 5 阴性对照组与GLUT- 1-shRNA组TE-13细胞MMP-2、MMP- 9和HIF-1α表达的蛋白质印迹法检测结果
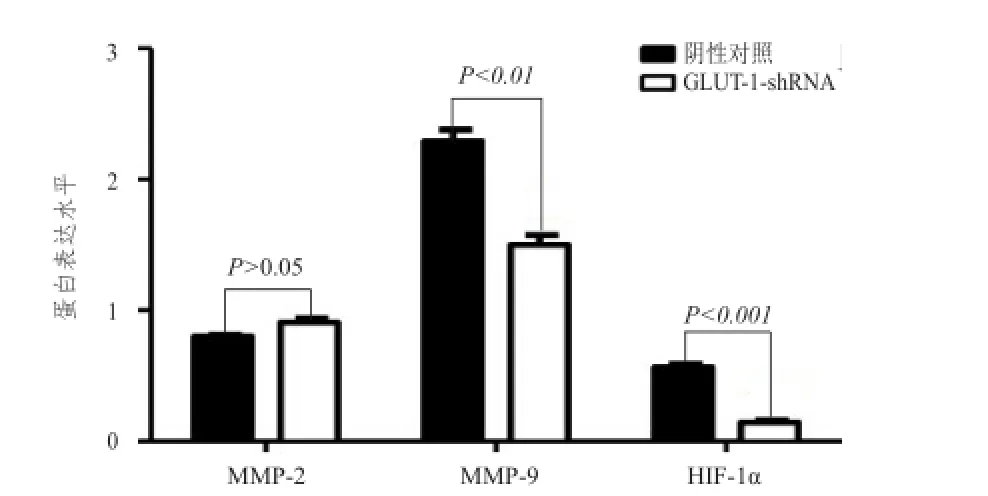
图6 蛋白质印迹法检测阴性对照组与GLUT-1-shRNA组TE-13细胞MMP-2、MMP-9和HIF-1α 表达的比较
3 讨论
GLUT是分布在哺乳动物细胞膜上的一类跨膜糖蛋白,几乎存在所有的组织中,其主要功能是转运葡萄糖跨过细胞膜进入细胞内,为细胞能量代谢提供基本的葡萄糖供应[10]。恶性肿瘤组织为了满足其无序、快速增殖以及无氧糖酵解为主要能量代谢途径的要求,通常在大多数肿瘤细胞表面呈现GLUT-1蛋白的异常高表达,来增加葡萄糖的摄取,并与肿瘤的恶性进展程度和侵袭转移表现密切相关[6,11-12]。本研究利用慢病毒包装质粒转染食管鳞癌细胞TE-13,干扰其GLUT-1的表达,稳定转染GLUT-1-shRNA慢病毒后的TE-13细胞的GLUT-1蛋白和mRNA表达水平明显下降,表明本研究成功地建立了GLUT-1蛋白稳定低表达的食管癌细胞株。后续的细胞增殖实验显示:相比阴性对照组,GLUT-1干扰后TE-13细胞的增殖在72、96 h表现为明显的抑制,考虑是由于TE-13细胞膜表面GLUT-1蛋白表达降低后,减少了葡萄糖通过GLUT-1进入细胞内的数量,降低了细胞的能量供给,即糖酵解的速率;同时,由于糖酵解速率的降低,致使糖酵解过程中产生的6-磷酸葡萄糖、丙酮酸数量减少,从而导致肿瘤细胞快速增殖所需的脂肪酸、核苷酸等合成降低,最终抑制了食管癌细胞的增殖[6]。这个结果有力地证实了选择调低或抑制食管癌细胞GLUT-1蛋白的表达,将会有效抑制食管癌细胞的增殖。但是检测的细胞周期结果显示,沉默GLUT-1表达后TE-13的细胞周期在12、24 h未见明显变化,这与增殖实验中TE-13细胞在48 h内未见明显增殖表现相吻合,可能由TE-13细胞的生长增殖特性所决定。
已知肿瘤的侵袭和转移是一个多因素参与,多阶段、多步骤完成的复杂过程[16]。其中糖酵解过程生成的乳酸转移至细胞外可造成肿瘤组织微环境酸化,从而为肿瘤细胞侵袭和转移做好了环境准备。同时,肿瘤细胞或周围间质细胞分泌的基质金属蛋白酶(matrix metalloproteinase,MMP)可以通过降解细胞外基质、调节细胞间黏附及促进新生血管形成来促进恶性肿瘤的侵袭和转移,其中MMP-2、MMP-9是金属蛋白酶家族中与肿瘤浸润转移关系最为密切的因子。对人体不同部位和组织所进行的研究显示,MMP表达类型和组织类型之间存在着特定的紧密联系。温洪涛等[17]采用免疫组织化学和Westem blot法检测了41例食管鳞癌组织及相应正常食管组织中MMP-2、MMP-9的表达发现:食管鳞癌组织中MMP-9的阳性表达率明显高于正常组织,且与淋巴结转移及静脉侵袭显著相关;而食管鳞癌组织中MMP-2的阳性表达率与蛋白相对表达量均明显低于MMP-9,且与肿瘤淋巴结转移及静脉侵犯无关。而Liao等[18]的研究发现,抑制肺腺癌细胞A549的GLUT-1蛋白表达,通过GLUT-1/MT1-MMP/MMP-2通路降低MMP-2的表达,从而达到降低肿瘤侵袭转移的目的。虽然目前尚未见有关食管鳞癌GLUT-1/MT1-MMP/ MMP通路的研究报道,但是我们的实验发现:沉默GLUT-1表达后,食管鳞癌TE-13细胞的MMP-9蛋白表达明显降低,而MMP-2蛋白的表达未见明显的变化,提示我们在食管鳞癌细胞应该存在着GLUT-1/MT1-MMP/MMP-9的调控通路,可能在调控食管鳞癌肿瘤侵袭转移上起着重要的作用,这有待于进一步的研究加以证实。同时进行的肿瘤细胞迁移实验表明,沉默GLUT-1表达,使TE-13细胞的迁移能力降低,提示沉默GLUT-1表达后TE-13细胞迁移一定程度被抑制。研究表明,肿瘤细胞的迁移和对周围组织、血管的侵袭是肿瘤细胞转移的关键步骤,其发生与进展需要与细胞增殖、分化、移动的相关基因及其表达调控模式的改变和促进细胞移动的外界因素二者的共同作用[19]。武宁等[20]的研究发现,较高浓度的二甲双胍能够促进肺腺癌A549细胞迁移,并与其促进肿瘤细胞MMP-9蛋白高表达密切相关。因此,我们考虑沉默GLUT-1表达,导致细胞迁移降低可能是由于GLUT-1蛋白表达下调导致肿瘤细胞葡萄糖摄取减少,细胞能量供给及增殖减低以及肿瘤细胞MMP-9表达降低等多因素所致。这些结果提示我们如果以GLUT-1蛋白作为治疗靶点,有可能通过抑制食管癌细胞增殖和MMP-9的表达,降低甚至阻止食管癌细胞降解细胞外基质、调节细胞间黏附的能力,从而降低食管癌的侵袭能力,预防或减少食管癌的转移或复发。
恶性肿瘤细胞常处于失控性生长及高代谢状态,故缺氧是实体肿瘤微环境特征之一,与肿瘤的发展、浸润、转移等恶性生物学行为密切相关[21]。葡萄糖酵解不仅适合于肿瘤组织广泛存在的低氧环境,而且缺氧时缺氧诱导因子HIF-1α和GLUT-1的过度表达将促进糖代谢增加满足肿瘤生长能量代谢的需要。HIF-1α是介导细胞对缺氧微环境进行适应性反应的关键性转录调控因子,能激活许多缺氧反应性蛋白的表达,使组织产生一系列适应反应而得以在缺氧状态下生存[22]。一般情况下,肿瘤组织因缺氧导致HIF-1α表达增加,过度表达的HIF-1α通过与不同缺氧反应蛋白如血管内皮生长因子和GLUT-1等启动子和增强子上的HIF-1结合位点结合,提高这些蛋白的表达,从而促进肿瘤新生血管的生成,维持癌细胞的能量代谢,为癌细胞的进一步生长和转移提供物质基础[23]。本研究发现,调低食管鳞癌TE-13细胞GLUT-1蛋白的表达,其HIF-1α的表达亦呈现明显的降低。虽然这一结果的机制尚不清楚,有待进一步的研究加以说明。考虑可能是由于GLUT-1蛋白表达降低,使得肿瘤细胞代谢、增殖能力下降,导致其乏氧程度得到改善,进而引起HIF-1α蛋白表达降低;或者因沉默GLUT-1表达,导致与HIF-1α相结合的GLUT-1靶点减少所致。
本研究通过慢病毒为载体介导的RNAi技术获得了能够稳定转染干扰食管鳞癌TE-13细胞GLUT-1蛋白表达的sh-RNA;通过对沉默GLUT-1表达后TE-13细胞在细胞增殖、细胞周期、迁移以及相关蛋白表达水平的观察,提示我们通过调低或抑制食管鳞癌细胞膜GLUT-1蛋白的表达水平,能够明显抑制肿瘤细胞的增殖、迁移,并调低与肿瘤侵袭转移相关的MMP-9蛋白的表达,在一定程度上为寻求以调低GLUT-1蛋白表达为治疗肿瘤靶点建立了初步的实验基础。
[1]SiegelRL,Miller KD,Jemal A.Cancer statistics,2015[J].CACancer J Clin,2015,65(1):5-29.
[2]Cui XB,Shen YY,Jin TT,et al.SLC39A6:a potential target for diagnosis and therapy of esophageal carcinoma[J].J Transl Med,2015(13):321.
[3]Wang W,Liu L,Wang Z,et al.Impact of ABO blood group on the prognosis of patients undergoing surgery for esophageal cancer[J].BMC Surg,2015(15):106.
[4]Pan W,Sun Z,Xiang Y,et al.The correlation between high body mass index and survival in patients with esophageal cancer after curative esophagectomy:evidence fromRetrospective studies[J].Asia Pac J Clin Nutr,2015,24(3):480-488.
[5]Xu WW,Li B,Lam AK,et al.Targeting VEGFR1-and VEGFR2-expressing non-tumor cells is essential for esophageal cancer therapy[J].Oncotarget,2015,6(3):1790-1805.
[6]Miles KA,WilliamsRE.WarburgRevisited:imaging tumor blood flow and metabolism[J].Cancer Imaging,2008(8): 81-86.
[7]Shim BY,Jung JH,Lee KM,et al.Glucose transporter 1 (GLUT1)of anaerobic glycolysis as predictive and prognostic values in neoadjuvant chemoradiotherapy and laparoscopic surgery for locally advancedRectal cancer[J].Int J Colorectal Dis,2013,28(3):375-383.
[8]Zhang C,Liu J,Liang Y,et al.Tumour-associated mutant p53 drives the Warburg effect[J].Nat Commun,2013(4): 2935.
[9]Vasconcelos MG,VasconcelosRG,Pereira de Oliveira DH, et al.Distribution of Hypoxia-Inducible Factor-1α and Glucose Transporter-1 in Human Tongue Cancers[J].J Oral Maxillofac Surg,2015,73(9):1753-1760.
[10]Wood IS,Trayhurn P.Glucose transporters(GLUT and SGLT):expanded families of sugar transport proteins[J].Br J Nutr,2003,89(1):3-9.
[11]Chiba I,Ogawa K,Morioka T,et al.Clinical significance of GLUT-1 expression in patients with esophageal cancer treated with concurrent chemoradiotherapy[J].Oncol Lett, 2011,2(1):21-28.
[12]Ito H,Duxbury M,Zinner MJ,et al.Glucose transporter-1 gene expression is associated with pancreatic cancer invasiveness and MMP-2 activity[J].Surgery,2004,136(3): 548-556.
[13]Kato H,Takita J,Miyazaki T,et al.Glut-1 glucose transporter expression in esophageal squamous cell carcinoma is associated with tumor aggressiveness[J].AnticancerRes,2002,22(5):2635-2639.
[14]Ogane N,Yasuda M,Shimizu M,et al.Clinicopathological implications of expressions of hypoxia-related molecules in esophageal superficial squamous cell carcinoma [J].Ann Diagn Pathol,2010,14(1):23-29.
[15]Kato H,Takita J,Miyazaki T,et al.Correlation of 18-F-fluorodeoxyglucose(FDG)accumulation with glucose transporter(Glut-1)expression in esophageal squamous cell carcinoma[J].AnticancerRes,2003,23(4):3263-3272.
[16]CairnsRA,KhokhaR,HillRP.Molecular mechanisms of tumor invasion and metastasis:an integrated view[J].Curr Mol Med,2003,3(7):659-671.
[17]温洪涛,张蕾,李继昌,等.人食管鳞癌组织中MMP-2、MMP-9和TIMP-1、TIMP-2的表达[J].郑州大学学报(医学版),2006,41(3):418-420.
[18]Liao H,Wang Z,Deng Z,et al.Curcumin inhibits lung cancer invasion and metastasis by attenuating GLUT1/ MT1-MMP/MMP2 pathway[J].Int J Clin Exp Med,2015, 8(6):8948-8957.
[19]Sahai E.Mechanisms of cancer cell invasion[J].Curr Opin Genet Dev,2005,15(1):87-96.
[20]武宁,顾红军,李强.二甲双胍对肺腺癌A549细胞迁移及侵袭活性的影响[J].中国癌症杂志,2009,19(3):179-182.
[21]Lee SL,Rouhi P,Dahl Jensen L,et al.Hypoxia-induced pathological angiogenesis mediates tumor cell dissemination,invasion,and metastasis in a zebrafish tumor model [J].Proc Natl Acad Sci U S A,2009,106(46):19485-19490.
[22]Sadlecki P,Bodnar M,Grabiec M,et al.TheRole of Hypoxia-inducible factor-1α,glucose transporter-1,(GLUT-1)and carbon anhydraseⅨin endometrial cancer patients [J].BiomedRes Int,2014(2014):616850.
[23]Fang Y,Yu S,Ma Y,et al.Association of DII4/notch and HIF-1a-VEGF signaling in the angiogenesis of missed abortion[J].PLoS One,2013,8(8):e70667.
The effects of GLUT-1 knockdown on proliferation and migration of esophageal squamous cell carcinoma cell line TE-13△
CHEN Tao1*#LIU Xiao-xing2*CHEN Yu-mei1SHI Yi-ping1WAN Liang-rong1LIU Jian-jun11
Department of Nuclear Medicine,2Department ofRadiation Oncology,Renji Hospital,School of Medicine,Shanghai Jiao Tong University, Shanghai 200127,China.
ObjectivectiveTo investigate the effects of glucose transporter protein-1(GLUT-1)knockdown on cell proliferation,cycle and migration of the esophageal squamous carcinoma cell line TE-13,and to study the background mechanism.MethodethodCell line TE-13 were transfected with a lentiviral vector carrying the GLUT-1-shRNA which is specific to GLUT-1 gene,then the stably interfered GLUT-1 expression cells were selected and all cells were divided into 2 groups: GLUT-1-shRNA group and negative control group.Real-time PCR and western blot analysis were used to determine the mRNA and protein levels of GLUT-1 in negative control and GLUT-1-shRNA transfected TE-13 cells.The cell proliferation,cell cycle and migration were analyzed by CCK-8 assay,flow cytometry,transwell analysis,respectively.Furthermore,the levels of proteins that were involved in migration or hypoxia were analyzed by western blot.ResultesultLentivirus mediated shRNA knockdown of GLUT-1 significantly downregulated the mRNA level(t=4.181,P<0.05)and protein level(t=6.713,P<0.01)of GLUT-1.Compared with negative control,the proliferation(72 h:t=3.097,P<0.05;96 h:t=3.497, P<0.05)of migration of TE-13 cells was significantly inhibited by GLUT-1 shRNA knockdown.However,the cell cycle showed no significant changes in 24 h after transfection.Moreover,the expression of MMP-9(t=6.895,P<0.01)and HIF-1α(t=13.74,P<0.001)were significantly downregulated by GLUT-1 shRNA knockdown,while the expression of MMP-2 (t=2.582,P>0.05)remained unchanged before and after GLUT-1 knockdown.ConclusionusionGLUT-1 knockdown by shRNA significantly inhibits the proliferation and migration of TE-13 cells.And the levels of MMP-9 and HIF-1α are significantly downregulated by GLUT-1 knockdown,which provides preliminary theoretical basis in searching for targeted therapy for esophageal carcinoma.
ds:Esophageal squamous cell carcinoma;GLUT-1;proliferation;cell cycle;migration
R735.1
A
10.11877/j.issn.1672-1535.2016.14.01.15
上海市科学技术委员会基金(12ZR1418100)
*两位作者对本文的贡献等同
(corresponding author),邮箱:drchen1207@sina.cn
2015-11-17)

