肺癌脑膜转移患者的临床特征及预后因素分析
李宁 于雷 杨渤彦中国医学科学院肿瘤医院综合科,北京121
肺癌脑膜转移患者的临床特征及预后因素分析
李宁于雷杨渤彦#
中国医学科学院肿瘤医院综合科,北京1000210
目的探讨肺癌脑膜转移癌(leptomeningeal metastases,LM)患者的临床特点和治疗方法。方法回顾性分析71例肺癌脑膜转移患者的临床特征和随访资料,采用Kaplan-Meier法绘制生存曲线,并分析影响LM患者预后的因素。结果71例LM患者的中位生存时间为150 d,1年生存率为22.5%(16/71)。单因素分析显示,KPS评分、原发性肿瘤控制情况、治疗情况、近期疗效及直接死亡原因与LM患者的生存时间有关(均P<0.05)。多因素分析显示,近期疗效及直接死亡原因是影响LM患者预后的独立因素(均P<0.05)。结论近期疗效及直接死亡原因影响肺癌脑膜转移患者的预后生存。应用全身治疗联合局部治疗有助于延长肺癌脑膜转移患者的生存时间,改善预后。
肺癌;脑膜转移;预后因素
Oncol Prog,2016,14(1)
脑膜转移癌又称癌性脑膜炎(neoplastic meningitis,NM),是指癌细胞在软脑膜和蛛网膜多发种植、弥漫性浸润生长而导致的一类疾病。当癌细胞来源于实体瘤时,又称为软脑膜癌病,是晚期恶性肿瘤严重的神经系统并发症。有研究报道,肺癌中LM发生率为5%~10%,病死率高,且目前尚缺乏有效的治疗方法。随着近年来肺癌发病率上升,诊疗技术不断发展,使患者生存期延长,但是LM的发生和诊断率也逐年提高,其临床特征及诊治也逐渐受到重视,但是以往的相关研究报道尚缺乏临床治疗的研究数据。为了更深入地了解LM的临床特征及预后,探讨治疗策略的利弊优劣,本文回顾性分析了71例肺癌脑膜转移患者的临床资料,分析影响患者生存的预后因素。
1 资料与方法
1.1一般资料
收集自2002年12月至2014年2月在中国医学科学院肿瘤医院治疗、临床资料完整的肺癌脑膜转移患者71例,所有患者均有原发性肿瘤的组织病理学诊断、影像学或脑脊液细胞学检查的确诊结果。随访至2014年7月30日,随访率为100%。
1.2研究方法
①诊断依据:患者的临床症状、增强CT或MRI表现和脑脊液细胞学检查。②临床资料:患者性别、年龄、体能状况评分(KPS评分)、发生LM的时间(从原发病确诊至诊断LM的时间)、是否合并脑转移或其他器官转移、原发性肿瘤的控制情况、LM的治疗方法和疗效。③治疗方法:全身治疗(全身化疗和/或靶向治疗)、局部治疗(全脑放疗和/或鞘内化疗)、对症支持治疗。④疗效评价:具有所列情况之一即可判定。缓解/稳定:临床症状减轻或未加重;增强CT或MRI检查病灶减少或未增多;原发病灶或其他病灶缩小或未增大。病情进展:临床症状加重;增强CT或MRI提示病灶增多;原发病灶或其他病灶增大;出现新发病灶。⑤生存分析:生存时间定义为患者从确诊脑膜转移至死亡或末次随访的时间。
1.3统计学方法
应用SPSS19.0软件进行统计分析,采用Kaplan-Meier法评估各组生存率并绘制生存曲线,Cox多因素回归模型进行预后分析,不同治疗方式间的有效率采用χ2检验,检验水平α=0.05。
2 结果
2.1患者临床特征
71例患者中,男34例,女37例;年龄27~78岁,中位年龄54岁。非小细胞肺癌61例(85.9%),其中腺癌55例(77.5%),鳞癌3例(4.2%),腺鳞癌3例(4.2%),小细胞癌5例(7.0%),病理或组织细胞学未分型5例(7.0%)。从肺癌诊断至发生LM中位时间为360 d。临床表现为头痛、恶心呕吐、头晕等颅内高压症状者44例(62.0%);表现为眼睑下垂、复视、吞咽困难、视力下降等颅神经受损症状者4例(5.6%);表现为四肢麻木和肢体肌力下降等脊神经受损症状者2例(2.8%);其他症状,表现为癫痫抽搐等3例(4.2%),意识障碍3例(4.2%),思维障碍1例(1.4%);还有1例(1.4%)患者无临床症状,复查时发现LM。其他资料见表1。

表1 71例LM患者的预后单因素分析
2.2检查方法
2.2.1影像学检查71例LM患者中,经影像学确诊64例(90.1%),其中MRI诊断62例,CT诊断2例,经脑脊液细胞学确诊7例。影像学表现为:软脑膜和蛛网膜下腔灶性、结节性强化13例(20.3%,13/64),多灶性或弥漫性异常强化51例(79.7%,51/ 64)。71例脑膜转移患者中,脑转移50例(70.4%),其中同时发现伴有脑转移18例(25.4%),同时伴有其他器官转移18例(25.4%)。
2.2.2脑脊液检查71例LM患者中,17例(23.9%)患者治疗前行脑脊液检查。17例行脑脊液检查的患者中,有7例患者蛋白升高、葡萄糖降低,脑脊液细胞学检查发现癌细胞;有9例患者蛋白升高、葡萄糖降低,脑脊液细胞学检查未发现癌细胞;有1例患者脑脊液细胞学及生化检查均正常。
2.2.3其他检查EGFR检测发生基因突变者15例(15/58)。
2.3治疗
根据患者具体情况选择全身化疗、靶向治疗、全脑放疗、鞘内化疗、对症支持治疗。33例患者接受全脑放疗,采用6MV-X线直线加速器外照射;49例患者行系统治疗(化疗或靶向治疗),共治疗1~10个周期;鞘内化疗13例,应用甲氨蝶呤或阿糖胞苷鞘内注射,每周1次,注射1~19次;1例患者因严重高颅压症状行脑室腹腔分流术;4例接受对症支持治疗。治疗后1个月进行疗效评价,根据临床症状、影像学及脑脊液检查结果进行评价,获得疾病缓解和稳定者46例,疾病进展者25例。
2.4生存情况
在随访期内,有63例患者死亡,8例生存,无失访病例,总生存时间为15~2400 d,中位生存期为150 d,1年生存率为22.5%。(图1)
2.5预后因素分析
单因素分析显示(表1),KPS评分≥70、原发性肿瘤情况稳定者生存期相对较长,P﹤0.05;是否合并有脑实质转移或其他器官转移对LM的生存期无显著影响。患者因脑膜转移癌病灶进展较其他器官病灶进展致死者生存期显著缩短,脑膜病灶进展致死者中位生存期仅60 d。治疗方式与生存预后有关,单纯全身治疗(包括系统化疗、靶向治疗及替莫唑胺)较单纯局部治疗(包括鞘内注射及放疗)中位生存期延长30 d,但无统计学差异,二者联合(全身治疗和局部治疗)则显示,中位生存时间达8个月,较单纯全身药物治疗者延长了5个月(P=0.012),较单纯局部治疗者延长了6个月(P= 0),较单纯支持治疗者延长了7个月(P=0.007)。单纯全身治疗、局部治疗、支持治疗三者比较,采用全身治疗者中位生存期较长,但无统计学差异,见表2。
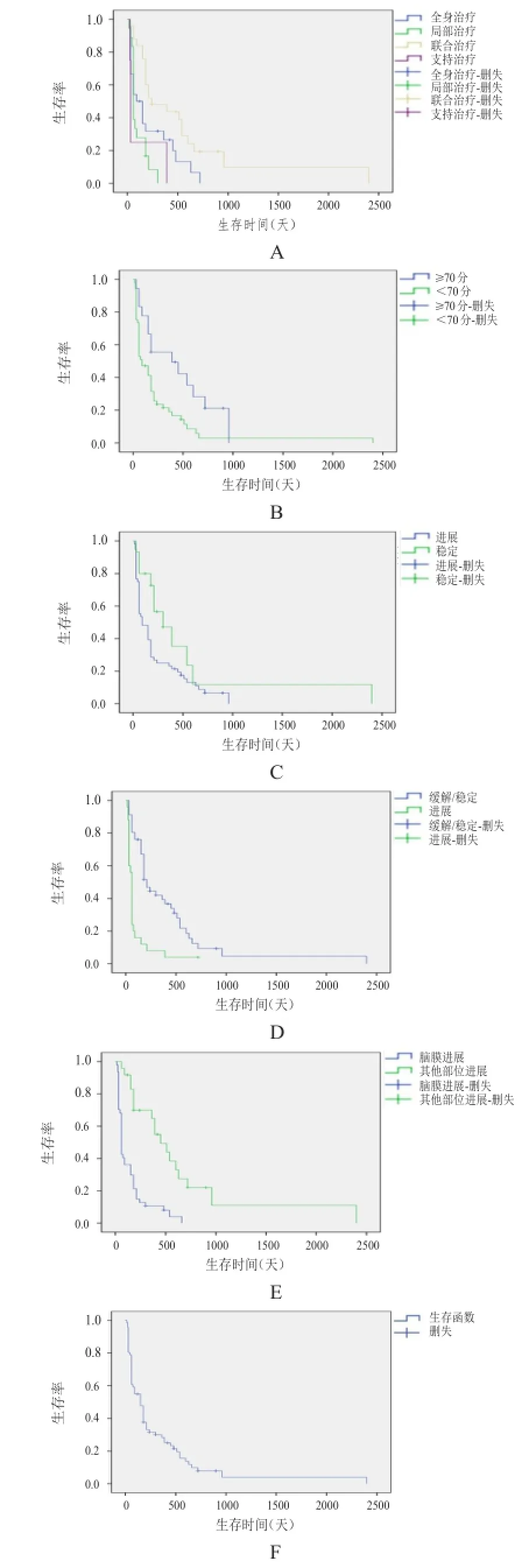
图1 肺癌LM患者的生存曲线

表2 不同治疗方法对脑膜转移病灶的近期疗效
2.6临床多因素分析
将KPS评分、原发肿瘤控制情况、治疗方式、近期疗效及直接死亡原因同时纳入Cox多因素回归模型进行预后分析,结果显示,临床近期疗效和患者直接死亡原因为LM预后的独立影响因素。见表3。

表3 71例LM患者预后的多因素分析
3 讨论
实体瘤的脑膜转移癌最常见于肺癌、乳腺癌、恶性黑色素瘤和胃癌[1-2],肺癌占40%~50%,乳腺癌约占20%。乳腺癌的LM生存期相对较长,约6个月,影响预后的有利因素包括,年龄≤55岁、KPS≥70分、病程较长、全身病况控制良好、无明显神经损伤或脑病、脑脊液蛋白显著升高、无大的脑膜病灶。2014年LM的NCCN指南中列出的危险因素有:KPS﹤60分、多发严重的神经功能损害、严重脑病、大病灶、缺乏有效治疗的广泛系统病变,不包括年龄和脑脊液蛋白水平。本文研究结果中表明KPS≥70分者生存期较长,体能状况较好的患者可以更好地耐受全身化疗,有机会接受全面的系统治疗[3]。因此,LM患者应积极地采用支持治疗、生物治疗和中医中药等综合治疗手段,改善患者的一般状况,这对提高患者的生存质量至关重要。
本研究结果显示,脑膜转移前原发性肿瘤得到控制的患者较处于进展期患者生存期明显延长,其中位生存期分别为10个月和3个月,差异有统计学意义(P=0.047),脑膜转移病灶的发生进展与脑外病灶并不一致。另一项对NSCLC耐药后LM治疗研究中显示,脑外病灶与LM耐药并非同步,其机制不明,可能与肺癌异质性、治疗后肿瘤遗传学改变等多因素相关。与乳腺癌LM不同,本结果显示病程较长不是生存的有利因素,从肺癌诊断至发生LM的中位时间是1年,超过1年者较病程少于1年者未见生存优势。
本组病例中70%的LM患者合并有脑实质转移,25%的患者脑转移与脑膜转移同时诊断,是否合并脑实质转移对生存无显著影响,LM也许是目前肺癌最严重的并发症之一,治疗难度远大于脑实质转移,未经治疗的患者多因进行性严重神经系统损伤导致迅速极度衰弱而死亡,自然病程4~6 周[4]。与患者相关的死亡原因中,因脑膜转移死亡较其他部位进展死亡患者的生存期明显缩短,其中位生存期分别为2个月和9个月,差异有统计学意义(P=0),LM病灶的控制情况对生存有显著影响。经治疗后脑膜转移病灶和原发病灶均获得稳定/好转患者的生存期较病情进展患者的生存期长,其中位生存期分别为7个月和2个月,差异有统计学意义(P=0),且是预后独立影响因素。因此,积极地处理和控制改善病情,或者稳定患者脑膜转移病灶有助于延长患者整体生存期。
由于LM的研究报道较少,尤其是临床治疗的研究数据缺乏,至今尚未建立标准有效的治疗方法。几项非随机对照或回顾性研究结果显示,经过现有治疗的患者中位生存期3~6个月,主要治疗方法包括:外科手术、全身治疗(系统化疗和靶向治疗)、局部治疗(全脑放疗和鞘内化疗)、支持治疗等。脑室腹腔分流术、Omaya管植入术等外科手术可以有效缓解颅内压增高症状,但也可能发生无菌性脑膜炎、感染等并发症,目前对其临床应用价值尚有争议。随着近几年化疗药物的研究进展,肺癌患者的生存质量也得到明显提高,全身化疗作为LM的一个治疗方法被重新重视,尤其是基因检测技术和靶向药物的应用使部分体能状况较差的患者获得了治疗机会,全身化疗和靶向治疗是LM的最重要的治疗方法[3,5-7],其疗效取决于药物渗透进入中枢神经系统的程度以及原发肿瘤对化疗药物的敏感性。随着新的化疗药物不断涌现,能透过血脑屏障的化疗药物有亚硝脲类药物,如尼莫司汀、洛莫司汀,其他如替莫唑胺、培美曲塞、拓扑替康,阿糖胞苷等。由于多数化疗药物(包括TKI等靶向药物)血脑屏障的透过率低,不能在CSF中达到有效抑瘤浓度,而加大化疗药物剂量又会增加毒性反应,因此即使其他病灶治疗反应良好,LM仍不能有效控制。近年来的研究表明,吉非替尼可以穿透血脑屏障,尤其伴有中枢神经系统转移有更高的CNS渗透[8],吉非替尼或厄洛替尼对非小细胞肺癌伴脑膜转移患者的治疗有效[9-10]。Grommes等[11]脉冲式应用厄洛替尼(900~ 1500 mg、每周1次口服)治疗8例TKI治疗进展的EGFR突变肺癌LM患者,6例LM获得PR,2例PD,中位生存期12个月,TTP2.7个月,认为脉冲式给药可以提高脑脊液中TKI浓度,达到有效促进癌细胞凋亡作用。Segura等[12]应用替莫唑胺一线治疗19例脑膜转移癌患者,中位生存时间43 d,结果提示,替莫唑胺在脑膜转移癌治疗中的作用和价值有待进一步探讨。本组病例中有单纯全身化疗患者15例,单纯靶向治疗5例,化疗联合靶向治疗3例。单纯全身治疗(全身化疗、靶向治疗)的患者中位生存期为90 d,与支持治疗患者比较,差异无统计学意义(P=0.167),结果表明,单纯全身治疗虽然不能显著延长患者的生存时间,但使脑膜转移病灶的近期客观缓解率升高,减轻中枢神经系统症状,从而改善患者的生存质量(P=0.031)。
LM的局部治疗包括鞘内化疗及全脑脊膜放疗。鞘内化疗是治疗LM的传统方法,常用药物有甲氨蝶呤、阿糖胞苷、阿糖胞苷脂质体、噻替哌,其他如依托泊苷、托泊替康、α-干扰素、利妥昔单抗、曲妥珠单抗等也有报道。疗效影响因素包括:原发性肿瘤对这些药物的敏感性、药物在肿瘤组织的弥散程度、药物细胞周期的特异性限制和半衰期短以及药物脑-脑脊液屏障渗透性等。有研究显示,脑脊液肿瘤细胞多数处于G0期,M期1%,S期0.1%,脑脊液循环梗阻阻碍药物到达肿瘤部位也使疗效减低。由于文化习俗的差异以及疗效不肯定,国内部分患者对鞘内注射存有严重的恐惧心理,患者依从性差。本组71例LM患者中,仅有13例患者接受了鞘内化疗,明显低于西方国家。鞘内化疗在脑膜白血病治疗中取得了良好的临床疗效,在实体瘤的LM中未显示出肯定的生存获益,普遍认为有益于缓解临床症状。Waki等[1]回顾性分析85例脑膜转移患者,经鞘内化疗的患者(n= 31)与未经鞘内化疗的患者(n=54)生存期比较有统计学差异(P=0.0001),鞘内注射化疗可延长患者生存期[1]。但多数研究结果显示,鞘内注射化疗并未延长患者的生存时间。Boogerd等[5]回顾性分析35例乳腺癌脑膜转移患者,经鞘内化疗的患者(n= 17)与未经鞘内化疗的患者(n=18)生存期比较无统计学差异(P=0.32),联合鞘内注射化疗不能延长患者生存期。Bokstein等[13]回顾性分析104例实体癌脑膜转移患者,经鞘内化疗者(n=54)与未经鞘内化疗者(n=50)中位生存期均为4个月,鞘内化疗的患者中20%发生迟发性脑白质病。
全脑脊膜放疗(SCI)因放射野区域覆盖颅骨和椎体,常造成严重的骨髓抑制影响患者的后期化疗,易引发高病死率。并且由于多个病灶弥散分布不能精确定位治疗,难以达到预期临床疗效。多项研究结果表明SCI并不能使患者生存获益。Morris等[14]回顾性分析125例肺癌脑膜转移患者,所有患者的中位生存期为3.0个月,经全脑放射治疗的患者(n=46)与未经全脑放射治疗患者(n=59)生存期比较无统计学差异(P=0.84),但针对块状病灶及产生症状病灶进行的放疗,可使患者姑息性获益。本研究也显示,单纯局部治疗(鞘内化疗、头部放疗)者中位生存期60 d,与支持治疗者比较,生存期无统计学差异(P=0.893)。单纯局部治疗与支持治疗相比较,虽然不能显著延长患者的生存时间,但使脑膜转移病灶的近期客观缓解率升高,减轻中枢神经系统症状,从而改善了患者的生存质量(P=0.027)。
Oechsle等[15]回顾性分析了135例实体瘤脑膜转移患者的治疗疗效,接受全身化疗联合鞘内化疗的患者生存期明显高于单纯局部化疗和放射治疗患者(5.6个月vs 1.7个月)。本研究分析了全身治疗(全身化疗和/或靶向治疗)、局部治疗(全脑放疗和/或鞘内化疗)、联合治疗及支持治疗对患者生存预后的影响,结果显示,接受联合治疗的患者可以显著延长生存期(P=0.001),与上述研究结果一致。Siegal[7]对104例实体瘤LM患者随机接受全身化疗、头部放疗及鞘内化疗联合治疗,接受全身化疗和头部放疗联合比较,两组中位生存期均为4个月,未见统计学差异,且前组患者脑部毒性反应严重。该研究提示,三联方案较二联方案毒性增加而并未提高疗效,也有研究报道脑部放疗后鞘内注射MTX会出现较严重的脑毒性,先鞘内注射MTX后脑放疗会使毒性反应减轻。本研究由于研究的病例数有限,联合治疗的具体模式还需进一步探讨。
多元Cox回归分析结果显示,近期疗效及直接死亡原因为患者独立的预后因素。临床上采用有效治疗获得脑膜转移病灶和原发病灶的缓解/稳定。以上的研究结果表明,经单纯全身治疗后,即使原发病灶等脑外病灶获得缓解,但对脑膜转移病灶疗效较差,患者因脑膜病灶进展死亡;单纯局部治疗可以缓解颅内压增高等神经症状,但多数疗效短暂,全身治疗联合局部治疗可使患者生存获益。本研究肺癌脑膜转移患者中位生存时间为5个月,近期疗效缓解/稳定者中位生存期可延长2个月。一般状况较好的患者应尽早应用联合治疗,体能状况较差者予积极支持对症治疗,同时依据病况使用鞘内化疗,从而缓解症状,减轻神经功能损害,尽快提升患者的整体状况,争取全身治疗的机会。对靶基因检测,如发现EGFR、ALK基因改变的患者可尽早应用靶向药物。局部治疗方法的选择可根据是否存在较大肿块和脑脊液梗阻情况决定首选鞘内化疗或放疗。
LM的早期诊断有助于及早开始治疗。脑脊液细胞学检查发现癌细胞是确诊LM的金标准,增强脑核磁是首选的影像学检查,首次CSF细胞学检查阳性率约50%,两次检查阳性率可达80%以上。约90%的患者CSF蛋白升高,50%有糖减少,﹤5%的LM常规CSF检查正常(未发现异常)。CSF蛋白>500 mg/dl考虑病情进展或合并有脑脊液循环梗阻,有报道显示30%~70%的LM患者存在部分或完全性脑脊液循环梗阻,对怀疑有脑脊液循环梗阻者推荐做脑脊液流量监测。近年来人们开始应用分子生物学技术检测脑脊液中的肿瘤DNA和相关抗原,以寻找一种更有效的方法来锁定高危人群,及早干预,可能会从根本上改善LM的预后。因此LM的早期诊断方法以及最佳的治疗模式需要我们继续研究与探索。
[1]Waki F,Ando M,Takashima A,et al.Prognostic factors and clinical outcomes in patients with leptomeningeal metastasis from solid tumors[J].J Neuro-Oncol,2009,93(2): 205-212.
[2]Clarke JL,Perez HR,Jacks LM,et al.Leptomeingeal metastases in the MRI era[J].Neurology,2010,74(18):1449-1454.
[3]Nagpal S,Riess J,Wakelee H.Treatment of leptomeningeal spread of NSCLC:a continuing challenge[J].Curr Treat Options Oncol,2012,13(4):491-504.
[4]LeRhun E,Massin F,Tu Q,et al.Development of a new method for identification and quantification in cerebrospinal fluid of malignant cells from breast carcinoma leptomeningeal metastasis[J].BMC Clin Pathol,2012,12(1):21.
[5]Boogerd W,Van den Bent MJ,Koehler PJ,et al.TheRelevance of intraventricular chemotherapy for leptomeningeal metastasis in breast cancer:aRandomized study[J].Eur J Cancer,2004,40(18):2726-2733.
[6]De Wit M,Lange-Brock V,Kruell A,et al.Leptomeningeal metastases:results of different therapeutic approaches[J].J Clin Oncol,2007,25(18s):2047.
[7]Siegal T.Leptomeningeal metastases:rationale for systemic chemotherapy or what is theRole of intra-CSF-chemotherapy?[J].J Neuro-Oncol,1998,38(2-3):151-157.
[8]Wang M,Zhao J,Chen M,et al.Cerebral penetration of gefi tinib in patients with lung adenocarcinoma[J].J Clin Oncol, 2011,29(4):502s(suppl;abstr 7608).
[9]Hashimoto N,Imaizumi K,Honda T,et al.SuccessfulRetreat with gefitinib for carcinomatous meningitis as diseaseRecurrence of non-small-cell lung cancer[J].Lung Cancer, 2006,53(3):387-390.
[10]Kim MK,Lee KH,Lee JK,et al.Gefitinib is also active for carcinomatous meningitis in NSCLC[J].Lung Cancer, 2005,50(2):265-269.
[11]Grommes C,Oxnard GR,Kris MG,et al.“Pulsatile”highdose weekly erlotinib for CNS metastases from EGFR mutant non-small cell lung cancer[J].Neuro Oncol,2011,13 (12):1364-1369.
[12]Segura PP,Gil M,Balañá C,et al.Phase II trial of temozolomide for leptomeningeal metastases in patients with solid tumors[J].J Neurooncol,2012,109(1):137-142.
[13]Bokstein F,Lossos A,Siegal T.Leptomeningeal metastases from solid tumors:a comparison of two prospective series treated with and without intra-cerebrospinal fluid chemotherapy[J].Cancer,1998,82(9):1756-1763.
[14]Morris PG,Reiner AS,Szenberg OR,et al.Leptomeningeal metastasis from non-small lung cancer:survival and the impact of whole brainRadiotherapy[J].J Thorac Oncol, 2012,7(2):382-385.
[15]Oechsle K,Lange-Brock V,Kruell A,et al.Prognostic factors and treatment options in patients with leptomeningeal metastases of different primary tumors:aRetrospective analysis[J].J CancerRes Clin Oncol,2010,136(11):1729-1735.
Clinical features and prognostic factors of lung cancer-induced leptomeningeal metastasis
LI Ning YU Lei YANG Bo-yan#
Department of General Medicine,Cancer Hospital,Chinese Academy of Medical Sciences,Beijing 100021,China
ObjectivectiveTo discuss the clinical features,treatment strategies,and prognostic factors of lung cancer-induced leptomeningeal metastasis(LM).MethodethodThisRetrospective analysis studied the clinical and follow-up data of 71 patients with LM in our hospital.Patients’survival curves were plotted using the Kaplan-Meier approach,and factors influencing patient prognosis were analyzed.ResultesultThe median survival time of these 71 patients was 150 d,and the 1-year survivalRate was 22.5%(16/71).Univariate analysis showed that the KPS score,control of primary tumor,treatment strategy,short-term efficacy,and direct cause of death were significantly associated with the survival of patients with LM (P<0.05 for all factors).Multivariate analysis identified short-term efficacy and direct cause of death as the independent prognostic factors for patients with LM(P<0.05 for both factors).ConclusionusionBoth of the short-term efficacy and direct cause of death are independent prognostic factors for patients with LM.Combined treatment(systemic treatment and local treatment)could prolong the survival of these patients,and improve prognosis.
ds:lung cancer;leptomeningeal metastasis;prognostic factors
R734.2
A
10.11877/j.issn.1672-1535.2016.14.01.17
2015-08-19)

