不同光处理下富氢水对萝卜芽苗菜花青苷含量和抗氧化能力的影响
张晓燕 贾 礼 田纪元 崔 瑾(南京农业大学生命科学学院,江苏南京 210095)
不同光处理下富氢水对萝卜芽苗菜花青苷含量和抗氧化能力的影响
张晓燕贾 礼田纪元崔 瑾*
(南京农业大学生命科学学院,江苏南京 210095)
∶在LED白光(W)和紫外光(UV-A)两种不同光条件下,研究培养液中添加富氢水(HRW)对萝卜芽苗菜生长、下胚轴中花青苷含量及抗氧化能力的影响,并检测了花青苷合成过程中关键结构基因的表达量变化。结果表明,与白光相比,紫外光处理显著抑制了萝卜芽苗菜的生长。不同连续光照时间(3、12、24、36 h)下,紫外光处理的萝卜芽苗菜下胚轴花青苷含量均显著高于白光处理;连续光照处理24 h和36 h时,UV-A+HRW处理下花青苷含量显著高于其他处理,表明UV-A有利于花青苷的合成,而HRW可进一步提高UV-A对花青苷合成的诱导作用;各连续光照时间下,DPPH自由基清除能力的变化趋势与花青苷含量基本一致。与白光相比,紫外光处理可明显提高花青苷合成关键基因的表达;UV-A+HRW处理下,PAL、CHS、CHI、F3H、DFR、LDOX和ANS的表达量均显著高于其他处理,表明UV-A+HRW处理下,上述基因的上调对花青苷含量的提高起到主要调控作用。
∶紫外光(UV-A);富氢水(HRW);萝卜芽苗菜;花青苷;抗氧化能力
萝卜芽苗菜是一种绿化型芽苗菜,含有丰富的有益人体健康的物质,如酚类化合物、抗坏血酸和硫代葡萄糖苷。花青苷是一种重要的酚类化合物,不仅赋予植物各种各样的颜色,如蓝色、紫色、红色、橙色等,还能保护植物应对外来的生物和非生物胁迫(Harborne & Williams,2000)。对人类健康而言,花青苷可作为抗氧化剂保护机体对抗心血管疾病、癌症和其他慢性疾病(Seeram,2008)。研究表明,光照处理有利于植物花青苷含量的提高,而遮阴处理有相反的效果(Takos et al.,2006;Albert et al.,2009)。此外,光强(Kang et al.,2013)、光质(Zhou & Singh,2004;Samuolienė et al.,2013)同样也会影响花青苷的合成,其中紫外光(Zhou et al.,2007;Tsurunaga et al.,2013)对花青苷合成的调控作用最明显。
植物中的花青苷生物合成主要受两类基因的共同调控。一类是结构基因,编码花青苷合成途径所需的酶,主要有苯丙氨酸解胺酶(PAL)、查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮-3-羟化酶(F3H)、二氢黄酮醇-4-还原酶(DFR)、花青素合成酶(ANS)、无色花青素双加氧酶(LDOX)、类黄酮葡萄糖苷转移酶(UFGT)等,其中CHS、CHI、F3H属于早期合成基因,DFR、ANS、LDOX、UFGT属于晚期合成基因(Cominelli et al.,2008;A lbert et al.,2009;Ferreyra et al.,2012);另一类是调节基因,编码调控结构基因表达的转录因子,主要包括MYB、bHLH和WD40等(Takos et al.,2006;杨鹏程 等,2012;Zhao et al.,2013)。
近年来,H2作为一种选择性的抗氧化剂和信号分子受到了广泛关注。在动物中,许多研究证明了H2具有抗氧化、抗炎症和抗细胞凋亡的作用,并推测H2在动物中具有重要的生理调节作用(Hong et al.,2010)。在植物中,越来越多的研究表明H2具有重要的生理作用,特别是在植物对胁迫的响应中发挥重要作用(Xie et al.,2012;Cui et al.,2013;Xu et al.,2013;Zeng et al.,2013)。比如,当以富氢水(HRW)的形式外源给植物提供H2时,能缓解镉胁迫和盐胁迫对植物引起的氧化胁迫作用,这可能与其对抗氧化代谢的调节有关(Xie et al.,2012;Jin et al.,2013;Xu et al.,2013,Wu et al.,2015)。Su等(2014)研究发现,与UV-A处理相比,UV-A+HRW处理可以显著提高萝卜芽苗菜花青苷的含量,并且HRW可以重建2个品种萝卜芽苗菜内源活性氧(ROS)的稳态,但在2个品种萝卜芽苗菜花青苷合成过程中起的作用不同。
本试验以杨花萝卜为试材,以HRW的形式给植物提供H2,旨在探究不同光环境下不同HRW处理时间对萝卜芽苗菜花青苷含量和抗氧化能力的影响;并检测了花青苷合成关键基因的表达量,为萝卜芽苗菜工厂化生产中光质的选择和HRW处理条件的选择提供理论依据。
1 材料与方法
1.1试验材料
供试萝卜(Raphanus sativus L.)品种为杨花萝卜,种子购于南京市大江蔬菜种子有限公司。
1.2试验方法
萝卜种子用去离子水浸泡12 h后,去除漂浮的种子和种皮上的粘液,沥去多余水分,黑暗条件下25 ℃催芽24 h,选取长势一致的种子播于铺有1层纱布的育苗盘中,培养液为1/4 Hoagland’s营养液或通有饱和富氢水(HRW)的1/4 Hoagland’s营养液,营养液每12 h更换1次,暗培养36 h后置于不同光照培养箱中培养,光源为LED白光(W) 或 紫 外 光(UV-A)(PHILIPS,TL 8W/ ACTINIC BL,MADE IN POLAND),调节电流以及光源与植株的距离,使用照度计(Hansatech,UK)测量,使白光的光照强度为30 μmol·m-2·s-1;使用紫外照度计(UV-340A,Lutron,Taiwan)测量,使得UV-A辐射强度为5.5 W·m-2,培养箱内相对湿度约为80%,温度为(25±2)℃。照光处理3、12、24 h和36 h后随机取样测定植株下胚轴中各项生长指标和生理指标;连续光照24 h后取样,采用Trizol试剂法提取植株总RNA,反转录成cDNA备用,使用引物(表1)进行qRT-PCR,获得花青苷合成相关基因(PAL、CHS、CHI、F3H、DFR、LDOX、ANS、UFGT),扩增产物相对表达量测定使用荧光定量PCR仪(ABI 7500,USA)进行检测。

表1 qRT-PCR引物
1.3富氢水的制备
富氢水通过鼓泡法制备,用氢气发生器(SHC-300,Saikesaisi Hydrogen Energy Co.,Ltd.,China)以150 mL·min-1的速度产生纯H2(99.99%,V/V)通入1 L水中,鼓泡30 min制备(Bernardi et al.,2008),随后立即用于处理。本试验条件下,新鲜制备的富氢水中H2的浓度为0.22 mmol·L-1,并可以在25 ℃下12 h内保持一个相对稳定的浓度。参照Su等(2014),本试验中所用的富氢水浓度为100%。
1.4项目测定
生长指标的测定∶萝卜芽苗菜下胚轴长采用直尺测定;全株鲜质量、可食鲜质量采用万分之一天平(Sartorius,BSA 124S)测定。每处理3次重复,每重复取15株。
可食率=可食鲜质量/全株鲜质量×100%
生理指标的测定∶花青苷含量的测定参照Zhou等(2013)方法;采用DPPH法测得花青苷提取物的抗氧化能力,DPPH自由基清除能力的测定参照Kim等(2006)的方法。每处理3次重复。
采用Excel 2010软件进行数据整理,SPSS 17.0软件进行方差分析,Origin 8.5软件进行绘图,显著性测验采用邓肯氏新复极差法(P<0.05)。
2 结果与分析
2.1不同光处理下富氢水对萝卜芽苗菜生长的影响
不同光处理对萝卜芽苗菜生长的影响显著(图1、表2)。白光处理的萝卜芽苗菜下胚轴呈浅红色,紫外光处理的呈深红色,UV-A+HRW处理的萝卜芽苗菜下胚轴红色最深(图1)。与白光处理相比,紫外光处理的萝卜芽苗菜下胚轴长、可食鲜质量和全株鲜质量均显著降低;UV-A处理的萝卜芽苗菜可食率最低,为88.58%,且显著低于W和W+HRW处理;UV-A处理下,外源添加富氢水提高了萝卜芽苗菜的可食率,但差异未达显著水平(表2)。

图1 不同光处理下富氢水对萝卜芽苗菜生长的影响
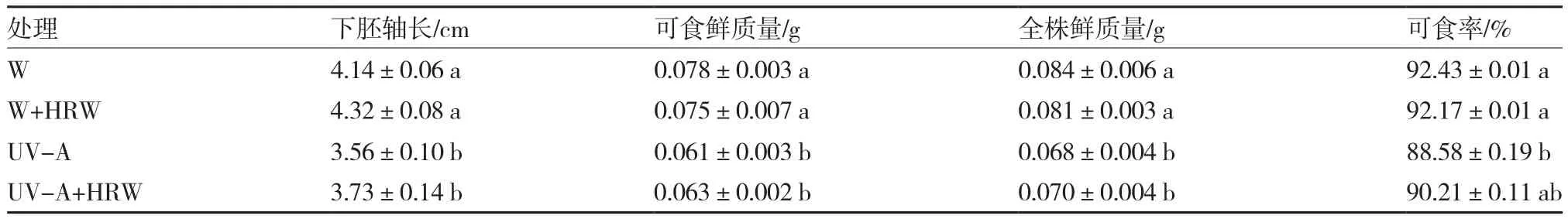
表2 不同光处理下富氢水对萝卜芽苗菜生长的影响
2.2不同光处理下富氢水对萝卜芽苗菜花青苷含量和抗氧化能力的影响
由图2可知,相同处理时间下,紫外光处理的萝卜芽苗菜下胚轴花青苷含量均显著高于白光处理,且以UV-A+HRW处理最高;连续照光36 h,UV-A+HRW处理的萝卜芽苗菜下胚轴花青苷含量达到最大值(0.674),且显著高于其他处理。白光处理下,是否外源添加富氢水对萝卜芽苗菜下胚轴的花青苷含量无显著影响;而紫外光处理下,UV-A+HRW处理的花青苷含量均高于UV-A处理,连续照光24 h和36 h,差异达显著水平。
由图3可知,连续照光3 h和12 h,萝卜芽苗菜下胚轴的DPPH自由基清除能力各处理组之间无显著差异;而连续照光24 h和36 h,紫外光处理的萝卜芽苗菜下胚轴DPPH自由基清除能力显著高于白光处理;连续照光36 h,UV-A+HRW处理下DPPH自由基清除能力达到最大值(89.11%)。白光处理下,是否外源添加富氢水对萝卜芽苗菜下胚轴的DPPH自由基清除能力无显著影响;而紫外光处理下,连续照光36 h时,UV-A+HRW处理的花青苷含量显著高于UV-A处理。
2.3不同光处理下富氢水对萝卜芽苗菜花青苷合成关键基因的影响
对萝卜芽苗菜花青苷合成相关基因的qRTPCR分析表明(图4),与白光处理相比,紫外光处理的花青苷合成关键基因(除UFGT外)表达量明显增高,其中UV-A+HRW处理下各基因(除UFGT外)的表达量均显著高于其他处理,W和W+HRW处理之间花青苷合成相关基因的表达量无显著差异。
3 结论与讨论
3.1紫外光不利于萝卜芽苗菜生长
光是影响植物生长发育的重要环境因子,植物能通过体内多种多样的光受体感应不同波长范围的光,从而调节植物的生长发育与物质代谢。本试验发现,与白光处理相比,UV-A和UV-A+HRW处理均显著降低了萝卜芽苗菜的下胚轴长、全株鲜质量、可食鲜质量,表明紫外光不利于芽苗菜的生长,这与鲁燕舞等(2014)对萝卜芽苗菜、张晓燕等(2014)和魏圣军等(2015)对大豆芽苗菜的研究结果一致。
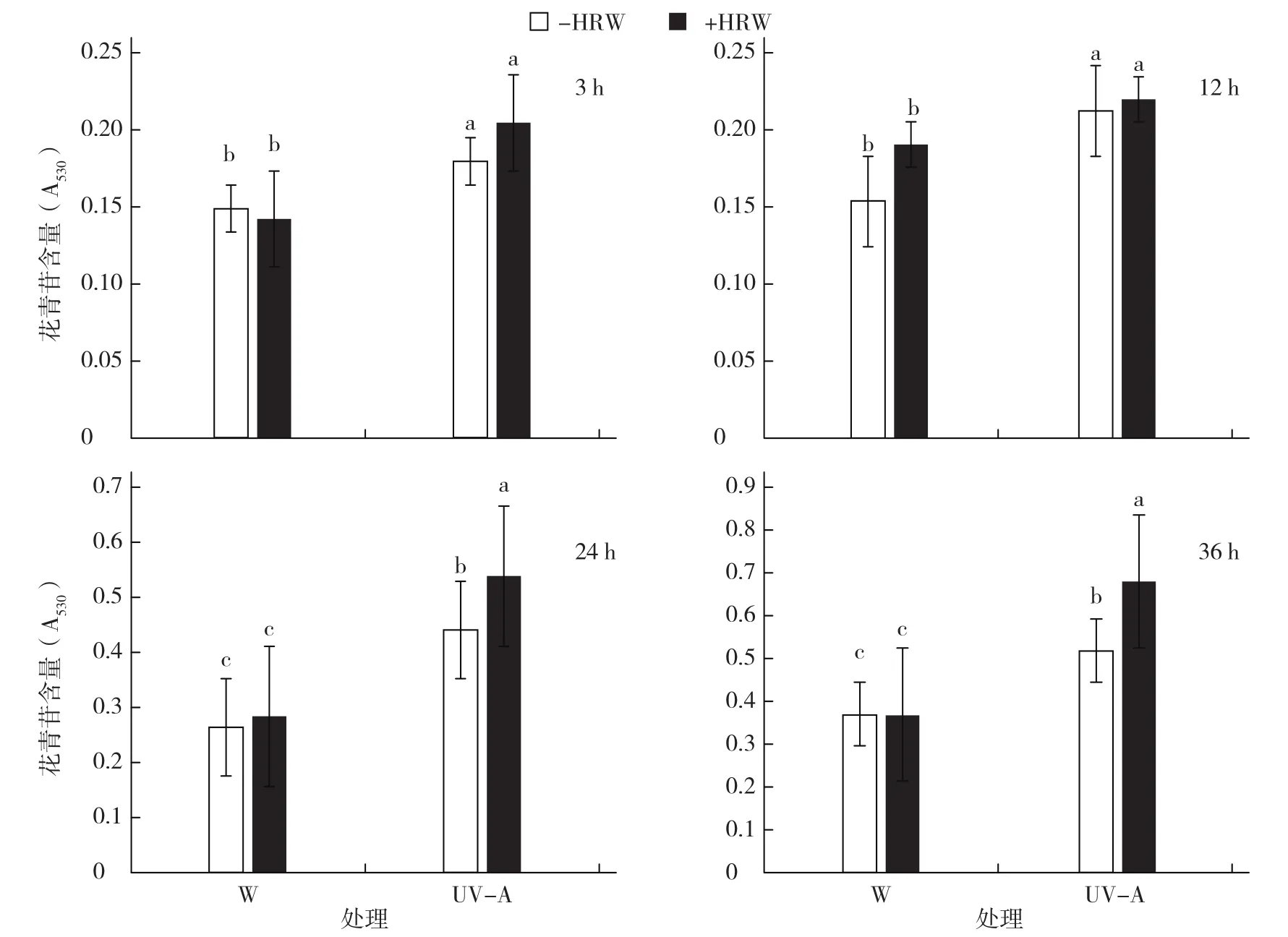
图2 不同光处理下富氢水对萝卜芽苗菜花青苷含量的影响

图3 不同光处理下富氢水对萝卜芽苗菜抗氧化能力的影响
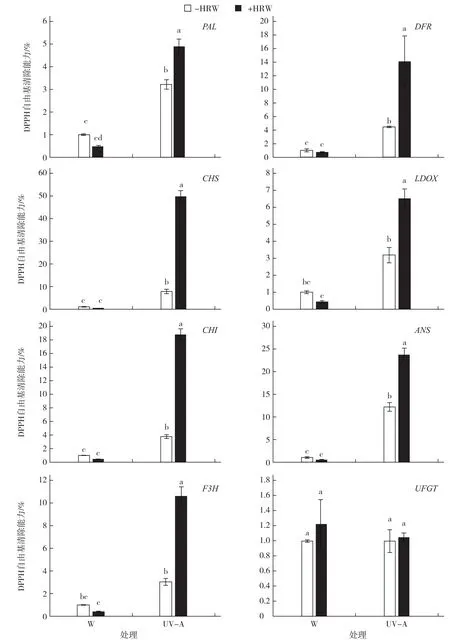
图4 不同光处理下富氢水对萝卜芽苗菜花青苷合成关键基因的影响
3.2紫外光有利于萝卜芽苗菜花青苷合成及增强抗氧化能力,富氢水具有进一步增效效果
在高等植物中,参与类黄酮合成途径的许多基因可被光诱导表达,进而导致花青苷的合成(Jianget al.,2016)。本试验中,不同的连续光照时间(3、12、24 h和36 h)下,紫外光处理的萝卜芽苗菜下胚轴花青苷含量均显著高于白光处理,表明紫外光对花青苷合成具有促进作用,这与Bo等(2007)在芜菁、Guo和Wang(2010)在番茄和戚楠楠等(2015)在大豆中的研究结果一致。本试验中,连续光照处理24 h和36 h时,UV-A+HRW处理的花青苷含量显著高于其他处理,表明HRW可进一步提高UV-A诱导的花青苷合成(Su et al.,2014)。
花青苷类物质具有抗氧化能力(Seeram,2008)。本试验结果表明,在连续光照处理3 h和12 h时,各处理之间的DPPH自由基清除能力没有显著差异,这可能是因为这两个处理时间较短,花青苷含量较低;而连续光照处理24 h和36 h时,紫外光处理的DPPH自由基清除能力显著高于白光处理,并且UV-A+HRW处理的DPPH自由基清除能力最强,这与花青苷含量的变化趋势一致。
3.3紫外光和富氢水对萝卜芽苗菜花青苷合成关键基因的合成具有协同促进作用
本试验发现,与白光相比,紫外光处理明显提高花青苷合成关键基因的表达,说明紫外光处理通过提高花青苷合成关键基因的表达来提高花青苷含量。UV-A+HRW处理下,PAL、CHS、CHI、F3H、DFR、LDOX和ANS的表达量均显著高于其他处理(图3),说明UV-A+HRW处理下,上述基因的上调对花青苷含量的提高起到主要调控作用。
综上所述,紫外光有利于提高萝卜芽苗菜花青苷含量,HRW通过提高花青苷合成途径中结构基因(CHS、CHI、F3H、DFR、LDOX和ANS)的表达,进一步诱导了萝卜芽苗菜下胚轴中花青苷的积累,提高萝卜芽苗菜的抗氧化能力。
鲁燕舞,张晓燕,耿殿祥,崔瑾.2014.光质对萝卜芽苗菜总酚类物质含量及抗氧化能力的影响.园艺学报,41(3)∶545-552.
戚楠楠,张晓燕,苏娜娜,邬奇,耿殿祥,齐学会,魏圣军,崔瑾.2015.UV-A诱导大豆芽苗菜下胚轴中花青苷积累的分子机理.中国农业科学,(12)∶2408-2416.
杨鹏程,周波,李玉花.2012.植物花青素合成相关的bHLH转录因子.植物生理学报,48(8)∶747-758.
魏圣军,耿殿祥,邬奇,张晓燕,苏娜娜,崔瑾.2015.UV-A辐射对大豆芽苗菜中抗坏血酸含量的影响.大豆科学,34(3)∶420-426.
张晓燕,鲁燕舞,魏圣军,崔瑾.2014.光质对大豆芽苗菜生长和大豆异黄酮含量及PAL活性的影响.大豆科学,33(1)∶46-52.
Albert N W,Lewis D H,Zhang H,Irving L J,Jameson P E,Davies K M.2009.Light-induced vegetative anthocyanin pigmentation in petunia.Journal of Experimental Botany,60(7)∶2191-2202.
Bernardi C,Chiesa L M,Soncin S,Passerò E,Biondi P A.2008. Determination of carbon monoxide in tuna by gas chromatography with micro-thermal conductivity detector.Journal of Chromatographic Science,46(5)∶392-394.
Bo Z,Li Y,Xu Z.2007.Ultraviolet A-specific induction of anthocyanin biosynthesis in the swollen hypocotyls of turnip (Brassica rapa).Journal of Experimental Botany,58(7)∶1771-1781.
Cominelli E,Gusmaroli G,Allegra D,Galbiati M,Wade H K,Jenkins G I,Tonelli C.2008.Expression analysis of anthocyanin regulatory genes in response to different light qualities in Arabidopsis thaliana.Journal of Plant Physiology,165(8)∶886-894.
Cui W,Gao C,Fang P,Lin G,Shen W.2013.Alleviation of cadmium toxicity in Medicago sativa,by hydrogen-rich water. Journal of Hazardous Materials,260∶715-724.
Ferreyra M L F,Rius S P,Casati P.2012.Flavonoids: biosynthesis,biological functions,and biotechnological applications.Frontiers in Plant Science,3(222)∶279-286.
Guo J,Wang M H.2010.Ultraviolet A-specific induction of anthocyanin biosynthesis and pal expression in tomato(Solanum lycopersicum L.).Plant Growth Regulation,62(1)∶1-8.
Harborne J B,Williams C A.2000.Advances in flavonoid research since 1992.Phytochemistry,55(6)∶481-504.
Hong Y,Chen S,Zhang J M.2010.Hydrogen as a selective antioxidant∶a review of clinical and experimental studies.Journal of International Medical Research,38(6)∶1893-1903.
Jiang M,Li R,Lian H,Yang L,Chen H.2016.Novel insight into the mechanism underlying light-controlled anthocyanin accumulation in eggplant(Solanum melongena L.).Plant Science,249∶46-58.
Jin Q,Zhu K,Cui W,Xie Y,Han B,Shen W.2013.Hydrogen gas acts as a novel bioactive molecule in enhancing plant tolerance to paraquat-induced oxidative stress via the modulation of heme oxygenase-1 signalling system.Plant Cell & Environment,36 (5)∶956-969.
Kang J H,Krishnakumar S,Atulba S L S,Jeong B R,Hwang S J. 2013.Light intensity and photoperiod influence the growth and development of hydroponically grown leaf lettuce in a closed-type plant factory system.Horticulture Environment & Biotechnology,54(6)∶501-509.
Kim J S,Lee B H,Kim S H,Oh K H,Cho K Y.2006.Responses to environmental and chemical signals for anthocyanin biosynthesis in non-chlorophyllous corn(Zea mays L.)leaf.Journal of PlantBiology,49(1)∶16-25.
Samuolienė G,Brazaitytė A,Sirtautas R,Viršilė A,Sakalauskaitė J,Sakalauskienė S,Duchovskis P.2013.Led illumination affects bioactive compounds in romaine baby leaf lettuce.Journal of the Science of Food & Agriculture,93(13)∶3286-3291.
Seeram N P.2008.Berry fruits for cancer prevention: current status and future prospects.Journal of Agricultural & Food Chemistry,56 (3)∶630-635.
Su N,Wu Q,Liu Y,Cai J,Shen W,Xia K,Cui J.2014. Hydrogen-rich water reestablishes ros homeostasis but exerts differential effects on anthocyanin synthesis in two varieties of radish sprouts under UV-A irradiation.Journal of Agricultural & Food Chemistry,62(27)∶6454-6462.
Takos A M,Jaffé F W,Jacob S R,Bogs J,Robinson S P,Walker A R.2006.Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples.Plant Physiology,142 (3)∶1216-1232.
Tsurunaga Y,Takahashi T,Katsube T,Kudo A,Kuramitsu O,Ishiwata M.2013.Effects of UV-B irradiation on the levels of anthocyanin,rutin and radical scavenging activity of buckwheat sprouts.Food Chemistry,141(1)∶552-556.
Wu Q,Su N,Cai J,Shen Z,Jin C.2015.Hydrogen-rich water enhances cadmium tolerance in Chinese cabbage by reducing cadmium uptake and increasing antioxidant capacities.Journal of Plant Physiology,175∶174-182.
Xie Y,Mao Y,Lai D,Zhang W,Shen Wen.2012.H2enhances Arabidopsis salt tolerance by manipulating zat10/12-mediated antioxidant defence and controlling sodium exclusion.PLoS One,7 (11)∶e49800.
Xu S,Zhu S,Jiang Y,Wang N,Wang R,Shen W,Yang J. 2013.Hydrogen-rich water alleviates salt stress in rice during seed germination.Plant & Soil,370(1-2)∶47-57.
Zeng J,Zhang M,Sun X.2013.Molecular hydrogen is involved in phytohormone signaling and stress responses in plants.PLoS One,8(8)∶e71038.
Zhao L,Gao L,Wang H,Chen X,Wang Y,Yang H,Wei C,Wan X,Xia T.2013.The R2R3-MYB,bHLH,WD40,and related transcription factors in flavonoid biosynthesis.Functional & Integrative Genomics,13(1)∶75-98.
Zhou Y,Singh B R.2004.Effect of light on anthocyanin levels in submerged harvested cranberry fruit.Journal of Biomedicine and Biotechnology,5∶259-263.
Zhou B,Li Y,Xu Z,Yan H,Homma S,Kawabata S.2007. Ultraviolet a-specific induction of anthocyanin biosynthesis in the swollen hypocotyls of turnip(Brassica rapa).Journal of Experimental Botany,58(7)∶1771-1781.
Zhou B,Zhang Z,Wang X H.2013.Anthocyanin-rich maize purple plant pigment stimulated the proliferation and differentiation of osteoblastic Mc3t3-E1 cells.Ann Nutr Metab,63∶1148-1149.
Abstract∶Effects of hydrogen-rich water(HRW) on growth,anthocyanin content and antioxidant capacity of radish sprouts cultured under 2 different light conditions of LED white light and UV-A irradiation were studied,and changes in transcript levels of anthocyanin biosynthesis-related genes were examined.The results showed that compared with the white light treatment,UV-A treatment could significantly depress the growth of radish sprouts.And under different continuous irradiation times(3,12,24 and 36 hours),the anthocyanin content of radish sprouts treated with UV-A were significantly higher than that treated with white light.Compared with other treatments,UV-A+HRW treatment could significantly increase anthocyanin content after 24 hours and 36 hours continuous irradiation,indicating that UV-A irradiation was favorable for anthocyanin biosynthesis,while,HRW could further enhance the abduction of this biosynthesis.And the changing trend of DPPH free radical scavenging ability were consistent with anthocyanin content under various continuous lighting times.Compared with the white light treatment,UV-A treatment could obviously increase the transcript levels of anthocyanin biosynthesis-related genes,the transcript levels of PAL,CHS,CHI,F3H,DFR,LDOX and ANS,treated by UV-A+HRW were all remarkably higher than that of the other treatments,indicating that under UV-A+HRW treatment,the upregulation of those genes was playing leading role in increasing anthocyanin contents.
Keywords∶UV-A;Hydrogen-rich water(HRW);Radish sprouts;Anthocyanin;Antioxidant capacity
Effects of HRW on Anthocyanin Content and Antioxidant Capacity of Radish Sprouts Treated with Different Light Treatments
ZHANG Xiao-yan,JIA Li,TIAN Ji-yuan,CUI Jin*
(School of Life Sciences,Nanjing Agricultural University,Nanjing 210095,Jiangsu,China)
张晓燕,博士研究生,主要从事植物光生物学方面的研究,E-mail∶2014216004@njau.edu.cn
(Corresponding author)∶崔瑾,博士,教授,主要从事设施栽培环境调控机理方面的研究,E-mail∶cuijin@njau.edu.cn
∶2016-06-30;接受日期∶2016-07-20
国家自然科学基金项目(31572169),江苏省农业科技自主创新资金项目〔CX(15)1040〕
——芽苗菜

