自然杀伤细胞与丙型肝炎病毒感染的Huh7.5细胞体外共培养后的功能变化
胡 姚 张 婷 叶颖子 王晓红 俞 蕙
·论著·
自然杀伤细胞与丙型肝炎病毒感染的Huh7.5细胞体外共培养后的功能变化
胡姚1张婷2叶颖子1王晓红1俞蕙1
目的探讨体外丙型肝炎病毒(HCV)感染对NK细胞功能产生的影响及其可能的机制。方法 利用质粒JC1-Flag2体外转录得到的HCV感染性颗粒(HCVcc)以MOI4.8感染Huh7.5细胞(Huh7.5-HCVcc),与健康人外周血分离得到的NK细胞进行共培养。与Huh7.5-HCVcc细胞共培养前后,采用ELISA法和MTT比色法分别检测NK分泌细胞因子IFN-γ、TNF-α和IL-10的水平和细胞杀伤活性,以评估HCV感染对NK细胞功能的影响。结果与MOI4.8的Huh7.5-HCVcc细胞共培养,NK细胞分泌IFN-γ、TNF-α和IL-10水平受到抑制,其中IFN-γ在共培养6 h(P<0.001)、9 h(P<0.001)、12 h(P<0.001)受到显著抑制,TNF-α在共培养6 h(P<0.001)、9 h(P<0.001)、12 h(P=0.001)受到显著抑制,IL-10在共培养6 h(P<0.001)、9 h(P=0.006)受到显著抑制;且NK细胞分泌细胞因子IFN-γ、TNF-α和IL-10的功能均在共培养6 h受到的抑制效应最大,平均抑制率分别为24.1%、20.7%和24.3%。NK细胞杀伤活性在共培养6 h(P=0.023)受到抑制,平均抑制率为16.6%。结论在体外与MOI4.8的Huh7.5-HCVcc细胞共培养,NK细胞分泌细胞因子(IFN-γ、TNF-α和IL-10)和细胞杀伤功能均受到抑制,且在不同时间点受到的抑制程度不同,提示NK细胞在HCV感染的不同阶段可能起到不同的作用。
自然杀伤细胞;丙型肝炎病毒;Huh7.5细胞;共培养
AbstractObjectiveThe numbers, subsets and function of natural killer (NK) cells altered in chronic hepatitis C virus (HCV) infected patients which indicating its association with chronic HCV infection, but the exact mechanisms remain unclear. To explore the functional effect of HCV infection on NK cells in vitro and the possible mechanism behind it.MethodsHuman hepatoma Huh7.5 cells were transfected with genomic RNA from cell culture adapted JC1 genotype 2a HCV strain (Huh7.5-HCVcc) and co-cultured with NK cells isolated from whole peripheral blood of concentrated healthy donors. The functional effect of HCV infection on NK cells was assessed by testing cytokine-secreting and cytotoxicity before and after co-culture.ResultsWhen co-cultrued with Huh7.5-HCV of MOI 4.8, the levels of IFN-γ, TNF-α and IL-10 secreted by NK cells were inhibited. The inhibition of secreting IFN-γ was specially significant at 6(P<0.001), 9(P<0.001) and 12(P=0.001) hours co-cultured with Huh7.5-HCV. The inhibition of secreting TNF-α was specially significant 6 h(P<0.001), 9 h(P<0.001) and 12 h(P=0.001) after co-cultured with Huh7.5-HCVcc. And the significant inhibition of secreting IL-10 appeared at 6 h(P<0.001) and 9 h(P=0.006) after co-cultured with Huh7.5-HCVcc. The strongest cytokine-secreting inhibition appeared 6 h after co-cultured with Huh7.5-HCVcc, the inhibition rate was 24.1%, 20.7% and 24.3%, respectively. The cytotoxicity decreased significantly 6 h after co-cultured with Huh7.5-HCVcc(P=0.023), and the average inhibition rate was 16.6%.ConclusionWhen in vitro cocultrued with Huh7.5-HCVcc of MOI 4.8, the NK cells functions of IFN-γ, TNF-α and IL-10 cytokine-secreting and cytotoxicity were inhibited. The degree of inhibition was different at different time points, which indicated that NK cells may act differently during HCV infection.
在慢性丙肝患者外周血和肝脏中,NK细胞的细胞总数、占外周血淋巴细胞数的比例较健康者均有不同程度的下降,NK细胞亚群也发生了变化,CD56brightNK细胞亚群比例呈上升趋势,CD56dimNK细胞亚群比例下降[1~4],且随着病程进展而发生变化[5],提示其可能与慢性丙型肝炎病毒(HCV)感染相关。但由于HCV不能直接感染NK细胞,缺乏理想的HCV体外感染模型,目前大多数研究多为对慢性丙肝患者外周血中NK细胞数量、亚群比例和功能等做初步研究,关于NK细胞在HCV感染发病过程中所起作用的具体机制尚不明确,使得在患者体内进一步的深入研究可操作性不高且不同患者存在个体差异。本研究采用体外构建的HCV感染性颗粒(HCVcc) 感染Huh7.5细胞,建立有效的HCV体外感染系统,并与健康人外周血中分离的NK细胞进行共培养,探讨HCV感染对NK细胞功能的影响,以期建立一个体外稳定有效的HCV感染NK细胞的模型,为体外研究NK细胞在HCV感染发病机制中的作用优化条件。
1 方法
1.1HCVcc的构建HCV全长基因组克隆质粒JC1-Flag2(由日本Wakita T教授惠赠)经体外酶切、线性化、转录后得到HCV RNA,将其电转入人肝癌来源细胞Huh7.5,所得HCVcc经连续稀释、HCV非结构蛋白NS5A染色(一抗:anti-NS5A-9E10,二抗:goat-anti-mouse-HRP)后,计数NS5A染色阳性细胞(即HCV感染的细胞),按Reed和Muench方法测定病毒滴度。Huh7.5细胞株和anti-NS5A-9E10抗体均由美国Rockerfeller大学Charlies Rice教授惠赠。
1.2HCVcc感染Huh7.5细胞各取5×105·mL-1的Huh7.5细胞2 mL铺于8块6孔细胞培养板,12 h细胞贴壁后,培养板各孔分别加入感染复数(MOI)为0(无病毒转染细胞孔)、0.8、1.6、3.2和4.8的病毒感染细胞,8 h后用1×PBS洗涤细胞3次去除残余病毒后,更换新的DMEM培养液,37℃、5%CO2恒温培养箱中孵育72 h,采用CELISA法定量检测病毒蛋白NS3的表达量。选取转染效率(即NS3表达量)最高的MOI时的Huh7.5-HCVcc细胞与NK细胞共培养作为实验组,以MOI为0作为对照组。
1.3HCVcc感染Huh7.5细胞后产生病毒应激颗粒检测HCVcc感染Huh7.5细胞72 h后,采用HCV的RNA结合蛋白G3BP1和翻译相关蛋白eIF4G,共同标记HCVcc感染Huh7.5细胞后诱生的病毒应激颗粒,在荧光显微镜下观察。
1.4感染HCVcc后Huh7.5细胞的代谢活动和增殖变化检测HCVcc感染Huh7.5细胞72 h后,采用MTT比色法检测Huh7.5细胞对人红白血病细胞K562的特异性裂解率,以评估Huh7.5细胞的代谢活动;分别用DAPI染料和HCV核抗体对Huh7.5细胞核和HCV核心蛋白进行染色,荧光显微镜下观察Huh7.5细胞的增殖活动。
1.5NK细胞分离、培养和鉴定取健康志愿者(25~30岁,18人次)新鲜外周血30 mL,EDTA抗凝,用淋巴细胞分离液分离得到外周血单个核细胞(PBMC)。向所得PBMC中加入10 mL D-Hank′s液重悬,用5 mL 苯丙氨酸甲酯(5 mmol·L-1)室温处理40 min,去除富含溶酶体的单个核巨噬细胞和B细胞等,加入rhIL-2调整终浓度至200 U·mL-1,置37℃、5%CO2恒温培养箱中孵育。采用BD公司FACS Calibur流式细胞仪对上述分离所得NK细胞进行鉴定和纯度检测。
1.6NK细胞与HCVcc感染的Huh7.5细胞共培养的功能变化
1.6.1NK细胞与Huh7.5-HCVcc共培养取实验组和对照组感染72 h后的Huh7.5-HCVcc细胞(浓度为1×10-1·mL-1)和分离培养72 h的NK细胞(浓度为1×106·mL-1)各1 mL于8块6孔细胞培养板中共培养,每组2个复孔。同时设置单独NK细胞培养孔(只加2 mL NK细胞悬液)和调零孔(RPMI 1640完全培养基和DMEM培养液各1 mL),置37℃、5%CO2恒温培养箱孵育。
1.6.2共培养前后NK细胞杀伤活性的变化分别于共培养前和共培养3、6、9、12、15、18、21、24 h收获各孔细胞,置于1.5 mL离心管中(每组2管细胞),调整细胞浓度至2×106·mL-1备用。每组取1管细胞悬液,采用MTT比色法以K562细胞为靶细胞、E/T=40∶1测定NK细胞杀伤活性。
1.6.3共培养前后NK细胞分泌IFN-γ、TNF-α和IL-10的水平变化于共培养前和共培养3、6、9、12、15、18、21、24 h分别收集各孔培养上清1 mL,用0.22 μm的滤膜过滤后分装在1.5 mL离心管中,于-20℃保存备用。采用ELISA试剂盒(Abcam公司)检测上清中IFN-γ、TNF-α和IL-10水平,分别做出各自的标准曲线,得到IFN-γ、TNF-α和IL-10的可信范围分别为50~400、62.5~2 000和500~5 000 pg·mL-1。
2 结果
2.1不同MOI时HCVcc感染Huh7.5细胞时病毒蛋白NS3的表达水平以MOI为0作为对照,MOI为0.8、1.6、3.2和4.8时,病毒蛋白NS3的表达水平分别为1.7、3.1、4.8和5.5。故以MOI为4.8时Huh7.5-HCVcc细胞与NK细胞共培养作为实验组。
2.2HCVcc感染Huh7.5细胞后产生的病毒应激颗粒图1显示, 以MOI为0作为对照组 ,MOI为4.8的HCVcc
感染Huh7.5细胞72 h后,约95%的细胞均产生典型的HCV应激颗粒,该颗粒均同时含有G3BP1和eIF4G这2种HCV应激颗粒关键蛋白。

图1HCV感染Huh7.5细胞后产生的应激颗粒
注A: MOI=0; B: MOI=4.8
2.3感染HCVcc后Huh7.5细胞的代谢活动和增殖变化图2显示,MOI为4.8时Huh7.5细胞代谢活性受到的抑制最大,抑制率为28.6%。与对照组相比,实验组Huh7.5细胞的增殖未受到明显影响。
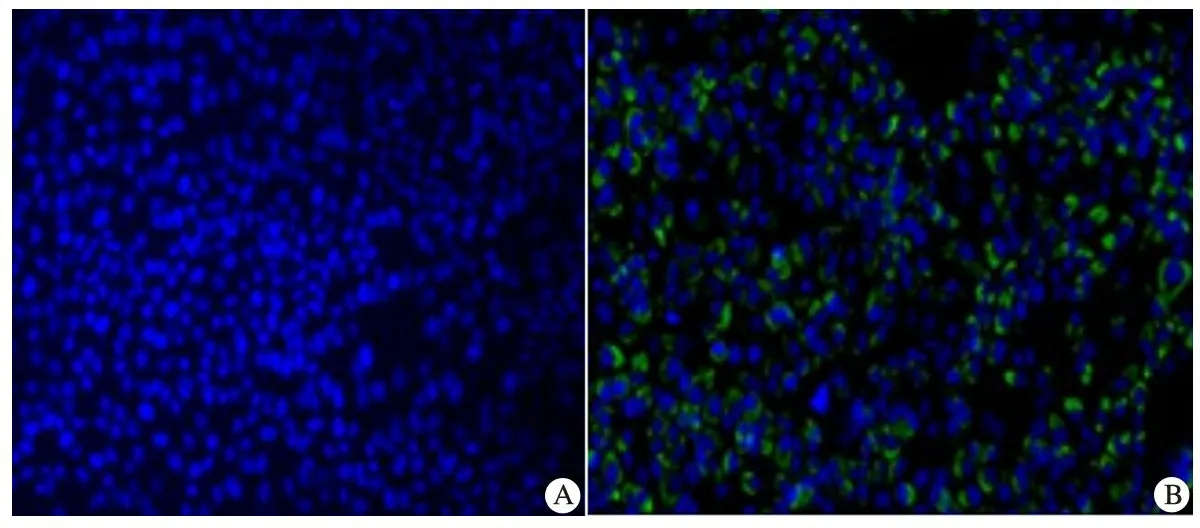
图2HCV感染时Huh7.5细胞的增殖活动
注A: MOI=0; B: MOI=4.8;蓝色颗粒为DAPI染色,绿色颗粒为HCV核抗体染色
2.4NK细胞的分离及鉴定图3显示,采用流式细胞仪对NK细胞进行鉴定和纯度检测,结果显示所得NK细胞纯度≥90%。
2.5共培养前后NK细胞杀伤活性的变化如图4所示,共培养前NK细胞的杀伤活性最强。随着共培养时间的延长,两组NK细胞的杀伤活性均逐步受到抑制,且实验组在共培养后任意一个时点均较对照组抑制率更大。由于NK细胞的衰减,故仅分析 3、6、9、12、15 h这5个时点的数据,NK细胞杀伤活性在共培养6 h(P=0.023)受到抑制,平均抑制率为16.6%。
2.6共培养前后NK细胞分泌IFN-γ、TNF-α和IL-10的水平变化由于NK细胞的衰减,在第18 h及之后的时点的测定值低于可信范围(图4),
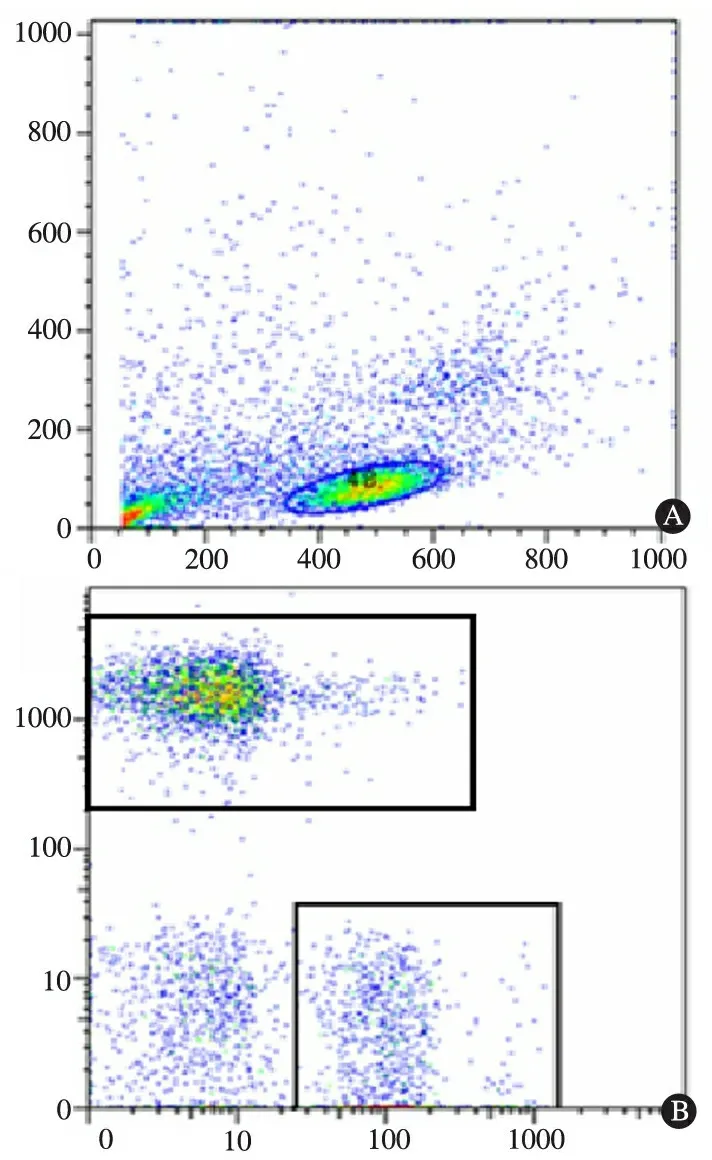
图3NK细胞流式细胞图
注A: 以淋巴细胞为门; B: 以NK细胞为门

图4共培养前后NK细胞杀伤活性
故仅对共培养3、6、9、12、15 h这5个时点的数据进行分析。图5显示,以MOI为0作为对照,NK细胞分泌IFN-γ、TNF-α和IL-10水平受到Huh7.5-HCVcc(MOI=4.8)的抑制,其中IFN-γ在共培养6 h(P<0.001)、9 h(P<0.001)、12 h(P=0.001)受到显著抑制,TNF-α在共培养6 h(P<0.001)、9 h(P<0.001)、12 h(P=0.001)受到显著抑制,IL-10在共培养6 h(P<0.001)、9 h(P=0.006)受到显著抑制;且NK细胞分泌细胞因子IFN-γ、TNF-α和IL-10的功能均在共培养6 h受到的抑制最大,平均抑制率分别为24.1%、20.7%和24.3%。
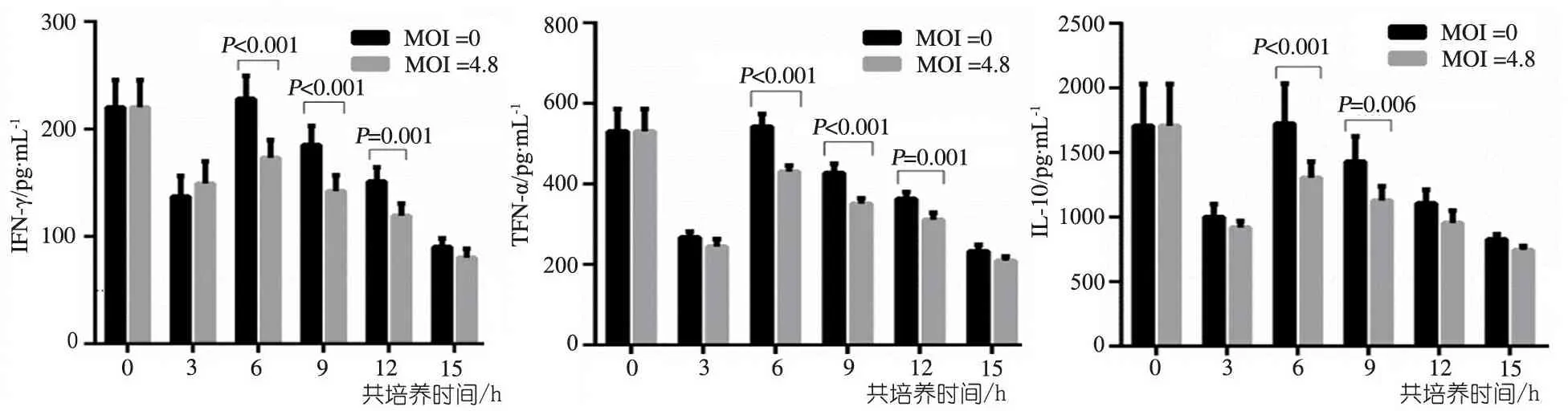
图5共培养前后NK细胞分泌IFN-γ、TNF-α和IL-10的水平
3 讨论
本研究以MOI为0作为对照,MOI为4.8时Huh7.5细胞代谢活性受到一定程度的抑制,但其增殖活动未受到明显影响。故Huh7.5细胞可用于建立有效的HCV体外感染细胞模型。
有报道RNA病毒感染细胞后会在细胞中产生病毒应激颗粒[6~9]。许多对HCV体外感染的研究中,为确认细胞被HCV感染后诱导产生的应激颗粒,多采用G3BP1和TIA1这2种HCV RNA结合蛋白中的一种或两种标记其应激颗粒[10,11]。本研究受张飞等[12]的启发,以RNA结合蛋白G3BP1和翻译相关蛋白eIF4G两种蛋白共同标记HCV感染Huh7.5细胞产生的应激颗粒。以MOI为0作为对照,MOI为4.8的HCVcc感染Huh7.5细胞72 h后,约95%的细胞产生典型的HCV应激颗粒,该颗粒同时含有HCV的RNA结合蛋白G3BP1和翻译相关蛋白eIF4G这2种HCV应激颗粒关键蛋白,进一步佐证了所得HCVcc能够有效的感染Huh7.5细胞,建立HCV体外感染体系。
目前的研究对慢性HCV感染患者外周血NK细胞的功能缺陷已经达成共识。从单细胞水平来看,慢性HCV感染患者外周血中NK细胞的杀伤功能受到的影响不大,甚至有所增强[13],但总体CD56dimNK细胞亚群的数量下降,NK细胞的总体杀伤功能相对减弱[14~16],而其分泌细胞因子功能下降;其机制可能为NK细胞受到了长期的慢性HCV感染诱导产生的低剂量IFN-α反复刺激,导致其杀伤功能活化,抑制IFN-γ信号通路[4],而IFN-γ是NK细胞清除HCV的有效方式,这可能是导致HCV感染慢性化的重要机制之一。由于临床上获取肝组织相比外周血困难,所以对慢性丙肝患者肝脏中NK细胞的研究尚不多。初步研究显示慢性丙肝患者肝脏中的NK细胞功能减弱[5]。
Holder等[17]用毒株JFH1感染Huh7.5细胞后与NK细胞共培养的研究发现,NK细胞分泌的细胞因子IFN-γ和TNF-α的水平受到显著抑制,而IL-4和IL-10的分泌水平并未受到明显影响,NK细胞杀伤活性亦受到抑制,但其研究仅检测了共培养5 h NK细胞功能受到的影响,未对共培养后不同时间点进行监测。本研究中利用健康志愿者NK细胞在200 U·mL-1的rhIL-2作用下体外培养72 h后,与MOI为4.8的Huh7.5-HCVcc细胞共培养,对共培养前和共培养后不同时间点NK细胞的功能进行了监测,NK细胞分泌的细胞因子IFN-γ、TNF-α和IL-10的水平均受到Huh7.5-HCVcc的抑制,IFN-γ和TNF-α均在共培养6、9和12 h受到显著抑制,IL-10在共培养6和9 h受到显著抑制;NK细胞的杀伤活性仅在共培养6 h受到的抑制最为显著。该结果与Holder等[17]研究的结果并不完全一致,可能与实验所用病毒质粒克隆不同、共培养监测时间点不同等实验条件有一定关系。本研究在体外用JC1感染Huh7.5细胞后与NK细胞共培养,发现NK细胞分泌细胞因子(IFN-γ、TNF-α和IL-10)和细胞杀伤功能均受到抑制,且在不同时间点受到的抑制程度不同,提示NK细胞在HCV感染的不同阶段可能起到不同的作用,但有关NK细胞在HCV感染发病过程中所起到的作用及其具体机制尚需进一步深入研究。
[1]Dessouki O, Kamiya Y, Nagahama H, et al. Chronic hepatitis C viral infection reduces NK cell frequency and suppresses cytokine secretion: Reversion by anti-viral treatment. Biochem Biophys Res Commun, 2010,393(2):331-337
[2]Oliviero B, Varchetta S, Paudice E, et al. Natural killer cell functional dichotomy in chronic hepatitis B and chronic hepatitis C virus infections. Gastroenterology, 2009,137(3):1151-1160, 1160-1161
[3]Bonorino P, Ramzan M, Camous X, et al. Fine characterization of intrahepatic NK cells expressing natural killer receptors in chronic hepatitis B and C. J Hepatol, 2009,51(3):458-467
[4]Mondelli MU, Varchetta S, Oliviero B. Natural killer cells in viral hepatitis: facts and controversies. Eur J Clin Invest, 2010,40(9):851-863
[5]Varchetta S, Mele D, Mantovani S, et al. Impaired intrahepatic natural killer cell cytotoxic function in chronic hepatitis C virus infection. Hepatology, 2012,56(3):841-849
[6]White JP, Cardenas AM, Marissen WE, et al. Inhibition of cytoplasmic mRNA stress granule formation by a viral proteinase. Cell Host Microbe, 2007,2(5):295-305
[7]Fros JJ, Domeradzka NE, Baggen J, et al. Chikungunya virus nsP3 blocks stress granule assembly by recruitment of G3BP into cytoplasmic foci. J Virol, 2012,86(19):10873-10879
[8]Finnen RL, Pangka KR, Banfield BW. Herpes simplex virus 2 infection impacts stress granule accumulation. J Virol, 2012,86(15):8119-8130
[9]Lindquist ME, Lifland AW, Utley TJ, et al. Respiratory syncytial virus induces host RNA stress granules to facilitate viral replication. J Virol, 2010,84(23):12274-12284
[10]Ruggieri A, Dazert E, Metz P, et al. Dynamic oscillation of translation and stress granule formation mark the cellular response to virus infection. Cell Host Microbe, 2012,12(1):71-85
[11]Garaigorta U, Heim MH, Boyd B, et al. Hepatitis C virus (HCV) induces formation of stress granules whose proteins regulate HCV RNA replication and virus assembly and egress. J Virol, 2012,86(20):11043-11056
[12]张飞. 丙型肝炎病毒调控细胞应激颗粒机制的初步探讨.复旦大学, 2013
[13]Oliviero B, Varchetta S, Cerino A, et al. Enhanced NK cell cytolytic activity in chronic HCV infection. J Hepatol, 2008,482:S51
[14]Morishima C, Paschal DM, Wang CC, et al. Decreased NK cell frequency in chronic hepatitis C does not affect ex vivo cytolytic killing. Hepatology, 2006,43(3):573-580
[15]Ahlenstiel G, Titerence RH, Koh C, et al. Natural killer cells are polarized toward cytotoxicity in chronic hepatitis C in an interferon-alfa-dependent manner. Gastroenterology, 2010,138(1):325-335
[16]Crotta S, Brazzoli M, Piccioli D, et al. Hepatitis C virions subvert natural killer cell activation to generate a cytokine environment permissive for infection. J Hepatol, 2010,52(2):183-190
[17]Holder KA, Stapleton SN, Gallant ME, et al. Hepatitis C virus-infected cells downregulate NKp30 and inhibit ex vivo NK cell functions. J Immunol, 2013,191(6):3308-3318
(本文编辑:张萍)
Functional changes in natural killer cells co-cultured with Huh7.5 cells infected with the hepatitis C virus in vitro
HUYao1,ZHANGTing2,YEYing-zi1,WANGXiao-hong1,YUHui1
(1DepartmentofInfectiousDiseases,TheChildren′sHospital,FudanUniversity,Shanghai201102; 2DepartmentofGastroenterology,ShanghaiChildren′sHospital,ShanghaiJiaotongUniversity,Shanghai200040,China)
YU Hui,E-mail:yuhui4756@sina.com.cn
Natural killer cells; Hepatitis C virus; Huh7.5 cells; Co-culture
上海市科委自然科学基金:12ZR1403500
1 复旦大学附属儿科医院感染科上海,201102;2 上海交通大学附属儿童医院消化科上海,200040
俞蕙,E-mail: yuhui4756@sina.com.cn
10.3969/j.issn.1673-5501.2016.04.010
2016-05-23
2016-08-06)

