亚砷酸钠抑制肝癌细胞增殖与PML蛋白表达*
王 伟,杨俊涛,刘宏鸣,袁 涛,刘孟刚,金世龙
(第三军医大学大坪医院野战外科研究所肝胆外科,重庆 400042)
·论著·
亚砷酸钠抑制肝癌细胞增殖与PML蛋白表达*
王伟,杨俊涛,刘宏鸣,袁涛,刘孟刚,金世龙△
(第三军医大学大坪医院野战外科研究所肝胆外科,重庆 400042)
目的研究亚砷酸钠抑制肝癌(HCC)细胞增殖是否与早幼粒细胞白血病(PML)蛋白表达有关。方法免疫组织化学法、免疫荧光、蛋白免疫印迹法(Western blot)和荧光定量PCR检测HCC组织PML蛋白及基因表达。结果免疫组织化学分析显示随机选择15例高分化、中度分化和低分化HCC组织和细胞均不同程度表达PML蛋白。Western blot 分析发现24例HCC组织、HuH7、HepG2、Hep3B、SMMC-7721和L02细胞均表达PML蛋白。免疫荧光提示HuH7、HepG2、Hep3B、SMMC-7721细胞核均有PML蛋白颗粒,其中HuH7和Hep3B细胞表达PML蛋白较HepG2、SMMC-7721细胞多。24例HCC组织,Hep3B、HepG2、SMCC-7721和HuH7细胞都表达PML基因。亚砷酸钠不仅可下调HuH7和原代HCC细胞表达PML蛋白,而且亚砷酸钠抑制HuH7,HepG2,Hep3B和SMMC-7721细胞生长,随着暴露时间延长亚砷酸钠对HCC细胞抑制作用增强。 结论HCC组织和细胞系普遍表达PML基因和蛋白,PML蛋白可能是砷剂直接靶向作用的分子基础。
肝肿瘤;白血病,早幼粒细胞,急性;亚砷酸盐类
肝癌(hepatocellular carcinoma,HCC)发病率居世界恶性肿瘤第5位,几乎45%的HCC病例源于中国,且与乙型和丙型肝炎病毒感染有关[1-2]。20世纪70年代,我国学者用三氧化二砷(As2O3)治疗急性早幼粒细胞白血病(acute promyelocytic leukaemia,APL)取得了世人瞩目的突破性进展;近年应用As2O3治疗实体肿瘤的实验和临床研究受到广泛重视,显示出其更为广范的应用前景[3-4]。虽然As2O3明显抑制HCC细胞增殖、诱导癌细胞凋亡,但As2O3对HepG2和SMCC-7721生长抑制分子机制仍不清楚。前期研究结果提示As2O3可下调HuH7细胞早幼粒细胞白血病(promyelocytic leukemia,PML)蛋白表达,诱导HCC干细胞分化[5];但是,仅仅知道HuH7细胞表达PML蛋白,HCC组织是否普遍表达PML基因及蛋白缺乏研究数据。砷剂治疗HCC是否与PML表达有关更不清楚,本文重点分析HCC组织和细胞PML蛋白表达及亚砷酸钠对HCC细胞PML蛋白表达的调节作用,建立砷剂治疗HCC与HCC细胞表达PML的联系。
1 资料与方法
1.1一般资料175例HCC组织于2012年1月至2013年6月取自西南医院、新桥医院和大坪医院HCC切除的患者。
1.2细胞与试剂HuH7、HepG2、Hep3B、L02、SMMC-7721细胞系由第三军医大学西南医院肝胆科和病理科赠送,其中L02为正常肝细胞,其余4种为HCC细胞,白血病细胞株HL60和NB4细胞由重庆医科大学生命科学研究院赠送。DMEM和胎牛血清(FBS)为Hyclone产品,RPMI-1640为IVD产品。总RNA提取试剂盒、cDNA逆转录试剂盒为BioFlux产品,Promega GoTaq qPCR Master Mix为Promega产品。PML抗体购自Abcam和Santa Cruz公司。激光共聚焦显微镜为LSM780。
1.3细胞培养HuH7、HepG2、Hep3B、L02和SMCC-7721细胞在含10% FBS的DMEM培养液,37 ℃、5% CO2、饱和湿度的培养箱孵育,细胞汇合度达到70%~80%时,0.25%胰酶消化细胞,收集细胞进行试验。HL60和NB4细胞在含10% FBS的 RPMI-1640培养液,37 ℃、5% CO2、饱和湿度的培养箱孵育,收集细胞提取蛋白。
1.4CCK-8法分析HCC生长抑制情况HCC细胞接种于96孔板,每孔加1.0×103个细胞,加入100 μL 10% FBS的DMEM培养基(每2天换液)使其贴壁生长。次日细胞贴壁后分别加入不同浓度亚砷酸钠(0.1、0.2、0.4、0.6、0.8、1.0 μg/mL)每种浓度设12个孔,设调零孔12个(不加细胞)和细胞对照孔12个(不加药物),在37 ℃、5% CO2、饱和湿度的培养箱中孵育48、72、96 h后吸出培养液。每孔分别加入90 μL DMEM培养基和10 μL CCK-8溶液,继续培养2 h,在酶标仪上测定450 nm吸光度值[A(450)]。
1.5Western blot分析HCC细胞和组织PML蛋白表达提取细胞和组织总蛋白。Western blot检测PML蛋白表达:配置10%分离胶和4%积层胶。上样量为每泳道90 μg蛋白,体积25~30 μL。电泳,积层胶电压80 V,分离胶电压100~120 V,电泳2~3 h。切胶后聚偏氟乙烯(PVDF)膜向正极,胶在负极,将滤纸、PVDF膜及凝胶整齐重叠后放在湿转槽、电流150 mA转移90 min。取下PVDF膜,5%脱脂奶粉封闭,室温震摇1~2 h。将封闭的膜滴加一抗按(1∶100),4 ℃湿盒内过夜,次日PBS漂洗15 min×1次,5 min×4次,二抗按(1∶2 500),25 ℃振摇1 h,PBS漂洗15 min×1次,5 min×4次。混合等体积A液和B液(各500 μL,共1 mL),将显色剂滴加到PVDF膜正面,开始显色记录图像。
1.6免疫组织化学检测HCC组织PML蛋白表达取低分化、中分化和高分化HCC组织标本各5例。石蜡包埋的肝组织做超薄切片,切片脱蜡至水,PBS 洗5 min×2次;甲醇-H2O2室温处理切片20 min,PBS洗5 min×3次;枸橼酸缓冲液微波中火修复5 min,PBS洗5 min×3次;滴加PML抗体,4 ℃过夜;PBS洗5 min×3次,滴加增敏剂,37 ℃孵育35 min;PBS洗5 min×3次,滴加二抗,37 ℃孵育35 min;PBS洗5 min×3次,DAB显色10 min,镜下观察显色情况;水洗终止显色后,苏木素衬染15~30 s;脱水、封片。镜下观察照相。结果判定:阴性对照不着色,DAB 染色呈棕黄色颗粒为表达阳性。
1.7免疫荧光分析HuH7、HepG2、Hep3B、SMMC-7721细胞PML蛋白表达HCC细胞普通培养在10 mm盖玻片上,待细胞融合度达60%~80%时,用37 ℃预热PBS清洗5 min×2次,4%多聚甲醛室温固定15 min,PBS洗5 min×2次,0.5% Triton-x 100的PBS室温下脱色摇床振摇15 min,PBS洗5 min×3次。取出盖玻片放至载玻片上,10%山羊血清37 ℃封闭30 min,PML抗体湿盒内4 ℃孵化过夜。PBS脱色洗5 min×3次,滴加荧光抗体,37 ℃避光孵育60 min。PBS清洗5 min×3次、Hoechst33342染色细胞核,PBS清洗5 min×2次,取出盖玻片,封片后激光共聚焦显微镜下观察记录细胞PML蛋白表达。
1.8实时定量PCR分析HCC细胞系和HCC组织PML基因表达(1)用Trizol 提取HCC组织(自175例HCC切除的样本中随机取24例,用于PML蛋白和基因表达分析)和细胞总RNA,检测RNA含量后立即置-130 ℃保存。(2)按BioKT cDNA Cirst strand cynthesis Kit使用说明设置20 μL体系,在室温10 min,42 ℃ 45 min,95 ℃ 5 min,冰浴5 min的循环条件进行反应。逆转录后检测cDNA含量,在-20 ℃保存。(3)GAPDH 引物:正向5′-TGC AAC CGG GAAGGA AAT GA-3′ ,反向5′-GCC CAA TAC GAC CAA ATC AGA-3′;PML引物:正向5′-GGC TCG AGA AGG ATG TGG TC-3′,反向5′-GAA GTG AGG GCT CCC ATA GC-3′。(4)荧光定量PCR:按Promega GoTaq qPCR Master Mix Kit说明,配制20 μL反应体系于STRATAGNE mx3000P荧光定量PCR仪进行反应。反应条件:预变性 95 ℃ 4 min;95 ℃ 30 s,55 ℃ 20 s,72 ℃ 20 s反应40个循环。扩增产物经3%琼脂糖凝胶进行鉴定。
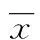

1~5:5例低分分化HCC;6~10:5例中分化HCC;11~15:5例高分化HCC。
图1高、中、低分化HCC组织PML蛋白表达(免疫组织化学×200)
2 结 果
2.1亚砷酸钠抑制HCC细胞生长本研究采用CCK-8法检测0.1~1.0 μg/mL亚砷酸钠处理HepG2、Hep3B、SMCC-7721和HuH7细胞48、72、96 h 生长抑制情况。结果显示0.2 μg/mL 亚砷酸钠显著抑制SMCC-7721细胞生长(P<0.05),0.4 μg/mL抑制其增殖能力更强(P<0.01)。0.4 μg/mL 亚砷酸钠明显抑制HepG2(P<0.01)和Hep3B(P<0.01)细胞增殖。0.1 ~0.4 μg/mL 亚砷酸钠刺激HuH7细胞增殖,但每两浓度梯度组间差异无统计学意义(P>0.05);0.8 μg/mL 亚砷酸钠抑制HuH7细胞增殖(P<0.01),低浓度亚砷酸钠刺激HuH7细胞增殖而高浓度抑制HuH7细胞增殖。亚砷酸钠抑制4种HCC细胞生长,随着暴露时间延长亚砷酸钠对HCC细胞抑制作用增强,0.4 μg/mL 亚砷酸钠可明显抑制HepG2、Hep3B和SMCC-7721细胞生长,0.8 μg/mL亚砷酸钠明显抑制HuH7细胞增殖,HuH7细胞耐受能力最强。

A:细胞;B:组织。
图2HCC组织和细胞表达PML蛋白

A:24例HCC组织PML基因表达; B:4种HCC细胞PML基因表达。
图3HuH7、HepG2、Hep3B、SMMC-7721和HCC组织PML基因及蛋白表达
2.2HCC组织表达PML蛋白自免疫组织化学分析结果显示,HCC细胞核、细胞质有不同程度表达PML,细胞质分布不均匀。低分化、中分化和高分化HCC组织均表达PML蛋白(图1),而且不同分化程度HCC组织PML蛋白表达差异无统计学意义。
2.3Western blot分析HCC组织和细胞系PML蛋白结果为了确定HCC细胞是否表达PML蛋白,排除假阳性结果,用白血病NB4和HL60细胞做阳性对照,人正常肝细胞系L02为正常对照,Western blot分析HCC组织及细胞PML蛋白表达。结果显示HuH7,HepG2,Hep3B,SMMC-7721和L02细胞均表达PML蛋白,见图2A。24例HCC组织不同程度表达PML蛋白,见图2B。

图4 免疫荧光分析4种HCC细胞PML蛋白表达

A:Western blot;B:免疫荧光图(×200)。
图5亚砷酸钠下调HuH7和原代HCC细胞PML蛋白表达
2.4荧光定量PCR分析HCC组织和细胞均有PML基因表达24例HCC组织(图3A),Hep3B,HepG2,SMCC-7721和HuH7细胞都表达PML基因(图3B)。
2.5免疫荧光分析HCC细胞系PML蛋白表达结果HuH7、HepG2、Hep3B和SMMC-7721细胞核均有PML蛋白颗粒,其中HuH7和Hep3B细胞荧光强度强于HepG2、SMMC-7721细胞,见图4。
2.6亚砷酸钠下调HCC细胞PML蛋白表达本研究用含0.5 μg/mL亚砷酸钠处理HuH7和原代HCC细胞5 d,检测HCC细胞PML蛋白表达变化。Western blot分析结果显示亚砷酸钠处理后HuH7和原代HCC细胞PML蛋白表达下调(图5A),免疫荧光分析发现HuH7细胞核PML蛋白荧光颗粒明显减少(图5B),提示亚砷酸钠直接下调HuH7和原代HCC细胞PML蛋白表达。
3 讨 论
As2O3是剧毒中药砒霜的主要成分, As2O3对急性早幼粒细胞白血病(APL)的治愈率达到95%。Zhang等[6]研究发现APL 细胞PML-RAR融合蛋白和PML蛋白RBCC锌指结构域半胱氨酸残基与砷结合,使PML聚合后与SUMO和UBC9结合,导致SUMO泛素化增强和PML及PML-RAR蛋白降解,阐明了As2O3降解PML-RAR和PML蛋白清除APL细胞的分子机制。研究显示,砷与邻近半胱氨酸结合,增加活性氧(reactive oxygen species,ROS)产生,后者使PML分子间形成二硫化合物,再与Arsenic直接结合,形成与PML核体(PML-nuclear bodys,PML-NBs)有关的PML多聚体,进而多聚体泛素化降解,PML-NBs随之解体,PML-NBs上的多种核转录因子失去发挥功能平台,诱导HCC干细胞分化[7-10]。Maroui等[11]研究证实As2O3诱发细胞核PML蛋白降解,参与了细胞增殖和分化。
前期结果显示As2O3具有明显抑制HCC增殖、细胞周期阻滞和诱导癌细胞凋亡的作用,然而,其具体分子途径不清楚,也未将As2O3与PML蛋白表达联系起来,尤其忽略了As2O3治疗APL在于砷直接与癌蛋白PML-RAR结合,使癌蛋白降解后APL细胞死亡的分子机制。过去砷剂治疗HCC的临床和基础研究存在4个缺陷:(1)认定HCC细胞不表达PML基因及蛋白;(2)不清楚砷剂抑制HCC细胞生长的分子机制;(3)As2O3治疗HCC是否也通过PML蛋白,缺乏相应研究;(4)甚至有研究者先在HCC细胞转染PML基因,表达PML蛋白后,再用As2O3处理HCC细胞[12]。为探索As2O3治疗HCC的分子途径,在前期研究的基础上,作者假设HCC组织及细胞株可能普遍表达PML基因及蛋白。本组从175例HCC切除患者标本中随机选15例HCC组织(高分化5例、中分化5例和低分化5例)进行免疫组织化学分析,结果发现15例HCC组织不同程度表达PML蛋白(图1)。Western blot分析24例HCC组织,结果24例HCC组织均不同程度表达PML蛋白,且各例HCC的PML蛋白表达量不尽相同(图2B)。为了排除假阳性,用急性白血病细胞株NB4及HL60细胞做阳性对照,L02细胞做正常对照,Western blot分析显示,HepG2、HuH7、Hep3B、SMMC-7721均表达PML蛋白(图2A)。免疫荧光分析显示HuH7、HepG2、Hep3B、SMMC-7721细胞核均有PML蛋白颗粒,其中HuH7和Hep3B细胞表达PML蛋白较HepG2、SMMC-7721细胞多(图4)。荧光定量PCR分析结果显示24例HCC组织,Hep3B、HepG2、SMCC-7721和HuH7细胞都表达PML基因,在HCC细胞中Hep3B细胞PML基因表达较高。以上结果证实HCC组织及细胞株可能普遍表达PML基因及蛋白,否定此前实体癌细胞不表达PML蛋白的观点。而且,前期用0.25 μg/mL As2O3处理HuH7细胞和本实验用0.50 μg/mL亚砷酸钠处理可直接下调HuH7和原代HCC细胞表达PML蛋白,这些结果首次证实HCC组织和细胞系普遍表达PML基因和蛋白,建立As2O3或亚砷酸钠治疗HCC与PML蛋白表达的联系。
本研究结果显示亚砷酸钠总体抑制HepG2、HuH7、Hep3B、SMMC-7721等4种HCC细胞生长,随着暴露时间延长亚砷酸钠对HCC细胞抑制作用增强;但是,很低浓度亚砷酸钠就可抑制HepG2、Hep3B、SMMC-7721细胞增殖,较高浓度亚砷酸钠才可以抑制HuH7细胞增殖,HuH7细胞对亚砷酸钠双向反应。随着亚砷酸钠处理时间延长,HCC细胞PML蛋白逐渐减少,直至消失,HCC细胞表现出生长抑制,本结果提示亚砷酸钠对HCC抑制与PML蛋白表达有关。前期研究观察到,As2O3不仅显著下调HuH7细胞PML蛋白表达,而且还可以增加对化学治疗药物的敏感性和抑制HuH7细胞形成肿瘤球能力,As2O3可能诱导CD13+CD133+LCSCs分化,清除LCSCs,达到治愈HCC的目的[6]。依据砷剂治疗APL的分子机制和本组观察结果,作者认为As2O3或亚砷酸钠抑制HCC细胞增殖与HCC细胞表达PML蛋白有密切关系。
[1]Llovet JM,Burroughs A,Bruix J. Hepatocellular carcinoma[J].Lancet,2003,362(9399):1907-1917.
[2]Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].JAMA,2013,310(9):982.
[3]刘佳,张大方,李超英.三氧化二砷的抗肝癌作用研究[J].长春中医药大学学报,2008,24(3):252-253.
[4]刘小敏,梁晓秋,张杨,等.三氧化二砷对人肝癌HepG2细胞内活性氧水平的影响[J].肿瘤学杂志,2009,15(3):229-231.
[5]金世龙,余天雾,黄中荣,等.As2O3在HuH7及CD13+CD133+LCSCs增殖和分化中作用的初步观察[J].第三军医大学学报,2012,34(18):1857-1861.
[6]Zhang XW,Yan XJ,Zhou ZR,et al.Arsenic trioxide controls the fate of the PML-RARalpha oncoprotein by directly binding PML[J].Science,2010,328(5975):240-243.
[7]Jeanne M,Lallemand-Breitenbach V,Ferhi O,et al.PML/RARA oxidation and Arsenic binding initiate the antileukemia response of As2O3[J].Cancer Cell,2010,18(1):88-98.
[8]Nakahara F,Weiss CN,Ito K.The role of PML in hematopoietic and leukemic stem cell maintenance[J].Int J Hematol,2014,100(1):18-26.
[9]Ito K,Bernardi R,Morotti A,et al.PML targeting eradicates quiescent leukaemia-initiating cells[J].Nature,2008,453(7198):1072-1078.
[10]Chang FT,McGhie JD,Chan FL,et al.Wong.PML bodies provide an important platform for the maintenance of telomeric chromatin integrity in embryonic stem cells[J].Nucleic Acids Res,2013,41(8):4447-4458.
[11]Maroui MA,Kheddache-Atmane S,El Asmi F,et al.Requirement of PML SUMO interacting motif for RNF4- or Arsenic trioxide-induced degradation of nuclear PML isoforms[J].PLoS One,2012,7(9):e44949.
[12]Cui L,Zhang S,Zhang W,et al.Arsenic trioxide and promyelocytic leukemia protein-adenovirus synergistically inhibit in vitro and in vivo growth of a hepatoma cell line[J].Oncol Res,2010,18(7):305-314.
Sodium arsenite inhibiting proliferation of hepatoceullar carcinoma cells and expression of promyelocytic leukemia protein*
WangWei,YangJuntao,LiuHongming,YuanTao,LiuMenggang,JinShilong△
(DepartmentofHepatobiliarySurgery,FieldSurgeryResearchInstituteofDapingHospital,ThirdMilitaryMedicalUniversity,Chongqing400042,China)
ObjectiveTo investigate whether the sodium arsenite inhibiting proliferation of hepatocellar carcinoma(HCC) cells and having a relation with the expression of promyelocytic leukemia (PML) protein.MethodsThe immunohistochemistry,Western blot analysis,immunofluorescence assay and quantitative PCR were used to examine the PML gene and protein expression in HCC tissue and cells.ResultsThe immunohis to chemical staining showed that the PML protein was expressed in nucleus of well-differentiated,moderately differentiated and poorly differentiated HCC tissues randomly selected from 15 cases of HCC undergoing hepatic resection.Western blot analysis showed that PML protein was expressed at varying levels in all 24 HCC tissue samples,HuH7,HepG2,Hep3B,SMMC-7721 and L02 cells.The immunofluorescence assay demonstrated that PML protein grains were found in the nucleis of the HuH7,HepG2,Hep3B and SMCC-7721 cells,in which HuH7 and Hep3B expressed more PML proteins than HepG2 and SMMC-7721 cells.24 HCC tissue samples,Hep3B,HepG2,SMCC-7721 and HuH7 cells all expressed PML gene.Sodium arsenite not only down-regulated the PML protein expressed in HuH7 and primary HCC cells,but also inhibited the HCC cell growth of HepG2,Hep3B,HuH7 and SMMC-7721,with the exposure time extension,the inhibiting effect of sodium arsenite on HCC cells was enhanced.ConclusionBoth HCC cell lines and tissues generally express ther PML protein and gene,PML protein may serve as the molecular basis for the direct targeting effects of arsenical agents.
liver neoplasms;leukemia,promyelocytic,acute;arsenites
10.3969/j.issn.1671-8348.2016.12.003
重庆市卫生和计划生育委员会局会中医药科技项目资助(ZY20132047)。作者简介:王伟(1981-),主治医师,本科,主要从事肝胆外科疾病临床研究。△
,E-mail:Shilongjin828@sina.com。
R735.7
A
1671-8348(2016)12-1591-04
2015-12-28
2016-01-26)

