革兰阴性杆菌血流感染的病原菌分布、耐药性及碳青霉烯酶基因的检测与分析
邹 颖, 徐晓刚, 郭庆兰, 李光辉
·论著·
革兰阴性杆菌血流感染的病原菌分布、耐药性及碳青霉烯酶基因的检测与分析
邹 颖1,2, 徐晓刚1, 郭庆兰1, 李光辉1
目的 调查复旦大学附属华山医院革兰阴性杆菌血流感染的病原菌分布情况、对常用抗菌药物的耐药性以及碳青霉烯酶基因的流行现状。方法 收集2012年3月1日—2013年2月28日该院血流感染分离获得的132株非重复革兰阴性杆菌菌株,按统一方案采用纸片扩散法进行抗菌药物敏感性试验,共筛选出33株碳青霉烯类不敏感菌株。采用PCR方法检测KPC、NDM、VIM、IMP、GIM、SPM、OXA23、OXA24、OXA51、OXA58型碳青霉烯酶基因。结果 革兰阴性杆菌血流感染前5位的病原菌依次为克雷伯菌属(28.0%,37/132)、大肠埃希菌(26.5%,35/132)、不动杆菌属(13.6%,18/132)、铜绿假单胞菌(9.8%,13/132)和肠杆菌属(7.6%,10/132)。33株碳青霉烯类不敏感革兰阴性杆菌中有75.8%(25/33)的菌株检测出碳青霉烯酶基因,KPC、OXA23、OXA51、NDM型碳青霉烯酶基因检出率分别为42.4%(14/33)、30.3%(10/33)、30.3%(10/33)、3.0%(1/33),未检测到其他类型碳青霉烯酶基因。13株对碳青霉烯类药物不敏感的肺炎克雷伯菌100%携带KPC型耐药基因,10株对碳青霉烯类药物不敏感的鲍曼不动杆菌100%携带OXA23、OXA51型基因。结论 革兰阴性杆菌血流感染中肺炎克雷伯菌、鲍曼不动杆菌对碳青霉烯类抗生素耐药形势严峻。携带KPC、OXA23型碳青霉烯酶基因是导致肺炎克雷伯菌和鲍曼不动杆菌对碳青霉烯类抗生素耐药的主要机制之一。
血流感染; 碳青霉烯酶; 金属β内酰胺酶; 碳青霉烯酶基因
1 材料与方法
1.1 革兰阴性杆菌血流感染诊断标准
血培养分离出革兰阴性杆菌,并伴有下列症状或体征中的一项:①发热>38℃或低体温<36℃,可伴有寒颤;②有入侵门户或迁徙病灶;③有全身感染中毒症状而无明确感染灶;④收缩压低于90 mmHg,或较原收缩压下降超过40 mmHg。回顾性调查血标本分离出革兰阴性杆菌患者的病史资料,所有患者均符合血流感染诊断标准。
1.2 菌株分离、培养、鉴定及药敏试验
菌株来自复旦大学附属华山医院2012年3月1日—2013年2月28日送检的血液标本,按医院常规方法进行细菌分离、培养、鉴定。剔除同一患者同一次发病重复分离的菌株,共获得132株革兰阴性杆菌。全部菌株经法国生物梅里埃公司产品VITEK 2-Compact或API 20系列鉴定。标准菌株为大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC 27853。采用纸片扩散法测定菌株对常用抗菌药物的敏感性,结果按美国临床和实验室标准化协会(CLSI) 2012年标准判读。头孢哌酮-舒巴坦判断标准参照文献[2]。药敏试验结果对亚胺培南、美罗培南、多立培南任一碳青霉烯类为中介或耐药即判定为碳青霉烯类不敏感菌株。
1.3 碳青霉烯酶基因的检测与分析
1.3.1 DNA提取 挑取1~2个菌落细菌加入500 μL TE(pH 8.0)溶液中混匀,100 ℃煮沸10 min后放入4 ℃冰箱,冷却后5 000 r/min离心1 min,收集上清液作为细菌DNA模板。
1.3.2 耐药基因扩增 KPC、NDM、IMP、VIM、 GIM、SPM型碳青霉烯酶基因采用PCR方法扩增(PCR仪为美国ABI公司产品,ABI 9600型)。反应总体积50 μL,其中10×buffer 5 μL,dNTP 4 μL,Taq酶0.25 μL(TaKaRa公司),上下游引物各1 μL(20 μmol/L),模板DNA 4 μL,ddH2O补足至50 μL。KPC、NDM、IMP、VIM引物应用DNAstar 7.1软件自行设计。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,共35个循环,最后72 ℃延伸6 min。GIM、SPM引物序列及PCR反应条件参照文献[3-4]。OXA23、OXA24、OXA51、OXA58型碳青霉烯酶基因采用多重PCR方法进行扩增,引物序列及PCR反应条件参照文献[5],反应总体积50 μL,其中10×buffer 5 μL,dNTP 4 μL,Taq 酶0.25 μL,每条引物各0.5 μL(20 μmol/L),模板DNA 3 μL,ddH2O补足至50 μL。各型碳青霉烯酶基因引物序列见表1,由生工生物(上海)有限公司合成。

表1 碳青霉烯酶基因引物序列及片段大小Table 1 Primer sequences and fragment length of carbapenem resistance genes

表1(续)Table 1(continued)
1.3.3 PCR产物分析 取5 μL PCR扩增产物与6×上样缓冲液1 μL混匀,经1.2%琼脂糖凝胶以120V电泳35 min,溴乙锭染色20 min,流水漂洗,最后在凝胶成像分析系统(美国Bio-Rad公司产品)上观察结果。采用DNA Marker DL2000为分子量标准,出现目的条带者判定为阳性。取阳性结果PCR产物送生工生物(上海)有限公司测序,测序结果与GenBank中的核苷酸序列进行同源性比对。
2 结果
2.1 病原菌分布
2012年3月—2013月2月复旦大学附属华山医院共发生132例革兰阴性杆菌血流感染,血培养分离获得革兰阴性杆菌132株。病原菌分布前5位依次为克雷伯菌属(28.0%,37/132,其中肺炎克雷伯菌36株,占97.3%)、大肠埃希菌(26.5%,35/132)、不动杆菌属(13.6%,18/132,其中鲍曼不动杆菌16株)、铜绿假单胞菌(9.8%,13/132)、肠杆菌属(7.6%,10/132,其中阴沟肠杆菌6株),见表2。
2.2 药敏试验结果
前5位病原菌对常用抗菌药物的敏感率见表3。132株革兰阴性杆菌中肠杆菌科细菌、铜绿假单胞菌、不动杆菌属对碳青霉烯类的敏感率分别为81.3%(74/91)、92.3%(12/13)、38.9%(7/18)。克雷伯菌属对碳青霉烯类的敏感率(62.2%)显著低于大肠埃希菌(97.1%~100%)和肠杆菌属细菌(80.0%~100%);对第三、第四代头孢菌素的敏感率(46.0%~51.4%)高于大肠埃希菌(22.9%~42.9%);对头孢哌酮-舒巴坦和哌拉西林-他唑巴坦的敏感率均在50%以上。大肠埃希菌对哌拉西林-他唑巴坦的敏感率达74.3%;克雷伯菌属对氨基糖苷类的敏感率为51.4%~62.2%,而大肠埃希菌为45.7%~80.0%;克雷伯菌属对环丙沙星的敏感率虽显著高于大肠埃希菌,但均不足半数(48.6%比28.6%)。肠杆菌属细菌对头孢吡肟、碳青霉烯类、氨基糖苷类和喹诺酮类均高度敏感,敏感率为80.0%~100%。不动杆菌属对碳青霉烯类的敏感率(38.9%)显著低于铜绿假单胞菌(92.3%)。不动杆菌属对所有受试药物的敏感率均未超过50%。铜绿假单胞菌对常用受试药物的敏感率为84.6%~92.3%,但对头孢哌酮和氨曲南仅分别为53.8%和69.2%。

表2 血培养分离132株革兰阴性杆菌的分布Table 2 Distribution of 132 strains of gram negative bacteria isolated from blood samples
33株对碳青霉烯类不敏感菌株中克雷伯菌属占42.4%(14/33,其中肺炎克雷伯菌13株)、不动杆菌属占33.3%(11/33,其中鲍曼不动杆菌10株)、肠杆菌属占6.1%(2/33),其余为大肠埃希菌、铜绿假单胞菌、嗜水气单胞菌、嗜麦芽窄食单胞菌、摩根摩根菌、洋葱伯克霍尔德菌各1株。碳青霉烯类不敏感克雷伯菌属对甲氧苄啶-磺胺甲唑的敏感率为57.1%,对环丙沙星和阿米卡星的敏感率为7.1%,对其他受试药物均耐药。碳青霉烯类不敏感不动杆菌属对阿米卡星、庆大霉素、环丙沙星、头孢哌酮-舒巴坦、甲氧苄啶-磺胺甲唑的敏感率为9.1%~18.2%,对其他受试药物均耐药,见表4。
2.3 碳青霉烯类不敏感菌株科室分布
33株碳青霉烯类不敏感菌株主要分布在综合ICU(10株)、神经外科ICU(7株)、神经外科急救病房(4株),其余分布在感染科(2株)、皮肤科(2株)、血液科(2株)、神经内科(2株)、神经外科(2株)、普外科(1株)和急诊内科(1株)。

表3 血标本分离前5位革兰阴性杆菌对常用抗菌药物的敏感率Table 3 Susceptibility of the top five gram negative bacterial species to selected antimicrobial agents (%)
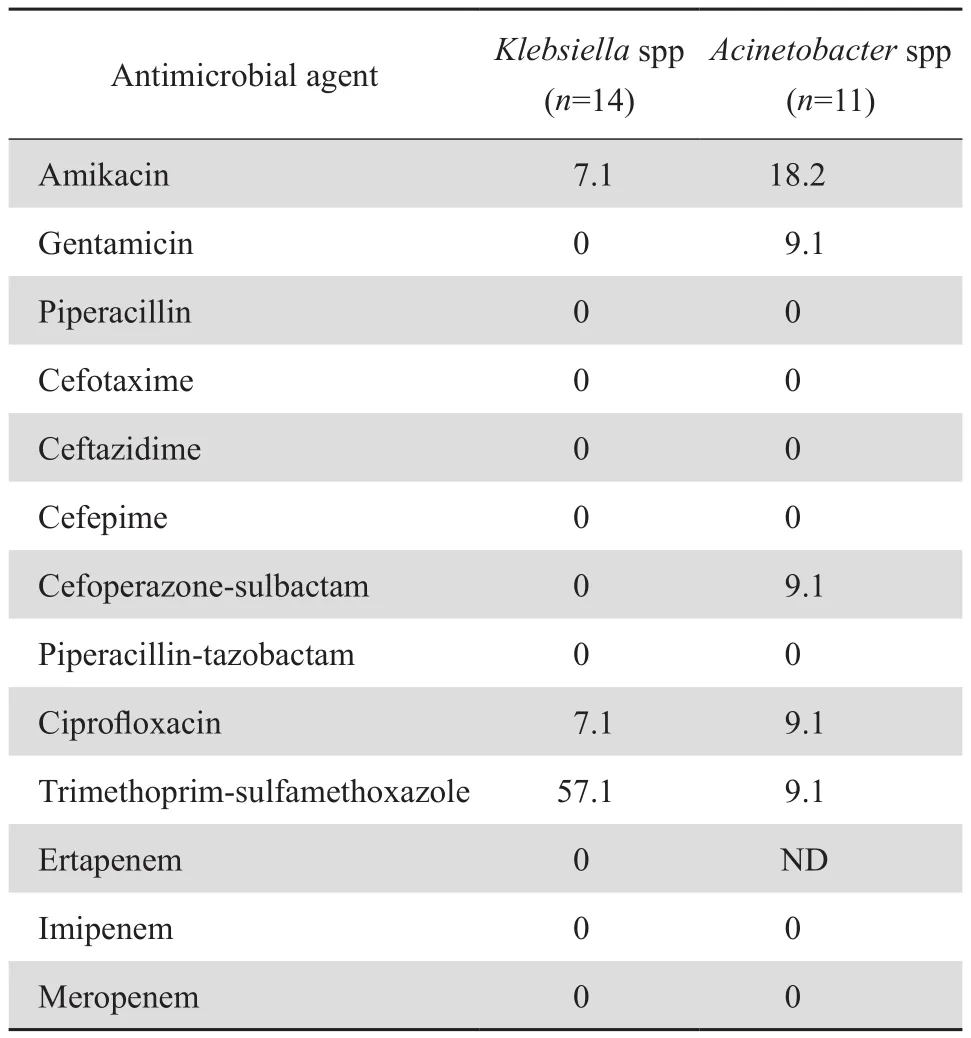
表4 25株碳青霉烯类不敏感克雷伯菌属和不动杆菌属菌株对常用抗菌药物的敏感率Table 4 Susceptibility of 25 carbapenem-nonsusceptible strains to selected antimicrobial agents(%)
2.4 碳青霉烯酶基因检测
33株对碳青霉烯类不敏感革兰阴性杆菌中有75.8%(25/33)菌株检测出碳青霉烯酶基因。KPC、OXA23、OXA51、NDM型碳青霉烯酶基因检出率分别为42.4%(14/33)、30.3%(10/33)、30.3%(10/33)、3.0%(1/33),未检测到其他类型碳青霉烯酶基因。13株对碳青霉烯类不敏感的肺炎克雷伯菌100%携带KPC型基因,10株对碳青霉烯类不敏感的鲍曼不动杆菌100%携带OXA23、OXA51型基因。不同菌株碳青霉烯酶基因携带情况见表5。KPC、NDM、OXA23、OXA51型基因扩增产物电泳图见图1~3。

表5 33株对碳青霉烯类不敏感菌株碳青霉烯酶基因携带情况Table 5 Detection of carbapenem resistance genes from 33 carbapenem-nonsusceptible strains

图1 KPC型碳青霉烯酶扩增产物电泳图(目的片段:334 bp)Figure 1 Electrophoretic pattern of KPC type carbapenemase gene amplified by PCR (target fragment size: 334 bp)

图2 NDM型碳青霉烯酶扩增产物电泳图(目的片段:386 bp)Figure 2 Electrophoretic pattern of NDM type carbapenemase gene amplified by PCR (target fragment size: 386 bp)
3 讨论
血流感染是常见的严重卫生保健相关感染[6],其中由革兰阴性杆菌引起的感染占有相当重要的地位。依据2012年CHINET监测数据,革兰阴性杆菌在血标本分离菌中占44.0%[7]。虽然凝固酶阴性葡萄球菌是血液最常分离到的细菌,但相当一部分可能为污染,而血培养分离到肠杆菌科细菌、不发酵糖革兰阴性杆菌往往具有诊断意义。

图3 OXA23、OXA51型碳青霉烯酶扩增产物电泳图(OXA23、OXA51目的片段大小分别为:501 bp、353 bp)Figure 3 Electrophoretic pattern of OXA type carbapenemase gene amplified by multiplex PCR (target fragment size of OXA23 and OXA51 genes: 501 bp and 353 bp)
本研究中革兰阴性杆菌血流感染占前5位的病原菌依次为克雷伯菌属、大肠埃希菌、不动杆菌属、铜绿假单胞菌和肠杆菌属细菌,与历年来CHINET血标本监测数据中前5位的病原菌基本一致,唯排位顺序略有不同,克雷伯菌属取代大肠埃希菌居第1位,两者所占比例非常接近。从耐药率方面来看,克雷伯菌属和大肠埃希菌对第三、第四代头孢菌素敏感率偏低,尤其是大肠埃希菌敏感率均低于50%,提示产ESBL菌株可能占有相当比例。大肠埃希菌对碳青霉烯类仍保持高度敏感,所有35株大肠埃希菌中仅1株对厄他培南药敏试验结果为中介,对美罗培南和亚胺培南仍为敏感。因此,临床对于怀疑由大肠埃希菌导致的血流感染可在知道药敏结果之前经验性选择碳青霉烯类。相比之下,克雷伯菌属对碳青霉烯类的耐药性明显高于大肠埃希菌。所有37株克雷伯菌属中有36株为肺炎克雷伯菌,超过1/3肺炎克雷伯菌(36.1%,13/36)对临床常用3种碳青霉烯类呈现高度耐药,且这13株耐碳青霉烯类菌株除了对甲氧苄啶-磺胺甲唑敏感率略高外,对其余9种常用的抗菌药物敏感率均不足10%,一旦感染临床几乎无药可选,耐药形势极为严峻。
另一个在病原菌组成中占相当比例且耐药情况极为严重的革兰阴性杆菌为不动杆菌属。18株不动杆菌属菌株对全部12种受试药物的敏感率均未超过50%,61.1%(11/18)菌株对碳青霉烯类不敏感,且这11株菌株对其余受试药物的敏感率也相当低,敏感率最高的阿米卡星也仅为18.2%,成为多重耐药革兰阴性杆菌的主要菌种之一。
从临床科室分布情况来看,对碳青霉烯类不敏感菌株有集中分布的趋势。综合ICU、神经外科ICU、神经外科急救病房3个科室共分离出21株耐药菌株,占总数的63.6%(21/33),因此不能排除存在多重耐药菌株医院内播散可能,可通过菌株同源性检测进一步验证。
碳青霉烯类治疗产ESBL革兰阴性杆菌引起的感染往往能取得令人满意的疗效,因此被认为是临床上针对多重耐药革兰阴性杆菌最有效的抗菌药物之一。然而,随着碳青霉烯类的广泛应用以及存在一些不规范使用乃至滥用的情况,近年来国内外细菌耐药性监测数据提示耐碳青霉烯类的革兰阴性杆菌比例不断上升。CHINET监测数据表明肺炎克雷伯菌对亚胺培南和美罗培南的耐药率分别从2005年的0.9%、1.3%升至2013年的10.5%、13.5%;同期鲍曼不动杆菌对碳青霉烯类抗生素的耐药率也从30%~40%升至60%左右[8-9]。英国抗菌药物耐药监测数据显示2010年产碳青霉烯酶细菌的数量较2003年增加了近300倍[10]。本研究中血液标本分离肺炎克雷伯菌对亚胺培南、美罗培南的耐药率均为36.1%(13/36),而鲍曼不动杆菌这一数据高达62.5%(10/16),以肺炎克雷伯菌、鲍曼不动杆菌为代表的革兰阴性杆菌对碳青霉烯类耐药性逐年上升已是不争的事实。
导致对碳青霉烯类耐药的重要原因之一是耐药菌株产生β内酰胺酶,它能水解碳青霉烯类药物,因而被称为碳青霉烯酶。KPC型、OXA型以及新近发现的以NDM型为代表的金属酶是其中最重要的分型[11-13]。本研究中33株对碳青霉烯类不敏感的革兰阴性杆菌中有75.8%(25/33)菌株检测出碳青霉烯酶基因,KPC、OXA23、OXA51、NDM型碳青霉烯酶基因检出率分别为42.4%(14/33)、30.3%(10/33)、30.3%(10/33)、3.0%(1/33)。KPC型、OXA23、OXA51型碳青霉烯酶基因集中分布于特定菌种,且在这些耐碳青霉烯类菌株中占据相当比例。本研究中除1株产酸克雷伯菌产KPC型碳青霉烯酶外,其他13株携带KPC型、10株携带OXA23、OXA51型碳青霉烯酶基因菌株均分布于肺炎克雷伯菌和鲍曼不动杆菌。13株碳青霉烯类不敏感的肺炎克雷伯菌均携带KPC型基因,10株碳青霉烯类不敏感的鲍曼不动杆菌全部携带OXA23、OXA51型基因。OXA51型基因普遍存在于鲍曼不动杆菌染色体中,对碳青霉烯类水解能力较弱,通常情况下并不表达活性[14]。近年研究表明,OXA23型基因与鲍曼不动杆菌对碳青霉烯类的耐药性密切相关。本研究提示携带KPC及OXA23型碳青霉烯酶基因是导致肺炎克雷伯菌和鲍曼不动杆菌对碳青霉烯类耐药的主要机制之一。
近年来临床分离到耐碳青霉烯类的铜绿假单胞菌逐年增多,其中产金属β内酰胺酶菌株成为耐药机制研究中的热点[15-16]。IMP、VIM、GIM、SPM型金属酶是耐碳青霉烯类铜绿假单胞菌中最常分离到的亚型[17]。本研究中共分离出13株铜绿假单胞菌,仅1株菌株药敏试验显示对碳青霉烯类不敏感,均未检测到上述4个亚型的金属酶。2009年在印度新德里1株肺炎克雷伯菌中分离到一种新的金属β内酰胺酶,它能水解除氨曲南以外所有β内酰胺类,包括碳青霉烯类,被命名为新德里I型金属β内酰胺酶(New Delhi Metalloβ-Lactamase, NDM-1)[18]。此后世界各地不断有产NDM-1酶菌株感染的病例报道,涉及菌种不仅有肺炎克雷伯菌,亦有大肠埃希菌、阴沟肠杆菌、弗劳地枸橼酸杆菌等其他肠杆菌科细菌,同时在鲍曼不动杆菌、铜绿假单胞菌等不发酵糖革兰阴性杆菌中检出更多[19],它的出现再次给全世界敲响了细菌耐药的警钟。NDM型碳青霉烯酶基因可以通过质粒转移到其他细菌DNA,本研究中发现1株产NDM型基因碳青霉烯酶的洛菲不动杆菌,提示NDM型基因碳青霉烯酶在不同菌种之间存在进一步的扩散趋势。
本研究中耐碳青霉烯类革兰阴性杆菌对临床常用的其他抗菌药物也有相当高的耐药率,由这些耐药菌导致的血流感染往往是致命的。虽然替加环素、多黏菌素等对耐药菌株有较好的抗菌活性,临床也可尝试联合用药来提高疗效[20],但是替加环素血药浓度偏低,不宜用于血流感染患者,多黏菌素有显著的肾毒性、神经毒性,联合用药会产生不良反应及费用增加等一系列问题,实际应用受到不少限制,疗效也未必令人满意。因此加强医院内病原菌菌种谱和耐药性监测,进行耐药基因筛查及耐药菌株同源性分析,为医院感染的防控提供流行病学依据十分必要。医务人员应重视本地区耐碳青霉烯类革兰阴性杆菌的分布情况,合理选择抗菌药物,加强医院感染防控从而延缓细菌耐药性的发展。
[1]RODRIGUEZ-CREIXEMS M, ALCALA L, MUNOZ P,et al. Bloodstream infections: evolution and trends in the microbiology workload, incidence, and etiology, 1985-2006.[J]. Medicine(Baltimore),2008,87(4):234-249.
[2]BARRY AL, JONES RN. Criteria for disk susceptibility tests and quality control guidelines for the cefoperazone-sulbactam combination[J]. J Clin Microbiol,1988,26(1):13-17.
[3]DONG F, XU XW, SONG WQ, et al. Characterization of multidrug-resistant and metallo-beta-lactamase-producing Pseudomonas aeruginosa isolates from a paediatric clinic in China[J]. Chin Med J,2008,121(17):1611-1616.
[4]SHIBATA N, DOI Y, YAMANE K, et al. PCR typing of genetic determinants for metallo-β-lactamases and integrases carried by gram-negative bacteria isolated in Japan, with focus on the class 3 integron[J]. J Clin Microbiol,2004,41(12):5407-5413.
[5]WOODFORD N, ELLINGTON MJ, COELHO JM. Multiplex PCR for genes encoding prevalent OXA carbapenemases in Acinetobacter spp.[J]. Antimicrob Agents,2006,27(4):351-353.
[6]DIEKEMA DJ, BEEKMANN SE, CHAPIN KC, et al. Epidemiology and outcome of nosocomial and community-onset bloodstream infection[J]. Clin Microbiol, 2003,41(8):3655-3660.
[7]李光辉, 朱德妹, 汪复,等. 2012年中国CHINET血培养临床分离菌的分布及耐药性[J]. 中国感染与化疗杂志, 2014,14(6):474-481.
[8]汪复. 2005年中国CHINET细菌耐药性监测结果[J]. 中国感染与化疗杂志, 2006,6(5):289-295.
[9]胡付品, 朱德妹, 汪复,等. 2013年中国CHINET细菌耐药监测[J]. 中国感染与化疗杂志,2014,14(5):369-378.
[10]Health Protection Agency. Guidance on carbapenem resistance producers[EB/OL]. 2011-01-28[2015-01-28]. http://www. hpa.org.uk/web//HPAweb&Page&HPAwebAutoListName/ Page/1294740725255.
[11]POIREL L, PITOUT JD, NORDMANN P, et al. Carbapenemases:molecular diversity and clinical consequences[J]. Future Microbiol,2007,2(2):501-512.
[12]YIGIT H, QUEENAN AM, ANDERSON GJ, et al. Novel carbapenem-hydrolyzing beta-lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella pneumoniae[J]. Antimicrob Agents Chemother,2001,45(4):1151-1161.
[13]WALSH TR. Emerging carbapenemases: a global perspective[J]. Int J Antimicrob Agents,2010,11,36 Suppl 3:s8-s14.
[14]WALTHER-RASMUSSEN J, HØIBY N. OXA-type carbapenemases[J]. J Antimicrob Chemother,2006,57(3):373-383.
[15]LEE MF, PENG CF, HSU HJ, et al. Molecular characterization of the metallo-beta-lactamase genes in imipenem-resistant Gram-negative bacteria from a university hospital in southern Taiwan[J]. Int J Antimicrob Agents,2008,32(6):475-480.
[16]ROSSOLINI GM, LUZZARO F, MIGLIAVACCA R, et al. First countrywide survey of acquired metallo-beta-lactamases in gram-negative pathogens in Italy[J]. Antimicrob Agents Chemother,2008,52(11):4023-4029.
[17]WALSH TR, TOLEMAN MA, POIREI L, et al. Metallo-betalactamases: the quiet before the storm? [J]. Clin Microbiol Rev,2005,18(2):306-325.
[18]KUMARASAMY KK, TOLEMAN MA, WALSH TR,et al. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study[J]. Lancet Infect Dis,2010,10(9):597-602.
[19]BHASKAR E. Clinical correlates of New Delhi metallo-beta lactamase isolates—a survey of published literature[J]. Indian J Med Res,2012,136(6):1054-1059.
[20]LIVERMORE DM. Has the era of untreatable infection arrived? [J]. J Antimicrob Chemother,2009,64 Suppl 1:i29-i36.
Distribution, antibiotic resistance and production of carbapenemases in gramnegative bacteria isolated from blood samples
ZOU Ying, XU Xiaogang, GUO Qinglan, LI Guanghui. (Institute of Antibiotics, Huashan Hospital, Fudan University, Key Laboratory of Clinical Pharmacology of Antibiotics, Ministry of Health, Shanghai 200040,China)
Objective To investigate the distribution, antibiotic resistance and prevalence of carbapenemases genes in gramnegative bacteria isolated from blood samples in Huashan Hospital. Methods Antimicrobial susceptibility testing was carried out according to a unified protocol using Kirby-Bauer method for 132 strains of gram-negative bacteria isolated from March 2012 to February 2013. KPC, NDM, VIM, IMP, GIM, SPM, OXA23, OXA24, OXA51 and OXA58 type carbapenemases genes were identified in 33 carbapenem-nonsusceptible strains by using PCR method. Results The top five bacterial species were Klebsiella spp. (28.0%, 37/132), E. coli (26.5%, 35/132), Acinetobacter spp. (13.6%, 18/132), P. aeruginosa (9.8%, 13/132), and Enterobacter spp. (7.6%, 10/132). Carbapenem resistance genes were identified in 75.8% (25/33) of the carbapenemnonsusceptible strains. The prevalence of KPC, OXA23,OXA51, NDM type carbapenem resistance genes was 42.4% (14/33), 30.3% (10/33), 30.3% (10/33), and 3.0% (1/33),respectively. KPC type carbapenem resistance gene wasidentified in all 13 strains of carbapenem-non-susceptible K. pneumoniae while OXA23 and OXA51 type carbapenem resistance genes were identified in all the 10 strains of carbapenem-nonsusceptible A. baumannii. Conclusions Resistance to carbapenem is increasing in K. pneumoniae and A. baumannii strains isolated from blood samples. KPC and OXA23 type carbapenem resistance genes may be one of the main mechanisms contributing to carbapenem resistance in K. pneumoniae and A. baumannii.
bloodstream infection; carbapenemase; metallo-beta-lactamase; carbapenemase gene血流感染是临床常见的重症感染性疾病,具有较高的发病率及病死率,对患者生命威胁极大。近年来,血流感染发病率呈持续增高趋势[1],与此同时细菌耐药性也日益严重。定期监测细菌耐药性,开展流行病学调查有助于临床医师掌握本地区病原菌的分布及耐药情况,有助于初始治疗选用恰当的抗菌药物,对于医院感染的防控也有积极意义。
R378.2
A
1009-7708(2016)02-0214-07
10.16718/j.1009-7708.2016.02.016
2015-06-15
2015-08-16
上海市科学技术委员会医学引导类科技支撑项目(10411961500)。
1. 复旦大学附属华山医院抗生素研究所,卫生部抗生素临床药理重点实验室,上海 200040;
2. 上海市公共卫生临床中心重症肝炎科。
邹颖(1980—),女,硕士研究生,主治医师,主要从事感染性疾病的诊断与治疗。
李光辉,E-mail: liguanghui@fudan.edu.cn。

