中考物质鉴别常考题型及解题诀窍
王廷虎
物质的鉴别是利用各物质的不同特征,将两种或两种以上的物质加以区别的过程。这种题型既能检查学生对元素化合物知识的掌握程度,又能考查学生解题的技能、技巧,有利于培养学生的发散思维能力,因此一直是各省、市中考命题者所关注的一个热点。
一、解题原理
1.依据物质的特殊性质进行鉴别,如物质的颜色、气味、溶解性等。
2.依据物质间反应时所产生的特殊现象进行鉴别,即所选择的试剂和被检验的物质在发生化学反应时,必须能够产生下列现象中的一种:①变色;②放出气体(通常指产生气体的气味或在溶液中反应时产生的气泡);③生成沉淀(注意观察沉淀的颜色及在酸中的溶解情况)。
二、实验步骤
一般按如下步骤:①取少许溶液(固体取少许配成溶液)于试管中;②加入少量的试剂(试剂的选择应根据具体物质的成分来确定,同时注意在鉴别时排除干扰);③观察并记录实验现象;④总结鉴别结果。
三、常考题型及解题诀窍
题型1 限选用一种试剂的物质鉴别题
(1)如果被检验的物质之间存在着明显的酸碱性差别,可选用适当的指示剂或pH试纸来鉴别。例如,用一种试剂鉴别HNO3、 NaNO3、Na2CO3三种无色溶液,则可选用pH试纸或紫色石蕊溶液。
(2)如果被检验的物质之间在水中的溶解性、溶解时的热效应以及溶解后形成溶液的颜色不同,可选用水来作为鉴别试剂。例如,用一种试剂鉴别NaCl、BaSO4、FeCl3、NaOH四种固体物质,则可选用试剂水。NaCl可溶于水并形成无色溶液;BaSO4不溶于水;FeCl3可溶于水并形成淡黄色溶液;NaOH易溶于水并形成无色溶液,且溶解后溶液的温度显著升高。
(3)如果被检验的物质之间含有相同的阳离子或大多数相同的阳离子,可选用强酸溶液来鉴别。例如,用一种试剂鉴别K2SO4、K2CO3、K2SO3三种无色溶液,则可选用稀盐酸或稀硫酸。其中,无任何实验现象的原溶液是K2SO4溶液;有无色、无味气体(CO2)产生的原溶液是K2CO3溶液;有无色、有刺激性气味气体(SO2)产生的原溶液是K2SO3溶液。
(4)如果被检验的物质之间含有相同的阴离子或大多数相同的阴离子,可选用强碱溶液来鉴别。例如,用一种试剂鉴别MgCl2、NaCl、FeCl3、CuCl2四种溶液,则可选用NaOH溶液。其中,有白色沉淀产生的原溶液是MgCl2溶液;无明显现象的原溶液是NaCl溶液;有红褐色沉淀产生的原溶液是FeCl3溶液;有蓝色沉淀产生的原溶液是CuCl2溶液。
(5)如果被鉴别的物质之间有几种相同的阳离子和阴离子,则要分别考虑区别不同阳离子和阴离子各需要何种离子,然后将这两种离子合起来组成一种试剂。例如,用一种试剂鉴别AgNO3、Na2SO3、Na2CO3、Ba(NO3)2四种物质。在四种物质中,AgNO3和Ba(NO3)2的阳离子不同,需要区别Ag+和Ba2+,可用Cl-;Na2SO3和Na2CO3阴离子不同,需要区别[SO2-3]和[CO2-3],可用H+。综上,可选试剂HCl。
(6)如果被检验的物质分别是金属或金属氧化物,可选用强酸溶液来鉴别。例如,用一种试剂鉴别Fe、Cu、FeO、CuO四种粉末状的固体物质,则可选用稀盐酸或稀硫酸。其中,有气泡冒出的粉末是Fe;无任何明显现象的粉末是Cu;粉末逐渐溶解,无气泡产生,但溶液呈浅绿色的是FeO;粉末逐渐溶解,无气泡产生,但溶液呈蓝色的是CuO。
例1 (2015·陕西)下列各组物质用稀硫酸不能完全区分开的是( )
A.镁粉、氧化铜粉、木炭粉
B.NaOH溶液、Ba(OH)2溶液、KOH溶液
C.Na2CO3溶液、NaCl溶液、BaCl2溶液
D.铝片、铁片、银片
解析:A项,分别加入稀硫酸,有气泡产生的是镁粉,粉末溶解且溶液变蓝色的是氧化铜粉,粉末不溶解的是木炭粉,现象不同,可以鉴别;B项,分别加入稀硫酸,生成白色沉淀的是氢氧化钡,没有明显现象的是氢氧化钾、氢氧化钠,现象不完全相同,不能鉴别;C项,分别加入稀硫酸,有气泡产生的是碳酸钠,生成白色沉淀的是氯化钡,没有明显现象的是氯化钠,现象不同,可以鉴别;D项,分别加入稀硫酸,出现气泡、溶液显无色的是铝片,出现气泡、溶液显浅绿色的是铁片,不溶解的是银片,现象不同,可以鉴别。
答案:B
题型2 不选用试剂的物质鉴别题
(1)看颜色。例如,不用任何试剂来鉴别 Ba(NO3)2、NH4Cl、KOH、CuSO4四种溶液。首先观察出呈蓝色的为CuSO4溶液,然后用CuSO4溶液作为鉴别试剂,分别加到另外三种溶液中,产生白色沉淀的原溶液是Ba(NO3)2溶液,产生蓝色沉淀的原溶液是KOH溶液,无现象产生的原溶液是NH4Cl溶液。
(2)闻气味。例如,不用任何试剂来鉴别NaOH溶液、36%的HCl溶液、AgNO3溶液和Na2CO3溶液。可先闻气味,36%的HCl溶液有刺激性气味,首先被识别出,然后以36%的HCl溶液作为鉴别试剂,分别加到另外三种溶液中,有白色沉淀产生的原溶液是AgNO3溶液,有气泡冒出的原溶液是Na2CO3溶液,无明显现象的原溶液是NaOH溶液。
(3)加热法。如果被检验的物质中具有受热易分解性质的,可以采用加热分解法来鉴别。例如,不用任何试剂鉴别NaHCO3、NH4HCO3、Na2CO3三种固体,便可采用加热法。加热时,由于分解无任何固体剩余的为NH4HCO3,而加热后固体质量减少,但仍有固体剩余的为NaHCO3,而加热后固体质量无变化的则为Na2CO3。
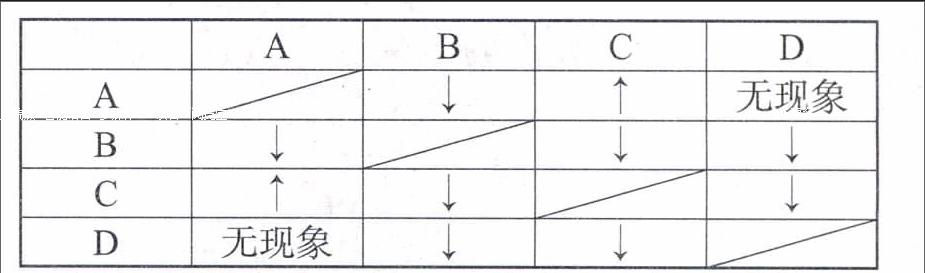
(4)两两混合列表法。对几种待鉴别的物质无法采用以上思路分析时,可以采用物质之间两两相互反应,并根据产生的实验现象不同,进行列表分析,从而来确定物质的名称。例如,不用任何试剂鉴别HCl、AgNO3、Na2CO3、BaCl2四种无色溶液。鉴别时可先将四种溶液分别编为A、B、C、D,两两之间相互进行反应,并用反应时产生的现象列出下表:
[\&A\&B\&C\&D\&A\&\&↓\&↑\&无现象\&B\&↓\&\&↓\&↓\&C\&↑\&↓\&\&↓\&D\&无现象\&↓\&↓\&\&]
由表可知,在四种物质中,能跟另外三种物质反应产生沉淀的只有AgNO3,因此,B为AgNO3;能跟其中两种物质反应产生沉淀,而跟另一种物质反应产生气体的只有Na2CO3,因此,C为Na2CO3;而能跟Na2CO3产生气体的物质A必是HCl;那么,D必然是BaCl2。
例2 (2015·襄阳)下列各组溶液,不用其他试剂无法鉴别的是( )
A.H2SO4 NaCl Na2CO3 CaCl2
B.HCl NaOH CuSO4 MgSO4
C.Na2CO3 K2SO4 BaCl2 HCl
D.NaNO3 HCl CaCl2 KOH
解析:A项,碳酸钠能够和硫酸反应产生二氧化碳气体,和氯化钙反应产生碳酸钙沉淀,因此,四种物质两两混合,既能够产生沉淀又能够产生气体的是碳酸钠,能够和碳酸钠反应产生气体的是硫酸,和碳酸钠反应产生沉淀的是氯化钙,剩下的是氯化钠,可以鉴别;B项,根据物质的颜色,首先鉴别出硫酸铜,然后将硫酸铜与其他三种物质混合,能产生蓝色沉淀的是氢氧化钠,然后将氢氧化钠与剩下的两种溶液混合,能够产生沉淀的是硫酸镁,无明显现象的是盐酸,可以鉴别;C项,氯化钡与硫酸钾、碳酸钠反应均能产生沉淀,故能与两种物质产生沉淀的是氯化钡,不与氯化钡反应的物质为盐酸,向其他两种物质中滴加盐酸,有气体生成的为碳酸钠,无现象的为硫酸钾,可以鉴别;D项,四种物质两两混合均没有明显现象,因此不加其他试剂不能鉴别。
答案: D
题型3 任意选用试剂的物质鉴别题
此类题目不限制所加试剂的种类,可有多种解法。题目考查的形式往往是从众多的鉴别方案中判断出最佳方案,其要求是操作步骤简单、试剂选用最少、现象明显。
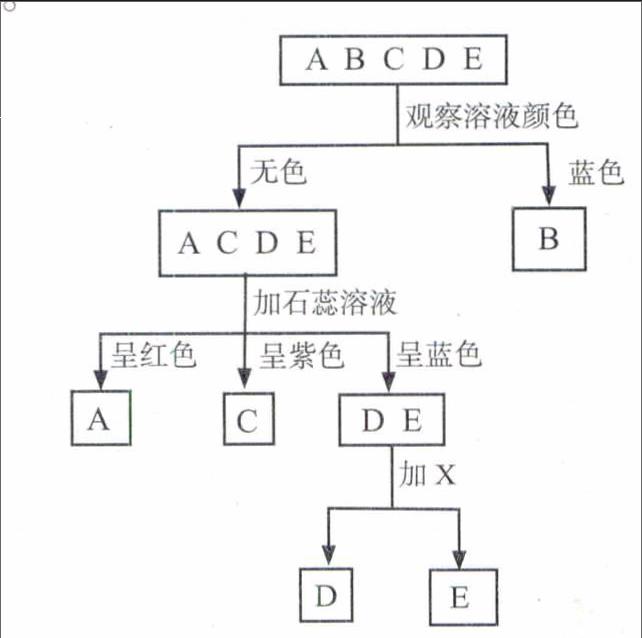
例3 (2015·天津)现有A、B、C、D、E五种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液、氯化钠溶液和稀硫酸中的一种,鉴别它们可按下图所示的步骤进行。回答下列问题。[A C D E] [A B C D E][B][C][A][E][D][观察溶液颜色][无色][蓝色][加石蕊溶液][呈红色][呈紫色][呈蓝色][加X][D E]
(1)B中的溶质是 (填化学式)。
(2)用X鉴别D、E时,X可以选用不同的物质。
①若X为稀盐酸,写出有气体生成的反应的化学方程式: 。
②若X为澄清石灰水,写出有沉淀生成的反应的化学方程式: 。
解析:硫酸铜溶液显蓝色;氢氧化钠、碳酸钠溶液呈碱性,能使石蕊溶液显蓝色;稀硫酸呈酸性,能使石蕊溶液显红色;氯化钠溶液呈中性,不能使石蕊溶液变色;碳酸钠溶液能与稀酸反应生成二氧化碳气体,能与钙离子、钡离子反应生成白色沉淀。(1)取五种溶液观察颜色,B溶液显蓝色,所以B是硫酸铜,剩余的四种溶液加入紫色石蕊溶液,A溶液显红色,所以A是稀硫酸,B溶液显紫色,所以B是氯化钠溶液,D、E溶液显蓝色,所以D和E分别是氢氧化钠溶液和碳酸钠溶液中的一种。 (2)①若X为稀盐酸,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳;②若X为澄清石灰水,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠。
答案:(1)CuSO4 (2)①Na2CO3+2HCl=2NaCl+H2O+CO2↑ ②Na2CO3+Ca(OH)2= CaCO3↓+2NaOH
题型4 开放式的物质鉴别题
此类题目在鉴别时具有很大的灵活性,可以不选用任何试剂来鉴别,也可以只选用一种试剂来鉴别,甚至在选择一种试剂时会有多种方案。
例4 (2015·常德)现有两瓶无色溶液,分别是氢氧化钠溶液和稀盐酸,请用三种不同的方法进行鉴别(不要求写出具体的操作过程和实验现象)。
解析:氢氧化钠溶液和稀盐酸的酸碱性明显不同,因此,可以用酸碱指示剂或测出溶液的pH来进行鉴别;也可以根据稀盐酸能与活泼金属反应产生氢气,能与碳酸盐反应产生二氧化碳,氢氧化钠溶液能与硫酸铜溶液、氯化铁溶液等反应产生沉淀来进行鉴别。
答案:①紫色石蕊溶液;②无色酚酞溶液;③用pH试纸测定溶液的pH;④与Mg或Fe等活泼金属混合;⑤与Na2CO3或CaCO3混合;⑥与CuSO4溶液或FeCl3溶液混合等。(写出三种即可)

