血红蛋白/Nano-Au/氨基硅烷/L-半胱胺酸@普鲁士蓝修饰电极检测H2O2
曹艳萍, 韩瑞芳, 张凌燕
(1.西北政法大学 公安学院,陕西 西安 710063;2.西南政法大学 刑事侦查学院,重庆 401120)
·化学与化学工程·
血红蛋白/Nano-Au/氨基硅烷/L-半胱胺酸@普鲁士蓝修饰电极检测H2O2
曹艳萍1, 韩瑞芳1, 张凌燕2
(1.西北政法大学 公安学院,陕西 西安710063;2.西南政法大学 刑事侦查学院,重庆401120)
以自组装在金电极上的L-半胱胺酸(L-cys)为基底沉积普鲁士蓝(PB),滴加氨基硅烷(APTES)后固定纳米金(Nano-Au),结合血红蛋白(HB),利用PB和HB对过氧化氢(H2O2)的催化作用,制备了H2O2传感器。该修饰电极在H2O2浓度为 4.0×10-8~1.0×10-5mol/L范围内与电流有线性响应,线性相关系数R=0.998 0。实验证明,HB/Nano-Au/APTES/L-cys@PB修饰电极显著提高了传感器的灵敏度,增强了稳定性,拓宽了线性响应范围并降低了检测下限。
L-半胱胺酸;普鲁士蓝;氨基硅烷;纳米金;过氧化氢
沉积于电极上充当电子媒介体的PB具有良好的电活性物质,己被广泛地应用于各种生物传感技术[1-4],但其存在易渗漏的缺点,影响了电极灵敏度及寿命。于是有文献报道了电聚合邻苯二胺[5]、壳聚糖[6]、巯基硅烷[7]等保护膜覆盖于PB外层以防止其渗漏。此外,HB价格低廉、稳定性好,且具有类似于过氧化物酶催化还原H2O2的作用[8]。
本文在电极上自组装一层L-cys,然后电沉积PB于L-cys分子空隙,滴加一层APTES,利用其丰富的氨基固定Nano-Au,最后在Nano-Au上固定一层HB,由此制备的电极具有如下优点:①PB掺杂于L-cys与呈网状的APTES形成的类似蘑菇状结构内,有效提高其稳定性;②缩合后的巯基硅烷呈网状结构,不仅可防止PB渗漏,其富含的氨基可以吸附更多的Nano-Au;③Nano-Au大的比表面积及良好催化性能,可以显著增加固定的HB的量并增强其催化活性,提高电极响应的灵敏度;④PB不仅是良好的电子媒介体,而且具有良好的催化性能,利用PB与HB良好的催化性能共同对H2O2进行电催化,放大了电极的电流响应,从而提高了电极的灵敏度。实验证明该传感器在H2O2浓度4.0×10-8~ 1.0×10-5mol/L范围内对电流有线性响应。 该传感器不但制备成本低,而且具有灵敏度高、稳定性好的优点。
1 实验部分
1.1仪器与试剂
CHI660A型电化学工作站(上海辰华仪器公司),采用循环伏安法考察不同修饰电极表面的电化学特性。该工作站采用的三电极系统为:HB/Nano-Au/APTES/L-cys @PB修饰的金电极为工作电极,铂丝电极为对电极,饱和甘汞电极为参比电极。测试底液为:25 mmol/L磷酸缓冲溶液(pH=6.5)。
L-cys (上海康达氨基酸厂),APTES,HB,氯金酸,柠檬酸三钠(Sigma公司,美国),铁氰化钾、三氯化铁(四川化学试剂厂)。实验用试剂均为分析纯试剂,实验用水为二次蒸馏水。
1.2电极制备
用纳米Al2O3将直径为2 mm、长约6 cm的裸金圆盘电极抛光成镜面,用蒸馏水对其进行冲洗,然后用无水乙醇和丙酮各超声5min后,再用蒸馏水冲洗,最后将金电极放置于室温并干燥待用。
电极制备参照文献[8]。将裸电极浸泡在20 mmol/L的L-半胱氨酸饱和溶液中0.5 h后,通过分子自组装形成一有序单分子修饰层,然后置于2.5 mmol/L K4Fe(CN)6+2.5 mmol/L FeCl3+0.1 mol/L KCl+0.1 mol/L HCl溶液中在+350和-50 mV范围内进行电沉积,滴加1.6 μL缩合的APTES,然后在Nano-Au中浸泡过夜,最后于含0.5mg/mL HB的25 mmol/L磷酸缓冲溶液(pH=6.5)中浸泡4 h。
2 结果与讨论
2.1HB/Nano-Au/APTES/L-cys@PB修饰电极表征
HB/Nano-Au/APTES/L-cys@PB修饰电极的过程见图1。图1b与图1a相比较,L-cys@PB出现了一对非常明显的 Fe(Ⅲ)/Fe(Ⅱ)氧化还原特征峰(见图1b),这是由于掺杂了电活性物质PB后,PB发生了如下氧化还原反应。
Fe4[Fe(CN)6]3+4e-+4K+↔K4Fe4[Fe(CN)6]3
当不具备导电性能的聚合物APTES作为保护膜滴加于L-cys@PB外层时,由于其网状结构堵塞了电子运动的部分通路,电流显著减小(见图1c)。Nano-Au具有良好的导电能力,当其固定在电极上时,通常促进电子传递,使电流增加。在本实验中,APTES/L-cys@PB修饰电极浸泡Nano-Au后,氧化还原峰电流值继续减小(见图1d),这可能是由于带负电荷的Nano-Au与同样带有大量负电荷的PB 之间的强烈的排斥作用产生的[9],当组装了HB后,电极电流显著继续减小(见图1e)。
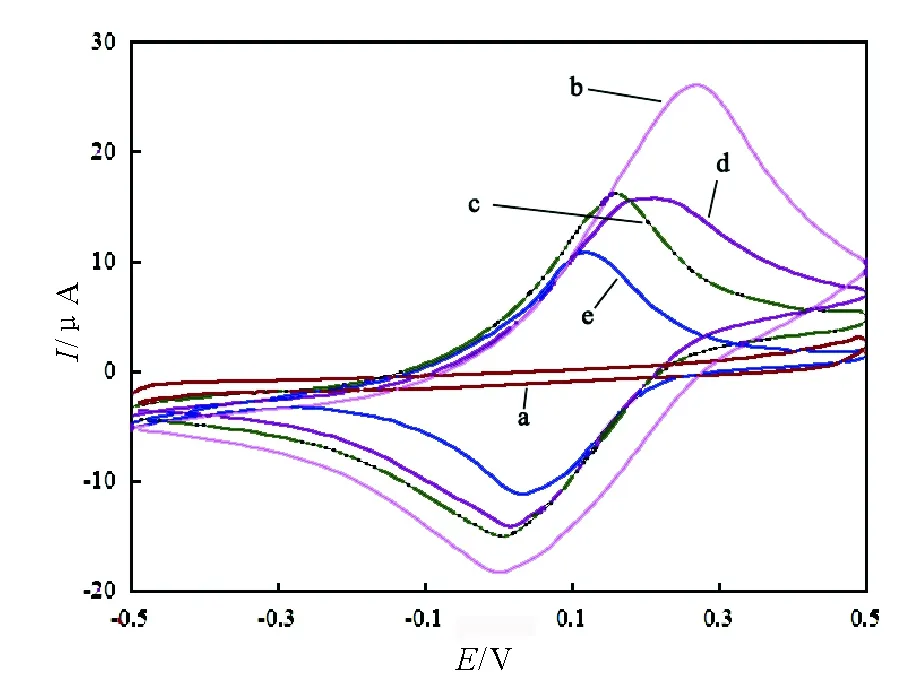
(a) L-cys, (b) L-cys@PB; (c) APTES/L-cys@PB;(d)nano-Au/APTES/L-cys@PB; (e)HB/nano-Au/APTES/L-cys@PB. 扫速: 100 mV/s.图1 循环伏安对电极制备过程的表征Fig.1 CVs were recorded in a 25 mmol/L PBS (pH 6.5)
由图2可见,在20~120 mV/s 范围内,HB/Nano-Au/APTES/L-cys@PB电极的ipa/ipc=1,即氧化峰与还原峰电流几乎相等,且氧化峰电流和还原峰电流ip与扫描速率V之间有线性关系,表明整个电极过程是受表面过程控制[9]。

图2 扫描速度对HB/Nano-Au/APTES/L-cys@PB修饰电极循环伏安的影响,扫速分别为:20, 40, 60, 80,100,120,140 mV/sFig.2 CVs of HB/Nano-A/APTES/L-cys@PB-modified electrode in 25 mmol/L PBS (pH 6.5) at various scan rates. The scan rates for curves are 20, 40, 60, 80,100,120 and 140 mV/s, respectively
2.2H2O2在 HB/Nano-Au/APTES/L-cys@PB 修饰电极上的电化学行为
图3考查了HB/Nano-Au/APTES/L-cys@PB 修饰电极对H2O2的电催化还原。当H2O2浓度分别是0 mol/L,0.50×10-6mol/L,2.30×10-6mol/L时,可以看出,HB/Nano-Au/APTES/L-cys@PB 修饰电极的氧化峰电流明显减小,还原峰电流显著增加。这证明HB/Nano-Au/APTES/L-cys@PB 修饰电极对H2O2有良好的电催化还原作用,其反应机理如下:
H2O2+CatFe(Ⅲ)→H2O+CatFe(Ⅳ)=O
H2O2+CatFe(Ⅳ)=O→H2O+CatFe(Ⅲ)+
O2
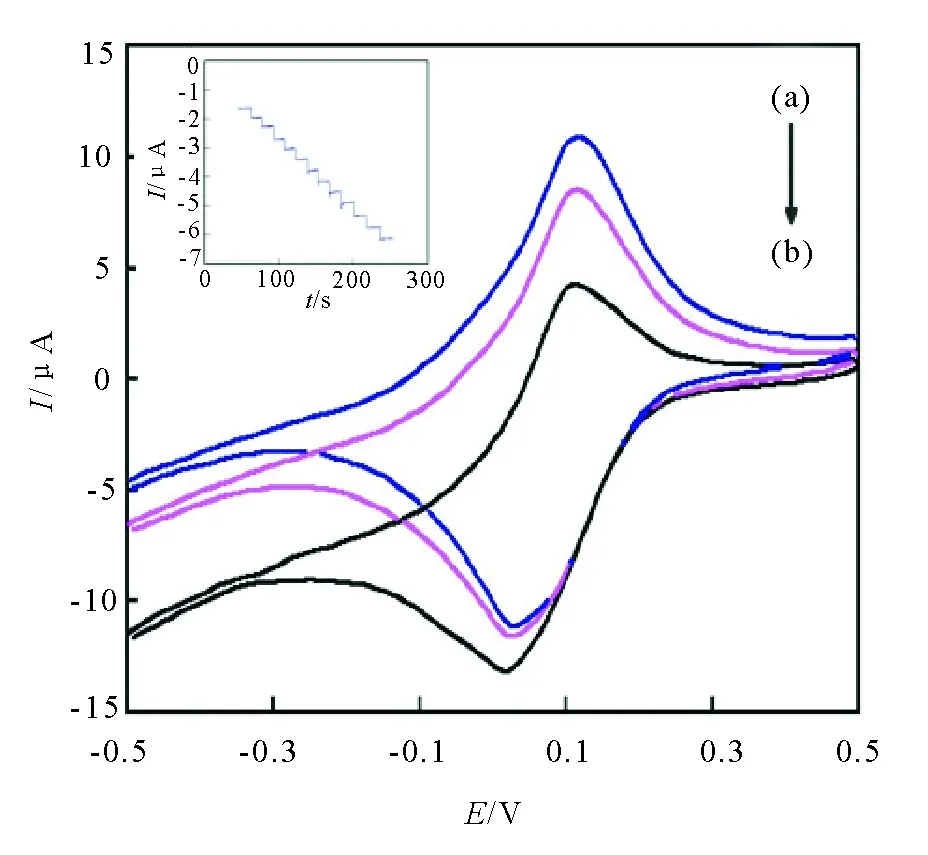
(a) 0mol/L; (b) 0.50×10-6mol/L; (c) 2.30×10-6mol/L,测试底液为25mol/L PBS (pH 6.5)的电催化行为。插图为计时电流:(25~125 s) 0.18 μmol/L, (125~175s) 0.42 μmol/L, (175~225 s) 1.38 μmol/L图3 HB/N ano-Au/APTES/L-cys@PB 电极 的电催化响应:H2 O2浓度Fig.3 Electrocatalytic activity of HB/Nano-Au/APTES/L-cys@PB-coated electrode in 25 mol/L PBS
2.3组装方法不同的电极电流响应特性比较
PB是良好的电活性物质,对H2O2有良好的电催化还原作用,但在电化学传感器研究中,基本上仅将其作为电子媒介体,只有极少数文献研究了其催化性能[8]。此外,HB与辣根过氧化物酶对H2O2均有良好的催化还原作用,但后者不仅对保存环境要求较高,且价格较前者贵,故本实验采用HB修饰电极。本实验比较了4种组装方法修饰的电极对H2O2的循环伏安电流响应曲线(见图4),分别为HB/Nano-Au/APTES/L-cys@PB(a),Nano-Au/APTES/L-cys@PB(b),HB/Nano-Au/APTES/PB(c),HB/Nano-Au/APTES/L-cys(d)修饰电极对H2O2的循环伏安电流响应曲线。从图4可见,a,b与c对H2O2均有良好的催化性能,由于固定在电极上的L-cys是有序定向单分子修饰层,而网状结构APTES则置于L-cys的外层,故L-cys与APTES构成了类似蘑菇网状结构[8]。PB掺杂并固定在L-cys分子之间,且外层有APTES保护,有效提高了稳定性,故图4中a与b响应性能较c好。HB/Nano-Au/APTES/L-cys修饰电极对H2O2几乎无响应。这是由于HB是生物大分子,其电活性物质辅基血红素中的铁原子被包裹于HB内部而未能与电极表面接触,故不能进行直接的电子传递,电极中引入电子媒介体PB后,能够促进HB与电极表面之间的电子传递。此外,PB在本实验设计中不仅充当电子媒介体,而且对H2O2具有良好的催化活性。实验证明,HB/Nano-Au/APTES/L-cys@PB 修饰电极对H2O2催化性能最好,其在H2O2浓度为 4.0×10-8~1.0×10-5mol/L范围内对电流有线性响应,检测下线 1.5×10-8mol/L(S/N=3)。这可能是因为PB与HB共同对H2O2催化的结果。
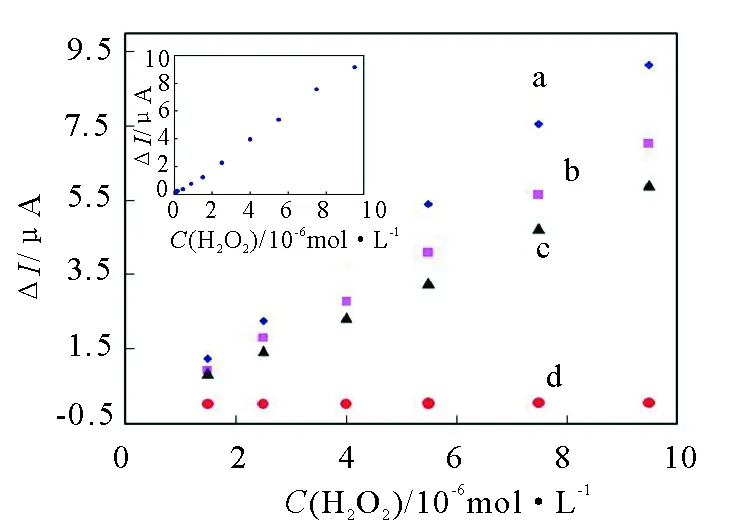
图4 H2O2在不同修饰电极的响应曲线图Fig.4 Amperometric response of H2O2 in the different modified electrode(a)HB/Nano-Au/APTES/L-cys@PB; (b)Nano-Au/APTES/L-cys@PB; (c)HB/Nano-Au/APTES/PB; (d)HB/Nano-Au/APTES/L-cys
酶促反应的动力学参数米氏常数(kmapp)可由Lineweaver-Burkequation 方程[10]求得:1/Iss=1/Imax+kmapp/ImaxC,其中Iss是加入一定浓度的H2O2时的稳态电流,Imax是H2O2浓度为最大时的电流,C为Iss对应的底物的浓度。 米氏常数(kmapp)可由稳态电流的倒数和H2O2浓度的倒数作图产生的斜率和截距求得。用此方法测得传感器的kmapp为 0.184 mmol/L, 较低的米氏常数说明该修饰电极固定的HB有较高的生物活性,且与H2O2有好的亲和力。
2.4PB沉积量、APTES滴加量修饰电极对电流响应的影响
PB沉积量对电流响应有很大影响。在相同条件下,电极上PB量与沉积时间成正比,图5比较了PB沉积时间分别为(a)15min,(b)20min,(c)25min,(d)30min修饰的HB/Nano-Au/APTES/L-cys@PB 电极对H2O2的催化效果,结果显示PB沉积25min时修饰的电极对H2O2的催化效果最好。
APTES滴加量对电极响应也会产生很大影响。当电极上APTES加量过多时会极大防止PB渗漏,且其丰富氨基将吸附更多Nano-Au,从而可以固定大量的HB。然而,大量的HB将堵塞电子到达电极的通道,反而降低了修饰电极对H2O2的催化作用,故实验过程中仅滴加1.6 μL APTES。
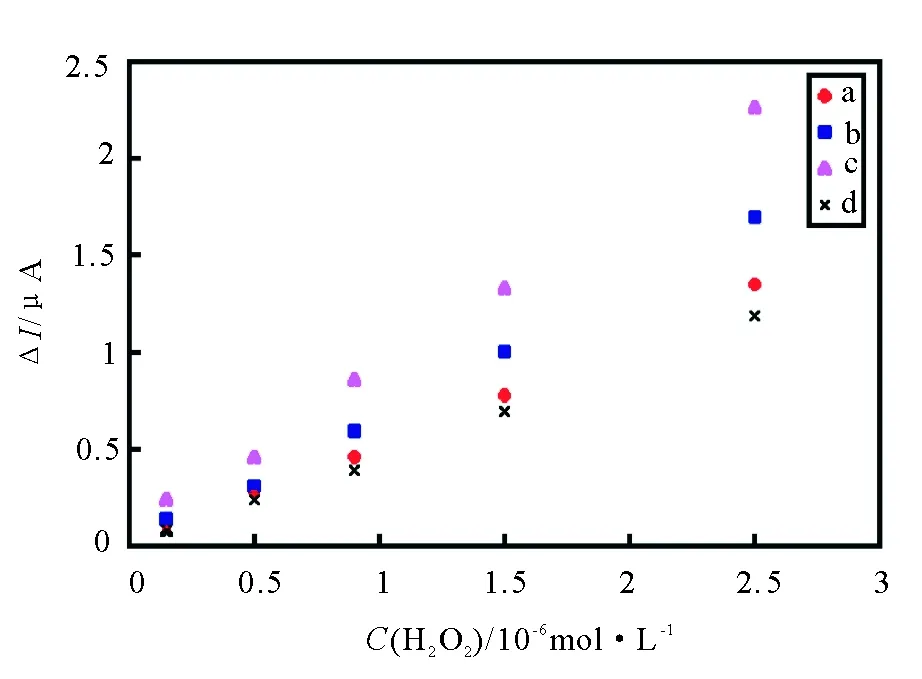
图5 PB沉积时间分别为(a) 15min, (b) 20min,(c) 25min, (d) 30min时修饰电极的电流响应Fig.5 The current response of the PB deposit time for the modified electrodes:(a) 15min, (b) 20min,(c) 25min, (d) 30min
pH对HB/Nano-Au/APTES/L-cys@PB修饰电极催化反应及其活性有重要影响。pH从4.0~7.5范围内的PBS中,固定H2O2浓度,发现当pH为6.5时,该修饰电极对H2O2催化效果最佳。
2.5电极的稳定性、重现性及抗干扰性实验
为了考察该修饰电极的稳定性,将HB/Nano-Au/APTES/L-cys@PB修饰电极放置于测试底液中(不含H2O2)连续循环扫描100圈后,发现该修饰电极的电流响应信号仍能保持初始信号的93.1%。这证明该电极组装方式能够有效防止PB渗漏,其主要原因是PB掺杂于L-cys后与L-cys之间有较强的黏附作用,能减少PB流失。此外,L-cys@PB与其外层网状的APTES形成的类似蘑菇状结构,也能够防止其渗漏,增加其稳定性。为了考察该修饰电极的寿命,将该电极放置于2~8℃冰箱中,间歇性使用15天,其响应信号的变化量未超过初始信号的5.2%。此外,文献[11]对电极的制备重现性进行考察,在相同条件下同时制备了4支HB/Nano-Au/APTES/L-cys@PB修饰电极,然后将它们分别置于含0. 2 mmol/L H2O2的测试底液中测定电流响应。结果显示:4支同时制备的电极其响应电流的RSD<4. 2%,此结果表明该修饰方法制备的电极有良好的制备重现性。
在优化后的实验条件下,将可能的干扰物质(浓度为1.0 mmol/L)如抗坏血酸、乳酸、葡萄糖、亚硝酸、尿酸等加入含0.2 mmol/L H2O2的测试底液中进行测试,结果证明上述物质对该修饰电极的测定均无明显影响。
3 结 论
本文介绍的HB/Nano-Au/APTES/L-cys@PB修饰电极对H2O2具有良好的催化性能。由于PB掺杂于L-cys分子间,且与APTES形成的类似蘑菇状结构有效防止PB渗漏,提高了其稳定性。 此外,由于PB和HB对H2O2具有催化性能,其协同作用,显著提高了电极对H2O2的催化响应。
[1]SUN G Q, LU J J, GE S G, et al. Ultrasensitive electrochemical immunoassay for carcinoembryonic antigen based on three-dimensional macroporous gold nanoparticles/graphene composite platform and multienzyme functionalized nanoporous silver label[J]. Analytica Chimica Acta, 2013, 775: 85-92.
[2]SHARMA P, SABLOK K, BHALLA V, et al. A novel disposable electrochemical immunosensor for phenyl urea herbicide diuron[J]. Biosensors and Bioelectronics, 2011, 26:4209-4212.
[3]SHARMA R, SURI C R.Biotransformation and biomonitoring of phenylurea herbicide diuron[J]. Bioresource Technology, 2011, 102: 3119-3125.
[4]SHARMA P, GANDHI S, CHOPRA A, et al. Fluoroimmunoassay based on suppression of fluorescence self-quenching for ultra-sensitive detection of herbicide diuron[J]. Analytica Chimica Acta, 2010, 676: 87-92.
[5]YUAN R, ZHANG L Y, LI Q F, et al.A label-free amperometric immunosenor based on the multi-layer structure of prussian blue/polymerized o-phenylenediamine/nano-Au/polymerized o-phenylenediamine/nano-Au/antibody for the determination of Japanese B encephalitis vaccine[J]. Analytica Chimica Acta, 2005, 531(1): 1-5.
[6]周庆美,谢青季.纳米金-壳聚糖-血红蛋白/普鲁士蓝/金电极检测过氧化氢[J]. 化学传感器, 2008, 28(1): 30-33.
[7]ZHANG L Y, ZHOU X F, CHU T.Preparation and evaluation of Fe3O4-core @Ag-shell nanoeggs nanoeggs for development of fingerprints[J]. Sci China Chem, 2013, 56: 551-556.
[8]ZHANG L Y, LIU Y J.Label-free amperometric immunosensor based on prussian blue as artificial peroxidase for the detection of methamphetamine[J]. Analytica Chimica Acta, 2014, 806: 204-209.
[9]张凌燕,袁若,柴雅琴,等.基于辣根过氧化物酶/纳米金/辣根过氧化物酶/多壁纳米碳管修饰的过氧化氢生物传感器的研究[J].化学学报, 2006, 64(16): 1711-1715.
[10] KAMIN R A, WILLSON G S.Rotating ring-disk enzyme electrode for biocatalysis kinetic studies and characterization of the immobi-lized enzyme layer[J]. Anal Chem, 1980, 52: 1198-1205.
[11] 王孟,梁新义,冯苍松,等.团聚状纳米AuPd修饰的H2O2生物传感器研究[J]. 食品研究与开发, 2012, 33 (4): 51-55.
(编辑陈镱文)
HB/Nano-Au/APTES/L-cystine@PB modified biosensor for H2O2determination
CAO Yan-ping1, HAN Rui-fang1, ZHANG Ling-yan2
(1.School of Public Security, Northwest University of Politics and Law, Xi′an 710063, China;2.College of Criminal Investigation, Southwest University of political Science and Law, Chongqing 401120, China)
An amperometric biosensor for the detection of H2O2was developed. The system was based on(3-mercaptorpropyl) trime-thoxysilane coat the prussian blue deposited @L-cystine-modified electrode to merge hemoglobin with nano-Au. The biosensor showed a specific response to H2O2in the range 4.0×10-8to 1.0×10-5mol/L by CV. Both prussian blue and hemoglobin exhibited excellent electrocatalytical properties toward the reduction of H2O2to amplify the amperometric signal, which enhanced the sensitivity of the biosensor and stability.
L-cys; PB; APTES; Nano-Au; H2O2
2015-03-11
国家自然科学基金资助项目(51102200);陕西省教育厅基金资助项目(2013JK0748)
曹艳萍,女,陕西榆林人,教授,从事型事法化及物证技术研究。
张凌燕,女,湖南长沙人,教授,从事法化及物证技术研究。
O657.1
A
10.16152/j.cnki.xdxbzr.2016-02-011

