高山被孢霉中Δ6脱饱和酶关键位点及其对活性的影响
史海粟,陈海琴,顾震南,张灏,陈永泉,陈卫
(江南大学 食品学院,江苏 无锡,214122)
高山被孢霉中Δ6脱饱和酶关键位点及其对活性的影响
史海粟,陈海琴*,顾震南,张灏,陈永泉,陈卫
(江南大学 食品学院,江苏 无锡,214122)
高山被孢霉中Δ6脱饱和酶(MaFADS6)是决定ω3/ω6多不饱和脂肪酸代谢流的关键酶。利用定点突变技术研究MaFADS6-Ι一级结构与功能的关系,为高山被孢霉多不饱和脂肪酸的合成提供了理论依据。利用非链取代式质粒扩增技术对已构建质粒pYES2/NT C-MaFADS6-Ι内的表达单元(即MaFADS6-Ι)中细胞色素b5区(HPGG)下游的位点进行定点突变,将所有突变体分别转化酿酒酵母进行诱导表达,进一步通过在培养基中添加Δ6脱饱和酶的底物来考察重组菌对各底物的催化作用。实验结果表明,所有突变体催化α-亚麻酸(ALA)的活性没有改变;K61和D68两个位点对催化亚油酸(LA)起关键作用,其对应的4个突变体对LA的转化率分别为(6.2±0.5)% (K61T)、(0.3±0.0)% (K61F)、(8.2±0.7)% (D68N)和(6.6±0.8)% (D68L),相比原始转化率各降低50%以上;G63和T69两个位点对LA的催化无直接影响,但G63T突变体由于突变位点极性改变,其对LA的转化率为(8.5±0.9)%,比原始转化率降低了49.9%;而V66位点的突变体对LA的转化率分别为(22.3±2.6)% (V66T)和(20.7±2.5)% (V66A),比原始转化率分别降低了36.1%和37.8%。确定了MaFADS6-Ι氨基酸序列中K61和D68两个关键氨基酸位点经突变后均会使其酶活明显降低,这为研究MaFADS6-Ι一级结构与功能的关系提供了理论依据。
Δ6脱饱和酶;高山被孢霉;定点突变
多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)对人体有重要的生理功能,对人类膳食和健康具有重要意义[1]。目前PUFAs的动植物来源有限,而利用产脂微生物合成PUFAs成为当今研究热点。高山被孢霉(Mortierellaalpina)是目前工业化生产花生四烯酸(arachidonic acid, 20:4Δ5,8,11,14, AA)的主要菌株,也是少量合成二十碳五烯酸(eicosapntemacnioc acid, 20:5Δ5,8,11,14,17, EPA)的具有正式安全性评估的菌种,同时也是脂质生物化学基础研究的重要模式菌[2-7]。
在高山被孢霉合成PUFAs途径中(图1),Δ6脱饱和酶是调控ω3/ω6脂肪酸代谢流的“分子开关”,它可以将α-亚麻酸(α-linolenic acid, 18:3Δ9,12,15, ALA)转化为十八碳四烯酸(stearidonic acid, 18:4Δ6,9,12,15, SDA)或将亚油酸(linoleic acid, 18:2Δ9,12, LA)转化为γ-亚麻酸(γ-linolenic acid, 18:3Δ6,9,12, GLA)[8-9]。高山被孢霉中Δ6脱饱和酶(MaFADS6)对这两种底物的选择性决定了ω3/ω6的比例,因此研究Δ6脱饱和酶的结构与功能的关系具有重要意义,但该酶是一个膜结合脱饱和酶,其分子结构与功能关系的研究一直没有取得重要进展。现阶段主要利用蛋白质功能区域交换或定点突变的技术进行研究。本实验室已对高山被孢霉ATCC 32222的Δ6I-脱饱和酶进行了催化特性的研究,确定了其底物偏好相关的关键位点[10],但对其细胞色素b5区域和His I区之间的氨基酸片段还没进行详细研究,本文将依托氨基酸多序列比对,对Δ6脱饱和酶的氨基酸序列进行比较,确定了细胞色素b5的特征结合区域-HPGG(His-Pro-Gly-Gly)下游的位点进行定点突变,旨在获得影响高山被孢霉来源MaFADS6-Ι催化特性的关键位点,为研究产脂微生物M.alpina中ω3/ω6脂肪酸流向调控提供理论基础。
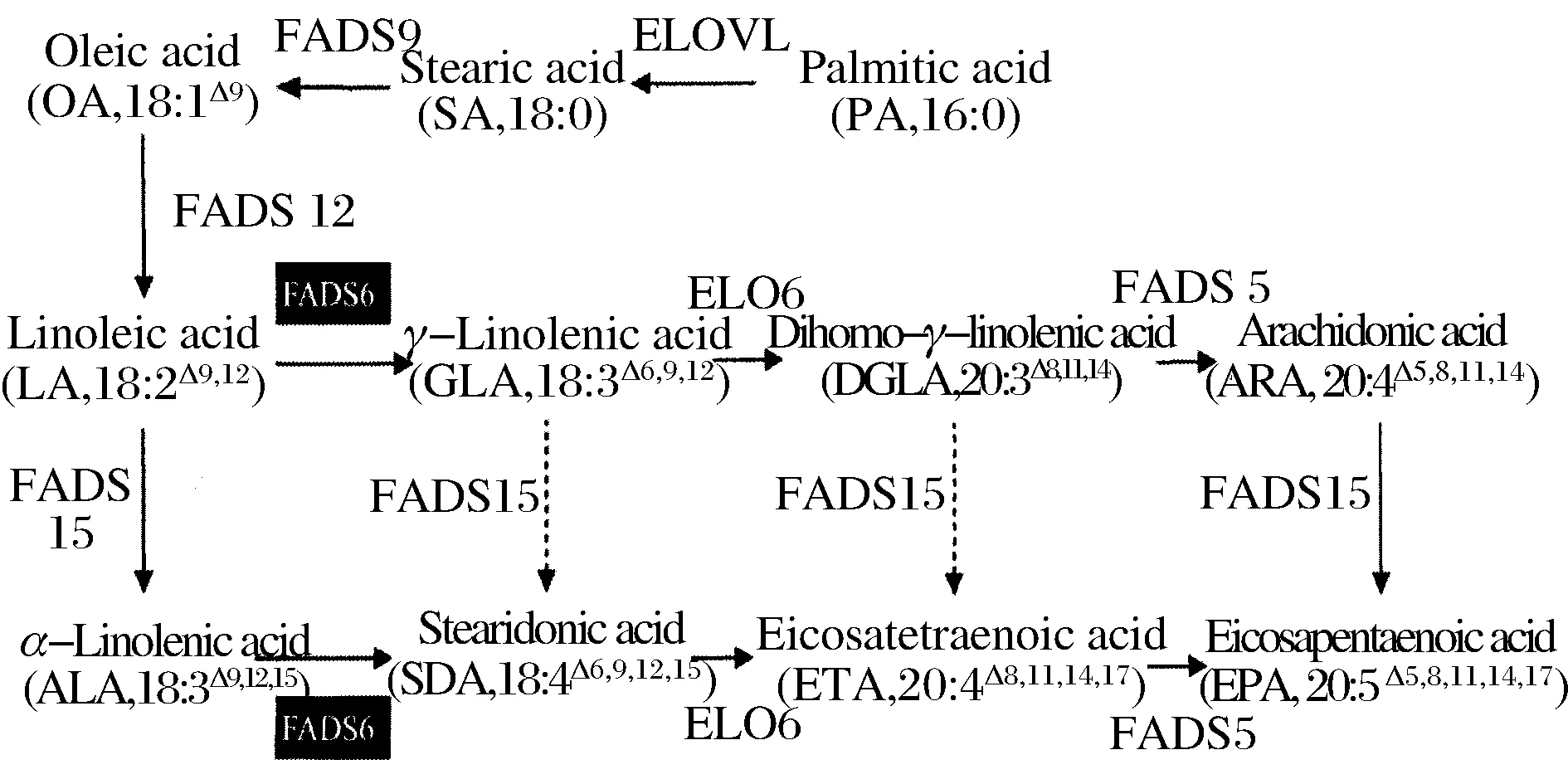
图1 高山被孢霉中多不饱和脂肪酸合成途径PUFAs biosynthetic pathways of M.alpina
1 材料与方法
1.1菌株和质粒、培养基
大肠杆菌(Escherichiacoli) TOP 10为实验室菌种库提供;高山被孢霉ATCC 32222购于美国标准生物品收藏中心,由本实验室菌种库保藏,并已对其完成基因组测序;酿酒酵母(Saccharomycescerevisiae)营养缺陷型INVSc1及表达载体质粒pYES2/NT C购自INVITROGEN公司,由本实验室保藏。YPD培养基:1%酵母提取物,2%蛋白胨,2%葡萄糖。LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L。SC-U及诱导培养基见pYES2/NT C操作手册。胰蛋白胨和酵母提取物均购自Oxoid公司。
1.2工具酶和试剂
游离脂肪酸LA和ALA及脂肪酸标品购于NU-CHEK,PREP公司。DNA marker DL10000购自TAKARA公司; HYQspinTMPlasmid DNA Kit柱式法质粒小提试剂盒(HG101-01)购自HYQBio公司;DNA序列测试也由生工生物工程(上海)股份有限公司完成;快速定点突变试剂盒购于TIANGEN公司;一抗(6×His标签鼠抗,Mouse THETM His Tag Antibody)和二抗(辣根过氧化物酶标记的羊抗鼠IgG,HRP-conjugated Goat Anti Mouse IgG)购于Genscript公司;引物由上海桑尼有限公司合成。其他常规试剂均为进口分装或国产分析纯。
1.3实验方法
1.3.1同源序列比对及拓扑模型预测
将MaFADS6-Ι与其他10个物种的Δ6脱饱和酶的氨基酸序列在DNAMAN软件中进行比对,并在TMHMM上完成对MaFADS6-Ι拓扑模型的预测。
1.3.2MaFADS6-Ι定点突变及测序鉴定
MaFADS6-Ι基因定点突变方法采用非链取代式质粒扩增技术,根据部分重叠的引物设计原则,利用primer5.0引物设计软件,设计K61T、K61F、G63A、G63T、V66T、V66A、D68N、D68L、T69V、T69S十对含预定突变位点的互补的寡核苷酸引物,送上海桑尼有限公司合成,如表1所示。以实验室前期构建的pYES2-MaFADS6-Ι质粒为模板,按TIANGEN公司快速定点突变试剂盒的操作说明进行定点突变的载体构建实验(图2)。

表1 本文所用的引物
注:a下划线代表突变的碱基位点。

图2 表达载体pYES2/NT C-MaFADS6-Ι-(mutant sites)的构建图示Fig.2 Schematic map of the recombinant plasmid pYES2/NT C-MaFADS6-Ι-(mutant sites)
对长出的突变克隆子进行PCR鉴定后,送交生工生物工程(上海)股份有限公司测序。得到的相应序列与MaFADS6-Ι基因原始序列使用Clustal X 2.1软件进行分析比较。将突变正确的转化子于-80 ℃冰箱在甘油管里保存。
1.3.3重组质粒pYES2/NT C-MaFADS6-Ι-(mutant sites)的转化
接种酿酒酵母菌株INVSc1的单菌落于YPD液体培养基,28 ℃恒温摇床过夜培养,接种适量的过夜培养液至YPAD液体培养基,28 ℃摇床过夜培养后离心收集菌体。细胞用无菌水和锂盐溶液[10×TE缓冲液∶10×LiAcV(贮液)∶V(无菌水)=1∶1∶8]各重悬1次,1 mL/份分装,于-80 ℃保存。
取200 μg载体DNA(鲑鱼精DNA)和≤5 μg重组表达载体一起加入2 mL EP管,混匀,加入锂盐溶液重悬,再加入1mL新鲜PEG溶液(50% PEG溶液∶10×TE缓冲液∶10×LiAc贮液=8∶1∶1),30 ℃摇荡温育30 min后于42 ℃热休克15 min,取200 μL 1×TE缓冲液重悬,最后取其中少量涂布于SC-U平板,28 ℃培养36~48 h。转化子经PCR验证后,于-80 ℃甘油管保存。具体方法详见精编分子生物学实验指南[11]。
1.3.4重组质粒pYES2/NT C-MaFADS6-Ι-(mutant sites)的表达及产物的Western blot分析
挑取酵母转化子单菌落至SC-U液体培养基,28 ℃摇床培养48 h,测定OD600值,取适量菌液接入含15 mL SC-U液体培养基的三角瓶,28 ℃摇床培养48 h,收集菌体,ddH2O重悬3次,SC-U诱导培养基重悬1次,离心去上清,加入15 mL SC-U诱导培养基,28 ℃摇床诱导12 h后收菌。
取2 mL诱导后的培养液,离心去上清,加入160 μL酵母破壁缓冲液和等体积的玻璃珠,使用FastPrep快速细胞破碎仪破壁后,加入40 μL 5×Loading Buffer,沸水浴5~10 min,取10 μL上样。样品经SDS-PAGE分离后,电转移至PVDF膜,TBST溶液漂洗3次,5 min/次,以含5%脱脂奶粉的TBST溶液于4 ℃缓慢振摇45 min,TBST溶液漂洗3次,5 min/次, 按1∶5 000加入6× His标签的鼠抗,孵育1 h,回收一抗,TBST溶液漂洗3次,5 min/次,按1∶2 000 加入HRP标记的羊抗兔IgG,缓慢摇荡45 min,TBST溶液漂洗3次,5 min/次。取等体积A、B液(A液:0.01 mol/L鲁米诺溶液;B液:0.1 mol/L双氧水溶液)混合,将PVDF膜反贴于A、B混合液于FluorChem FC3成像仪观察。
1.3.5重组Δ6脱饱和酶的活性测定
在上述诱导后的培养基中加入0.25 mmol/L cis-LA和0.25 mmol/L cis-ALA,28 ℃摇床继续培养12 h后收菌。菌体水洗3次,冻干。取100 mg冻干菌体,加2 mL 6mol/L的HCl,80 ℃水浴3 h,恢复至室温,加1 mL甲醇,振荡,加2 mL三氯甲烷,振荡1 min,收集氯仿层,氮气吹干;加入2 mL 10%的盐酸甲醇,60 ℃水浴3 h,加入1 mL饱和氯化钠和2 mL正己烷混匀,取上层于GC瓶。通过气相色谱仪对脂肪酸甲酯进行定性及定量分析,具体方法参照文献[12]。
1.3.6三维结构模拟
Δ6脱饱和酶各突变位点及突变体的三维结构通过SWISS-MODEL软件完成模拟,通过在线数据库自动搜索匹配的模板进行比对,生成三维结构。
2 结果与讨论
2.1同源序列比对及突变位点确定
利用DNAMAN软件对不同来源的Δ6脱饱和酶的氨基酸序列进行比对,如图3所示,发现MaFADS6-Ι与其他Δ6脱饱和酶一样,含有细胞色素b5区HPGG及3个组氨酸保守区即Ⅰ区HX3H、Ⅱ区HX2HH、Ⅲ区QX2HHLFP。细胞色素b5区域是作为Δ6脱饱和酶催化时的电子供体,该结构域中的HPGG是一个非常保守的亚铁血红素结合基序,是前端脱饱和酶的显著特征,对脂肪酸的脱饱和起着关键作用[13-14]。因此,我们从该区域寻找可能与Δ6脱饱和酶催化特性相关的位点,并在细胞色素b5区下游发现有一段比较保守的区域,其中有5个氨基酸位点存在差异,这可能与不同来源的Δ6脱饱和酶的催化特性相关。

MaFADS6-Ι:高山被孢霉ATCC 32222;OmFADS6:大麻哈鱼;CoFADS6:耳霉;TpFADS6:海链藻;GcFADS6:球状金藻;PtFADS6:三角褐指藻;PiFADS6:缺刻缘绿藻;CpFADS6:角齿藓;PyiFADS6:畸雌腐霉;MfFADS6:高山被孢霉1S-4;MWFADS6:高山被孢霉W15细胞色素b5(HPGG)区域用下划线表示,星号表示相同的氨基酸残基,箭头指示的氨基酸残基表示定点突变的位点。图3 基于Clustal X软件的FADS6序列比对Fig.3 Multiple Sequence alignment of FADS6 by Clustal X
通过脂肪酸脱饱和酶拓扑学模型分析显示,3个组氨酸保守区全部位于Δ6脱饱和酶的亲水区域。用TMHMM软件对Δ6 脱饱和酶的氨基酸序列的二级结构进行疏水性分析,拓扑结构如图4所示,该基因具有Δ6脱饱和酶基因的典型结构特征,两个长的跨膜疏水区,3个组氨酸保守区全部位于亲水区一侧,2个疏水的跨膜区穿过膜4次,与3个组氨酸保守区组成Δ6脱饱和酶的催化中心,5个待突变的氨基酸位点位于胞浆内。

图4 Δ6脱饱和酶的拓扑模型结构Fig.4 The predicted topology model of FADS6
2.2突变体构建及其验证
以氨基酸的亲水性和疏水性为原则,将5个位点的氨基酸残基分别突变成亲水性氨基酸和疏水性氨基酸。以提取的重组质粒pYES2-MaFADS6为模板,由表1的突变引物进行非链取代式质粒PCR扩增,经DpnI消化后转化至FDM感受态细胞中(定点突变试剂盒提供),待长出单菌落后进行PCR验证,结果如图5所示,扩增出的Δ6脱饱和酶突变基因大小在1 500 bp左右,与理论值大小一致。将鉴定正确的质粒送生工生物工程(上海)股份有限公司测序,确证定点突变成功。

M-Marker; 1,2-pYES2-K61T; 3,4-pYES2-G63A; 5,6-pYES2-V66T; 7,8-pYES2-D68N; 9,10-pYES2-T69V; 11,12-pYES2-K61F; 13,14-pYES2-G63T; 15,16-pYES2-V66A; 17,18-pYES2-D68L; 19,20-pYES2-T69S; 21-pYES2-FADS6图5 Δ6脱饱和酶突变基因重组载体pYES2/NT C-MaFADS6-Ι-(mutant sites)的PCR验证Fig.5 Identification of recombinant vectors for mutant genes by PCR
2.3MaFADS6-Ι突变基因在酿酒酵母中的表达
重组载体pYES2/NT C-MaFADS6-Ι-(mutantsites)转化酿酒酵母并诱导后,经SDS-PAGE分析和Western blot分析显示,重组MaFADS6-Ι在相对分子质量约54 kDa处可见特异的蛋白条带,与理论分子量一致,且各转化子的蛋白表达量在同一水平(图6)。

MW-Marker;1-pYES2/NT C;2-pYES2/NT C-MaFADS6-Ι-K61T;3-pYES2/NT C-MaFADS6-Ι-K61F;4-pYES2/NT C-MaFADS6-Ι-G63A;5-pYES2/NT C-MaFADS6-Ι-G63T;6-pYES2/NT C-MaFADS6-Ι-V66T;7-pYES2/NT C-MaFADS6-Ι-V66A;8-pYES2/NT C-MaFADS6-Ι-D68N;9-pYES2/NT C-MaFADS6-Ι-D68L;10-pYES2/NT C-MaFADS6-Ι-T69V;11-pYES2/NT C-MaFADS6-Ι-T69S;12-pYES2/NT C-MaFADS6-Ι图6 各突变基因表达产物的SDS-PAGE和Western bolt分析Fig.6 Analysis of expressing products by SDS-PAGE and Western bolt
2.4重组MaFADS6-Ι的催化特性分析
为验证重组MaFADS6-Ι的催化特性,选取已诱导的酵母转化子,以原始MaFADS6-Ι为对照,加入LA和ALA底物,28 ℃摇床培养12 h后通过气相色谱确定样品中LA、GLA、ALA和SDA的百分含量,以计算其对不同底物的转化率。结果如图7和图8所示,原始MaFADS6-Ι对LA和ALA的活性分别为56.2%和2.9%,所有重组MaFADS6-Ι对ALA的催化活性无影响。在对LA催化活性的影响上,K61T和K61F突变体对LA的转化率相比比原始MaFADS6-Ι有明显降低,分别降为6.2%和0.3%,这说明K61位点在MaFADS6-Ι的结构和功能中起重要作用,而将该点的Lys(K)突变成Phe(F)之后,几乎检测不到活性,推测原因可能是由于Phe的结构中存在苯环,其空间位阻使底物LA不能与酶契合;G63A、T69V和T69S对LA的转化率没有显著影响(分别为50.6%、51.8%和45.5%),但将G63突变成Thr时,转化率却降低至8.5%,由于Ala是非极性R基氨基酸,而Thr是不带电荷的极性R基氨基酸,这种替换改变了该位点的极性,从而破坏了MaFADS6-Ι活性中心的正常三维结构导致活性下降;V66T和V66A对LA的转化率分别为22.3%和20.7%,比原始MaFADS6-Ι的活性降低了50%以上, 推测该位点对酶活有影响,但不是影响酶活最关键的位点;D68N和D68L对LA的转化率分别为8.2%和6.6%,推断D68位点对MaFADS6-Ι活性的影响比V66位点更重要。

图7 同时添加底物LA和ALA时各突变体对底物的转化率Fig.7 Conversion rate of each mutant for each substrate其中LA转化率(%)=100 ×反应生成的GLA的量/(反应生成的GLA的量+反应剩余的LA的量),ALA转化率(%)=100 ×反应生成的SDA的量/(反应生成的SDA的量+反应剩余的ALA的量)。
2.5三维结构模拟分析
为了直观地解释各突变体的活性验证结果,以最近WANG[15]和BAI[16]等人在Nature杂志发表的人类和动物的Δ9-脱饱和酶的晶体结构和昆虫细胞色素b5区域的结构[17]为模板,利用SWISS-MODEL软件模拟出MaFADS6-Ι的三维结构(图9),各突变体的三维结构模拟图显示,对K61和D68两个氨基酸位点进行突变后,其三维结构发生了明显变化,而其他3个位点(G63、V66和T69)的突变没有引起明显的结构改变,这与酿酒酵母活性验证结果吻合。
综上所述,K61和D68两个位点对MaFADS6-Ι的活性起关键作用,G63和T69 两个位点对MaFADS6-Ι的活性不起关键作用,V66位点对MaFADS6-Ι的活性介于上述两者之间。

a-Cells of control(pYES2/NT C);b-pYES2/NT C-MaFADS6-Ι;c-pYES2/NT C-MaFADS6-Ι-K61T;d-pYES2/NT C-MaFADS6-Ι-K61F;e-pYES2/NT C-MaFADS6-Ι-G63A;f-pYES2/NT C-MaFADS6-Ι-G63T;g-pYES2/NT C-MaFADS6-Ι-V66T;h-pYES2/NT C-MaFADS6-Ι-V66A;i-pYES2/NT C-MaFADS6-Ι-D68N;j-pYES2/NT C-MaFADS6-Ι-D68L;k-pYES2/NT C-MaFADS6-Ι-T69V;l-pYES2/NT C-MaFADS6-Ι-T69S图8 同时添加底物LA和ALA后各重组载体pYES2/NT C-MaFADS6-Ι-(mutant sites)脂肪酸组成的GC图谱Fig.8 GC of fatty acids in each recombinants by adding both LA and ALA substrates

图9 突变体的三维结构模拟图Fig.9 Three-dimensional structure of each mutant(其中灰色结构表示突变氨基酸的化学结构式)
3 结论
本研究以MaFADS6-Ι为研究对象,通过序列分析确定了关键位点,对其进行突变后测定各突变体对两底物的催化作用,最终确定了MaFADS6-Ι氨基酸序列中K61和D68两个关键氨基酸位点对其催化活性有重要影响。
[1]ARTERBURN L M,HALL E B,OKEN H.Distribution,interconversion,and dose response of n-3 fatty acids in humans[J].American Journal of Clinical Nutrition,2006,83(6):1 467-1 476.
[2]李会珍,张志军.植物合成长链多不饱和脂肪酸研究进展[J].中国生物工程杂志,2008,28(12):112-115.
[3]HAO Guang-fei, CHEN Hai-qin, DU Kai,et al.Increased fatty acid unsaturation and production of arachidonic acid by homologous over-expression of the mitochondrial malic enzyme inMortierellaalpina[J].Biotechnology Letters,2014,36(9):1 827-1 834.
[4]SAKURADANI E,ANDO A,SHIMIZU S,et al.Metabolic engineering for the production of polyunsaturated fatty acids by oleaginous fungusMortierellaalpina1S-4[J].Journal of Bioscience and Bioengineering, 2013,116(4):417-422.
[5]SAKURADANI E,KOBAYASHI M,SHIMIZU S.Δ6-Fatty acid desaturase from an arachidonic acid-producingMortierellafungus:Gene cloning and its heterologous expression in a fungus,Aspergillus[J].Gene,1999, 238(2):445-453.
[6]SAKURADANI E,SHIMIZU S.Gene cloning and functional analysis of a second delta 6-fatty acid desaturase from an arachidonic acid-producingMortierellafungus[J].Bioscience,Biotechnology,and Biochemistry,2003,67(4): 704-711.
[7]代鹏,陈海琴,顾震南,等.高山被孢霉生产多不饱和脂肪酸发酵条件的研究进展[J].食品工业科技,201435(5):354-359.
[8]ZHANG Qi,LI Ming-chun,MA Hai-ting,et al.Identification and characterization of a novel Δ6-fatty acid desaturase gene fromRhizopusarrhizus[J].FEBS Letters,2004,556(1):81-85.
[9]ZHOU X R,ROBERT S,SINGH S,et al.Heterologous production of GLA and SDA by expression of anEchiumplantagineumΔ6-desaturase gene[J].Plant Science,2006,170(3):665-673.
[10]SHI Hai-su, CHEN Hai-qin,GU Zhen-nan,et al.Molecular mechanism of substrate specificity for delta 6 desaturase fromMortierellaalpinaandMicromonaspusilla[J].Journal of Lipid Research,2015,56(12):2 309-2 321.
[11]奥斯伯.精编分子生物学实验指南[M].第五版.北京:科学出版社,2008:545-581.
[12]ZHANG Bai-xi,RONG Chun-chi,CHEN Hai-qin,et al.De novo synthesis of trans-10, cis-12 conjugated linoleic acid in oleaginous yeastYarrowialipolytica[J].Microbial Cell Factories,2012,11(1):51.
[13]MITCHELL A G and MARTIN C E.A novel cytochrome b5-like domain is linked to the carboxyl terminus of theSaccharomycescerevisiaeΔ-9 fatty acid desaturase[J].Journal of Biological Chemistry,1995,270(50):29 766-29 772.
[14]QIU Xiao,HONG Hai-ping,DATLA N,et al.Expression of borage Δ6 desaturase inSaccharomycescerevisiaeand oilseed crops[J].Canadian Journal of Botany,2002,80(1):42-49.
[15]WANG Hui,KLEIN M G,ZOU Hua,et al.Crystal structure of human stearoyl-coenzyme A desaturase in complex with substrate[J].Nature Structural & Molecular Biology,2015,22(7):581-585.
[16]BAI Yong-hong, MCCOY J G, LEVIN E J, et al.X-ray structure of a mammalian stearoyl-CoA desaturase[J].Nature, 2015,524(7 564):252-256.
[17]WANG Li-jun,COWLEY A B,TERZYAN S,et al.Comparison of cytochromes b5 from insects and vertebrates[J]. Proteins:Structure,Function,and Bioinformatics,2007,67:293-304.
Key sites of Δ6 desaturase fromMortierellaalpinaand its effect on catalytic activities
SHI Hai-su, CHEN Hai-qin*, GU Zhen-nan, ZHANG Hao,CHEN Yong-quan, CHEN Wei
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Δ6 desaturase from oleaginousMortierellaalpina(MaFADS6) is a key enzyme in biosynthesis of ω3/ω6 polyunsaturated fatty acids (PUFAs). This study focused on the relationship between the primary structure and function for MaFADS6-Ι based on site-directed mutagenesis. Non-chain plasmid amplification method was used in this study to target downstream of cytochrome b5 region (HPGG) in the expression unit (MaFADS6-Ι) of pYES2/NT C-MaFADS6-Ιby site-directed mutagenesis. Each recombinant plasmid was transformed and expressed inSaccharomycescerevisiae. The results showed that the catalytic activity of all mutant using α- linolenic acid (ALA) as substrate has not changed. Two catalytic sites, K61 and D68, played a key role for its catalysis on linoleic acid (LA). The LA conversion rate of four corresponding mutants was (6.2 ± 0.5)% (K61T), (0.3 ± 0.0)% (K61F), (8.2 ± 0.7)% (D68N) and (6.6 ± 0.8)% (D68L), respectively, which reduced by more than 50% compared to the original conversion rate. G63 and T69 were two sites which not directly affect the catalysis of LA, but LA conversion of G63T mutant was (8.5 ± 0.9)% which decreased 49.9% compared the original conversion rate due to polarity change of mutation site. LA conversion rates of V66 mutants were (22.3 ± 2.6)% (V66T) and (20.7 ± 2.5)% (V66A), which decreased by 36.1% and 37.8% compared to the original conversion rate. Enzymatic activities were significantly reduced after mutation of two key site of amino acid sequence of MaFADS6-Ι, K61 and D68. It provided a theoretical basis for the study on relationship between primary structure of MaFADS6-Ιand its function.
Δ6 desaturase;Mortierellaalpina; site-directed mutagenesis
10.13995/j.cnki.11-1802/ts.201609001
硕士研究生(陈海琴教授为通讯作者,E-mail:haiqinchen@jiangnan.edu.cn)。
国家自然科学基金(No.21276108)
2016-02-03,改回日期:2016-03-21

