线性减小比生长速率指数补料策略对酵母生产效率的改善
季萌,缪冶炼*,陈介余,尤业兵,刘飞龙,许琳
1(南京工业大学 食品与轻工学院,江苏 南京,211800)2(日本秋田县立大学 生物资源学部,日本 秋田,010-0195)3(南京工业大学 生物与制药工程学院,江苏 南京,211800)
线性减小比生长速率指数补料策略对酵母生产效率的改善
季萌1,缪冶炼1*,陈介余2,尤业兵1,刘飞龙1,许琳3
1(南京工业大学 食品与轻工学院,江苏 南京,211800)2(日本秋田县立大学 生物资源学部,日本 秋田,010-0195)3(南京工业大学 生物与制药工程学院,江苏 南京,211800)
酵母的生产效率和成本在很大程度上依赖于培养模式。根据酵母的生长特性,提出了一种新的线性减小比生长速率指数补料(exponential-feeding based on linear reducing specific-growth-rate, LR-μ-EF)策略。首先,采用该策略进行抗冻酵母SaccharomycescerevisiaeAFY-1的3 L发酵罐培养试验,比较了培养过程中生物量的计算值和实验值。然后在此基础上,以最终生物量、收率和生产速度为酵母生产效率的评价指标,讨论了补料速度和累计补料体积对酵母生产效率的影响。当恒定比生长速率指数补料(constant-μexponential-feeding, C-μ-EF)培养阶段的比生长速率(μ)为0.05 h-1、LR-μ-EF培养阶段的μ减小速度为0.000 8 h-2时,生物量的实验值与计算值基本一致。在累计补料体积560 mL的条件下,最终生物量和酵母收率随着μ减小速度的增大而逐渐上升,当μ减小速度为0.000 8 h-2时分别达到77.5g/L和38.0%。这与μ减小速度为0(即C-μ-EF策略)时相比,分别增加了26.7%和27.5%。此外,酵母生产速度基本与μ减小速度无关,保持在0.8~0.9g/(L·h)范围。以上研究结果表明了LR-μ-EF策略改善酵母生产效率的能力,为酵母的工业化生产提供了有用信息。
酵母;分批培养;补料策略;比生长速率;生产效率
酵母在食品、医药、生物工程、发酵工程、饲料工业等领域有着广泛的应用,目前其全球年消费量高达数百万吨,并仍在不断增长[1]。酵母的培养模式直接影响其生产效率和成本,是酵母生产技术的研究热点之一[2-3]。从理论上来说,指数流加培养是一种最为有效的酵母培养模式。指数流加培养根据酵母的指数生长规律确定培养基的流加速度,可避免一次性投料培养中的底物抑制问题,减少乙醇和其他副产物的形成,从而提高酵母的收率和生产速度[4-6]。
目前关于酵母指数流加培养的研究大多数都假设培养过程中酵母的比生长速率保持恒定,也就是说酵母以恒定的比生长速率按时间的指数函数生长[7-9]。但实际上,指数流加培养过程中,比生长速率难以保持恒定。这是因为随着培养的进行(特别是在培养的中后期),酵母、乙醇和溶氧浓度等环境条件发生改变,酵母生长受到抑制[10-12]。此外,合理的比生长速率也难以确定。若比生长速率设定过高,则培养基供给超出酵母生长的需要,酵母生长受到抑制,反之若比生长速率设定过低,则培养基供给不足,限制酵母生长速度[13]。在指数流加培养的前期采用较大的比生长速率,后期采用较小的比生长速率,可改善溶氧不足问题,提高最终生物量[7,14]。因此,本研究根据糖代谢受到氧和糖浓度双重影响的酵母生长特性,提出一种新的线性减小比生长速率指数补料(exponential feeding based on linear reducing specific-growth-rate, LR-μ-EF)策略。该补料策略在培养初期采用较大的比生长速率,而在培养中后期采用随时间线性减小的比生长速率,以达到提高酵母生产效率的目的。
本文作者在前期研究中以SaccharomycescerevisiaeCGMCC 2.1423为出发菌株,采用低温等离子体诱变结合定向驯化的手段,选育出了1株发酵能力强的抗冻酵母S.cerevisiaeAFY-1[15]。该酵母冷冻生胚的发酵力在-20 ℃条件下冻藏7 d时为冷冻前的93%,35 d以后一直稳定在冷冻前的86%,抗冻能力明显优于其他市售酵母。本研究以抗冻酵母S.cerevisiaeAFY-1为实验菌株,探究LR-μ-EF策略改善酵母生产效率的有效性。首先,采用该策略进行抗冻酵母S.cerevisiaeAFY-1的培养,以恒化培养动力学参数为依据计算指数补料培养中的生物量,并与实验值比较;然后在此基础上,以最终生物量、收率和生产速度为酵母生产效率的评价指标,讨论补料速度和累计补料体积对酵母生产效率的影响。
1 指数补料培养数学模型
假设指数补料培养过程中酵母的比生长速率恒定,且补料速度等于消耗速度,则根据物料恒算可得如下补料方程[12]:
(1)
式中:F,补料速度,L/h;μ,酵母比生长速率(即单位质量的酵母在单位时间内的生长量),h-1;V0,初始罐内培养基体积,L;CC0,初始罐内生物量,g/L;YC/S,酵母对葡萄糖的收率,%;CSF,流加培养基的葡萄糖浓度,g/L;CS,罐内葡萄糖浓度,g/L;tF,指数补料培养时间,h。
对式(1)进行积分,可得到累计补料体积VSF(L)的计算式:
(2)
此外,罐内生物量CC(g/L)随指数补料培养时间的变化可用式(3)[11]表示:
(3)
式(1)~式(3)中,V0、CSF、CC0、μ、tF为操作参数,可根据实验需要设定。酵母在无抑制的条件下生长时,μ和CS之间的关系符合Monod方程[16]。经过变换,CS与μ的关系可以表示为:
(4)
式中,KS,基质饱和常数,g/L;μmax,酵母最大比生长速率,h-1。
YC/S与μ的关系可以用式(5)[17]表示:
(5)
式中,QS,基质消耗速率,h-1;YG,酵母最大生长得率系数;mS,酵母生长维持系数,h-1。
本研究分别在稀释率为0.006、0.01、0.03、0.05 h-1的条件下进行抗冻酵母S.cerevisiaeAFY-1的恒化培养,得到μmax=0.31 h-1;KS=0.81 g/L;YG=0.43;mS=0.002 4 h-1。因此在指数补料培养中,只要设定μ,即可分别根据式(4)和式(5)计算得到CS和YC/S[18]。
对于线性减小比生长速率的指数补料培养,本研究采用时间差分法计算补料速度、累计补料体积和罐内生物量。在充分小的时间间隔内,可以认为μ恒定不变,式(1)~式(3)成立。
2 材料与方法
2.1酵母菌种
以抗冻酵母S.cerevisiaeAFY-1为实验菌株。该菌株采用斜面培养基(葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,琼脂20 g/L)在4 ℃条件下保存。
2.2培养基
种子培养基:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,自然pH,在121 ℃条件下灭菌20 min,冷却至室温。
扩大培养基:葡萄糖40 g/L,酵母浸粉8.9 g/L,无机离子母液(KH2PO460 g/L、MgSO420 g/L、CaCl20.2 g/L)3.6 mL/L,维生素母液(肌醇2 g/L、硫胺素0.5 g/L)3.6 mL/L,自然pH。其中,维生素母液采用0.22 μm微滤膜过滤除菌,其他溶液在121 ℃下灭菌30 min,冷却至室温后混合。
流加培养基:葡萄糖500 g/L,酵母浸粉111.46 g/L,无机离子母液(KH2PO460 g/L、MgSO420 g/L、CaCl20.2 g/L)45.3 mL/L,维生素母液(肌醇2 g/L、硫胺素0.5 g/L)45.3 mL/L,自然pH。灭菌方法与扩大培养基相同。
2.3种子培养
在250 mL三角瓶中装入100 mL种子培养基,用接种环将酵母菌种从斜面培养基接种至种子培养基中,在180 r/min、30 ℃的摇床上培养21 h(对数期后期,细胞浓度为1.2×107个/mL)。
2.4补料分批培养
酵母的补料分批培养分别采用恒定比生长速率指数补料(constant-μexponential feeding, C-μ-EF)和线性减小比生长速率指数补料(LR-μ-EF)的2种策略进行。其中,采用C-μ-EF策略的培养包括2个阶段:无补料培养阶段和C-μ-EF培养阶段;采用LR-μ-EF策略的培养包括3个阶段:无补料培养阶段、C-μ-EF培养阶段、以及LR-μ-EF培养阶段。无补料培养的目的在于得到一定的酵母生长速度和生物量,使得指数补料培养顺利进行[19]。
(1)无补料培养
在3 L发酵罐(BIOTECH-3BG,上海保兴生物设备工程有限公司)中装入1.0 L扩大培养基,接入50 mL种子液,进行无补料的培养。培养温度和通气量分别设定在30 ℃和200 L/h,罐内发酵液的溶氧量通过改变搅拌转速(200~800 r/min)控制在30%以上,pH用浓度为2 mol/L的H2SO4溶液和1 mol/L的NaOH溶液控制在5.0左右。
(2)C-μ-EF培养
在无补料的培养进行到24 h时,罐内葡萄糖和乙醇完全消耗。从此开始,按照式(1)向罐内供给流加培养基,进行C-μ-EF培养。比生长速率(μ,h-1)设定为0.05[13]。
(3)LR-μ-EF培养
当无补料及C-μ-EF培养进行到40 h时,开始LR-μ-EF培养。μ与培养时间t(h)的关系可用式(6)表示:
μ=0.05-ω(t-40) (ω>0)
(6)
式中,ω,μ的减小速度,h-2。
(4)补料
采用蠕动泵(BT100-02-YZ1515,保定齐力恒流泵有限公司)向发酵罐内补给流加培养基,当累计补料体积达到设定值时结束培养。从理论上来说,补料速度按式(1)计算,但补料速度随时间的变化难以在蠕动泵上实现。因此,本实验采用时间差分法进行补料速度的计算和控制,时间间隔△t设定为1 h。在任意时刻t,根据式(2)计算出△t内的平均补料速度(L/h),作为蠕动泵在△t内的操作值。以μ=0.05 h-1为例,补料速度的计算值和操作值如图1所示。

图1 补料分批培养中补料速度的计算值和蠕动泵操作值(μ=0.05 h-1)Fig.1 Calculated feeding rate and set values for peristaltic pump operation in the fed-batch culture
2.5测定
培养过程中,从发酵罐内取出发酵液试样10 mL,测定生物量、乙醇和残糖浓度。
(1)生物量测定
采用紫外分光光度计(752S,上海棱光技术有限公司)在600 nm处测定试样的光密度(OD600),并根据标准曲线方程计算出生物量(干重)。测定前,根据需要进行稀释,以保证OD600在0.2~0.8范围内。每个测定重复3次,取平均值。
(2)乙醇和残糖浓度测定
试样的乙醇和残糖浓度采用生物传感器(SBA-40E,山东省科学院生物研究所)进行测定。将试样在4 ℃、3 000 r/min条件下离心10 min,取25 μL上清液进样。每个测定重复3次,取平均值。
3 结果与讨论
3.1培养过程特征
图2表示C-μ-EF策略应用的1例。该实验中,经过24 h的无补料培养,生物量(CC)达到12.3 g/L,罐内葡萄糖(CS)和乙醇(CE)消耗殆尽,溶氧(DO)也出现急剧上升。因此,在此时开始C-μ-EF培养,μ设定为0.05 h-1。在C-μ-EF培养阶段,罐内葡萄糖浓度无上升,表明流加培养基的营养成分被全部利用。生物量的实验值在52 h前与计算值基本一致,但在52 h后小于计算值,且随着时间的延长,两者差别增大。71 h时,累计补料体积达到560 mL,培养终了。此时,生物量的实验值为61.2 g/L,远小于计算值82.8 g/L。与生物量的变化相对应,乙醇浓度从52 h时开始逐渐增加,到71 h时达到16.7 g/L。溶氧也在52 h时开始从30%逐渐下降,71 h时下降至0。

Ⅰ:无补料培养阶段;Ⅱ:C-μ-EF培养阶段,μ=0.05 h-1图2 C-μ-EF策略应用的一例Fig.2 An application example of C-μ-EF strategy
在C-μ-EF培养的中后期,生物量的实验值小于计算值,表明部分葡萄糖消耗于酵母的乙醇发酵途径,实际的μ小于其设定值0.05 h-1。该现象发生的主要原因是:随着培养的进行,生物量增加,依靠提高搅拌转速与通气量已不能满足酵母生长的需要,因而发酵液的溶氧下降,同时产生了克雷布特效应[2,7,20-21]。
为了解决这一问题,提高酵母生产效率,本研究提出了LR-μ-EF策略。图3表示LR-μ-EF策略应用的1例。该培养策略包括3个阶段:0~24 h的无补料培养阶段、24~40 h的C-μ-EF培养阶段、40~102 h的LR-μ-EF培养阶段。在C-μ-EF培养阶段,μ同样设定为0.05 h-1;在LR-μ-EF培养阶段,μ按式(6)线性减小,其中ω设定为0.000 8 h-2。在整个C-μ-EF和LR-μ-EF培养阶段,罐内葡萄糖(CS)和乙醇(CE)浓度无上升,溶氧(DO)始终维持在30%以上,生物量(CC)的实验值与计算值基本一致。102 h时,累计补料体积达到560 mL,培养终了。此时,生物量达到77.5 g/L,与C-μ-EF策略相比提高了26.7%。由此可见,采用LR-μ-EF策略,可避免发酵液溶氧不足、克雷布特效应等问题。
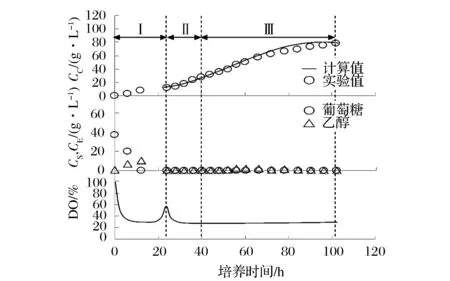
Ⅰ:无补料培养阶段;Ⅱ:C-μ-EF培养阶段,μ(h-1)=0.05;Ⅲ:LR-μ-EF培养阶段,μ(h-1)=0.05-0.0008(t-40)图3 LR-μ-EF策略应用的一例Fig.3 An application example of LR-μ-EF strategy
3.2μ减小速度对酵母生产效率的影响
酵母生产效率采用最终生物量(CCF,g/L)、收率(YC/S,%)和生产速度[RC,g/(L·h)]进行评价。其中,CCF表示培养结束时单位体积的发酵液所含的酵母质量,强调酵母培养能力;YC/S表示生产酵母质量与消耗葡萄糖质量的百分比,强调基质利用效率;RC表示整个培养过程中单位体积的发酵液在单位时间内的生产酵母质量,强调酵母生产强度。
μ的减小速度可用式(6)中的ω来表示。ω越大,则μ减小速度越大。将ω分别设定为0、0.000 3、0.000 6和0.000 8 h-2,进行酵母的指数补料培养,当累计补料体积达到560 mL时结束培养。ω对酵母生产效率的影响如图4所示。在0~0.000 8 h-2的ω范围内,最终生物量、酵母收率和生产速度的实验值均小于计算值。在理论计算中,因为酵母收率和培养基消耗量均为定值,所以最终生物量和酵母收率的计算值与ω的大小无关,分别保持在82.6 g/L和40.1%。而在实际上,ω=0(即C-μ-EF策略)时,最终生物量和酵母收率的测定值分别仅为61.2 g/L和29.8%。最终生物量和酵母收率的测定值随ω的增大而逐渐上升,当ω=0.000 8 h-2时分别上升到77.5 g/L和38.0%,比ω=0时分别增加了26.7%和27.5%。
图4中,酵母生产速度的实验值和计算值都随ω的增大逐渐下降。但另一方面,实验值和计算值的差别随ω的增大逐渐缩小。其原因是酵母收率的实验值随ω的增大逐渐上升,酵母生产速度实验值的下降幅度较小。酵母生产速度的实验值和计算值在ω=0时分别为0.9和1.2g/(L·h),在ω=0.000 8 h-2时均下降到0.8 g/(L·h)。

图4 ω对酵母生产效率的影响Fig.4 Effect of ω on the yeast production efficiency
3.3累计补料体积对酵母生产效率的影响
累计补料体积表示指数补料培养的延续性。在式(6)中ω=0(即C-μ-EF策略)和ω=0.000 8 h-2(即LR-μ-EF策略)的条件下,将累计补料体积分别设定为200、300、400、560 mL,进行酵母培养。累计补料体积对酵母生产效率的影响如图5所示。在2种不同策略的培养中,最终生物量(CCF)均随累计补料体积的增大呈上升趋势。当累计补料体积从200 mL增加到560 mL时,ω=0条件下的最终生物量从43.4 g/L上升到61.2 g/L,而ω=0.000 8 h-2条件下的最终生物量从46.7 g/L上升到77.5 g/L。与ω=0条件相比,ω=0.000 8 h-2条件下最终生物量的上升幅度较大。与最终生物量相反,酵母收率(YC/S)随累计补料体积的增大呈下降趋势。当累计补料体积从200 mL增加到560 mL时,ω=0条件下的酵母收率从36.2%下降到29.8%,而ω=0.000 8 h-2条件下的酵母收率从40.9%下降到38.0%。与ω=0条件相比,ω=0.000 8 h-2条件下酵母收率的下降幅度较小。
图5中,酵母生产速度(RC)在ω=0和ω=0.000 8 h-2条件下与累计补料体积无关,基本保持在0.8 g/(L·h)。
由上述可见,在200~560 mL的累计补料体积范围内,LR-μ-EF策略与C-μ-EF策略相比,可提高最终生物量和酵母收率,同时保持酵母生产速度基本不变。

图5 累计补料体积对酵母生产效率的影响Fig.5 Effect of overall feeding volume on the yeast production efficiency
ATASOY等[2]认为,在面包酵母的培养中需要从基质和空气供给速度的两方面限制乙醇生成,提高生物量。他们将基质和空气供给的动态方程转换成非线性规划问题,并建立了控制矢量的优化演算方法,为动态发酵操作提供了理论依据。CHOPDA等[6]采用基于TCP/IP协议的解耦几何控制器(decoupled input-output linearizing controller,DIOLC)进行面包酵母培养中葡萄糖和溶氧的动态控制,使得最终生物量比采用PID控制器时提高了23%。DIOLC控制器对基质和溶氧控制更加精细,有助于生物量的最大化。与此相比,本研究提出的LR-μ-EF策略,显示了操作方便、酵母生产效率高的特点。
酵母生产效率不仅与补料策略有关,而且受菌种、发酵罐等多种因素的影响。目前的酵母工业化生产中,通常根据培养液中葡萄糖和乙醇的浓度来进行补料速度的反馈控制。可以推测,采用本研究提出的补料策略,同时结合发酵液中葡萄糖、乙醇浓度等测定值实时监测培养系统状态,调整补料速度,则可进一步提高酵母生产效率。
4 结论
提出一种新的LR-μ-EF策略,并采用该策略进行抗冻酵母S.cerevisiaeAFY-1的3 L发酵罐培养试验。得到的结论如下:
(1)当C-μ-EF培养阶段的μ为0.05 h-1、LR-μ-EF培养阶段的μ减小速度为0.000 8 h-2时,罐内葡萄糖和乙醇浓度无上升,溶氧始终维持在30%以上,生物量的实验值与计算值基本一致。
(2)在累计补料体积560 mL的条件下,最终生物量和酵母收率随着μ减小速度的增大而逐渐上升。当μ减小速度为0.000 8 h-2时,最终生物量和酵母收率分别为77.5 g/L和38.0%,与μ减小速度为0(即C-μ-EF策略)时相比分别增加了26.7%和27.5%。酵母生产速度基本与μ减小速度无关,保持在0.8~0.9 g/(L·h)范围。
(3)当累计补料体积从200 mL增加到560 mL时,最终生物量和酵母收率在μ减小速度0.000 8 h-2的条件下分别增加和减少30.8 g/L、2.9%,而在μ减小速度0的条件下分别增加和减少17.8 g/L、6.4%。酵母生产速度与累计补料体积无关。
[1]SERIO M D,TESSER R,SANTACESARIA E.A kinetic and mass transfer model to simulate the growth of baker’s yeast in industrial bioreactors[J].Chemical Engineering Journal,2001,82:347-354.
[2]ATASOY I,YUCEER M,BERBER R.Optimisation of operating conditions in fed-batch baker’s yeast fermentation[J].Chemical & Process Engineering,2013,34(1):175-186.
[3]赵小丽,甄玉国,王兰惠,等.酿酒酵母发酵条件的研究[J].中国酿造,2014,33(6):75-78.
[4]YEE L,BLANCH H W.Recombinant trypsin production in high cell density fed-batch cultures inEscherichiacoli[J].Biotechnology & Bioengineering,1993,41(8):781-790.
[6]CHOPDA V R,RATHORE A S,GOMES J.Maximizing biomass concentration in Baker’s yeast process by using a decoupled geometric controller for substrate and dissolved oxygen[J].Bioresource Technology,2015,196:160-168.
[7]洒荣波.基于重组巴斯德毕赤酵母高密度培养研究[D].无锡:江南大学,2005:38-49.
[8]梁国斌.产朊假丝酵母生产谷胱甘肽过程控制与优化[D].无锡:江南大学,2008:24-31.
[9]聂敏.发酵法生产谷胱甘肽及其高产策略研究[D].苏州:苏州大学,2010:24-32.
[10]LEE J,LEE S Y,PARK S,et al.Control of fed-batch fermentations[J].Biotechnology Advances,1999,17(1):29-48.
[11]王兰,肖冬光.利用制糖废蜜流加培养酵母的动力学研究[J].生物技术,2004,14(4):43-46.
[12]于景芝.酵母生产与应用手册[M].北京:中国轻工业出版社,2008:79-82.
[13]康远军.高耐性鲁氏酵母高密度发酵研究[D].武汉:湖北工业大学,2015:35-41.
[14]HOEK P V,HULSTER E D,DIJKEN J P V,et al.Fermentative capacity in high-cell-density fed-batch cultures of baker's yeast[J].Biotechnology & Bioengineering,2000,68(5):517-523.
[15]缪冶炼,时晓剑,陈玲,等.一株抗冻能力强的面包酵母及其在冷冻生胚加工中的应用: 中国, CN 103194401 A[P]. 2013-07-10. http://www2.drugfuture.com/cnpat/search.aspx.
[16]张昀羿,李元广,金建,等.SAM产生菌酿酒酵母HYS98发酵动力学及比生长速率控制策略[J].过程工程学报,2005(3):322-326.
[17]江学斌,林健聪,梁世中.毕赤酵母产木聚糖酶的动力学及流加策略[J].华南理工大学学报:自然科学版,2013(12):115-119.
[18]REYNDERS M B,RAWLINGS D E,HARRISON S T L.Studies on the growth, modeling and pigment production by the yeastPhaffiarhodozymaduring fed-batch cultivation[J].Biotechnology Letters,1996,18(6):649-654.
[19]江学斌.基于工业化生产的毕赤酵母高效表达木聚糖酶XYL1的研究[D].广州:华南理工大学,2013:72-88.
[21]LANDI C,PACIELLO L,ALTERIIS E D,et al.High cell density culture withS.cerevisiaeCEN.PK113-5D for IL-1β production: optimization, modeling, and physiological aspects[J].Bioprocess & Biosystems Engineering,2015,38(2):251-261.
Improvement of yeast production efficiency by an exponential feeding strategy based on linear reducing specific-growth-rates
JI Meng1, MIAO Ye-lian1*, CHEN Jie Yu2, YOU Ye-bing1,LIU Fei-long1, XU Lin3
1(College of Food Science and Light Industrial Engineering, Nanjing Technology University, Nanjing 211800, China)2(Faculty of Bioresource Science, Akita Prefectural University, Akita 010-0195, Japan)3(College of Biotechnology and Pharmaceutical Engineering, Nanjing Technology University, Nanjing 211800, China)
The production efficiency and cost of yeasts depend greatly on culture modes. A novel strategy for exponential feeding based on linear reducing specific-growth-rate (LR-μ-EF strategy) was proposed according to their growth characteristics. Fed-batch culture of freeze-tolerant yeastSaccharomycescerevisiaeAFY-1 was carried out in a 3L stirred tank bioreactor with the feeding strategy. The experimental values of biomass during culture were compared with calculated values. Then, the effects of feeding rate and overall feeding volume on yeast production efficiency were discussed, where the yeast production efficiency was evaluated based on final biomass, yeast yield and production rate. When the specific-growth-rate (μ) was 0.05 h-1in constant-μexponential feeding (C-μ-EF) culture stage, and theμdecrease rate was 0.000 8 h-2in LR-μ-EF culture stage, the experimental values of biomass agreed well with the calculated values. Under the condition of an overall feeding volume at 560 mL, the biomass and the yeast yield increased with the increasing ofμdecrease rate, and reached 77.5 g/L and 38.0% at theμdecrease rate of 0.000 8 h-2, respectively, which respectively increased by 26.7% and 27.5% in comparison with those in the culture withμdecrease rate of 0 (i.e. C-μ-EF strategy). In addition, the yeast production rate had no significant relationship withμdecrease rate, and fluctuated in the range of 0.8-0.9 g/(L·h). The results demonstrated superior capability of LR-μ-EF strategy for the improvement of yeast production efficiency, and provide useful information for the industrial production of yeasts.
yeast; batch culture; feeding strategy; specific growth rate; production efficiency
10.13995/j.cnki.11-1802/ts.201609006
硕士研究生(缪冶炼教授为通讯作者,E-mail:ylmiao@njtech.edu.cn)。
国家重点基础研究发展计划(2011CBA00807)
2016-03-21,改回日期:2016-04-27

