高效液相色谱-串联质谱法同时测定饲料中9种霉菌毒素及其代谢物
庄 倩, 曲宝涵, 李 彦, 吴 燕, 穆阿丽, 李 辉
(1.青岛农业大学化学与药学院,山东青岛 266109;2.青岛市饲料兽药检测站,山东青岛 266071)
霉菌毒素是真菌在谷物或饲料上生长繁殖过程中产生的有毒二次代谢产物,其种类繁多,在收获、存储或加工过程中只要条件适宜都有可能产生。霉菌毒素的物理性质非常稳定,它可长时间留存在饲料、粮食等作物中,动物摄入含有霉菌毒素的饲料后可使其组织器官受损,甚至诱发癌变,而受其污染的食物也严重影响着人体健康乃至危及生命[1,2]。据统计,世界上大约有25%的谷物遭受各种霉菌污染,而且随着全球饲料谷物贸易的增加,动物饲料中不同产地谷物混合的机会增加,进而导致饲料中同时含有多种霉菌毒素的几率大大提高。因此,研究霉菌毒素的检测方法日益受到人们的重视。近年来,霉菌毒素检测有薄层色谱法、酶联免疫法、高效液相法和液质联用法等方法[3 - 6]。传统的薄层色谱法检测种类单一而且前处理步骤繁琐,酶联免疫法虽简便快速但是易受杂质干扰影响定量结果。
高效液相色谱法和液-质联用技术是目前常用的霉菌毒素的分析检测方法,其中液-质联用法具有选择性高、灵敏度好、可同时完成多组分检测的优点。本实验建立了一种对饲料中9种霉菌毒素及其代谢物同时检测的高效液相色谱-串联质谱(HPLC-MS/MS)方法,为霉菌毒素检测提供参考。
1 实验部分
1.1 仪器与试剂
1200 Series液相色谱仪,6410 Triple Quad LC/MS串联质谱仪(美国,Agilent公司);Agilent C18柱(150×2.1 mm,3.5 μm);Techcomp CT15RT型台式高速冷冻离心机;IKAMS 3 Basic微型振荡器;HY-6双层调速振荡器;KQ-250B超声波清洗器;Organomation Associates 5085型氮吹仪。
甲醇、乙腈、正己烷(色谱纯,美国Sigma-Alorich公司);乙酸铵(色谱纯,英国Alfa Aesar公司);甲酸(色谱纯,天津市科密欧化学试剂有限公司);NaCl(分析纯,天津市科密欧化学试剂有限公司)。实验用水为去离子水。
标准品(纯度>98%):黄曲霉毒素B1、B2、G1、G2均购自Supelco公司。T-2毒素、HT-2毒素、玉米赤霉烯酮均购自Pribolab公司,β-玉米赤霉烯醇和β-玉米赤霉醇购自Sigma公司。标准品储备液:黄曲霉毒素B1、B2为液体标准品,浓度为3 μg/mL。黄曲霉毒素G1、G2、T-2毒素、HT-2毒素、玉米赤霉烯酮、β-玉米赤霉烯醇和β-玉米赤霉醇为固体标准品,将其分别用乙腈溶解定容,浓度为10 mg/L,于-20 ℃保存。标准品中间液:分别移取黄曲霉毒素B1、B2、G1、G2、T-2毒素、HT-2毒素、玉米赤霉烯酮、β-玉米赤霉烯醇和β-玉米赤霉醇适量,用甲醇稀释,配成1 μg/mL的标准品中间液,备用。
1.2 样品前处理
称取5.0 g样品于50 mL离心管中,加入1 g NaCl和25 mL乙腈-水(85∶15),振荡20 min后涡旋混匀30 s,在10 000 r/min下离心5 min。移取5 mL上清液以稳定流速过TC-M160多功能净化柱(时间不少于60 s),抽干,流出液收集于刻度试管中,于60 ℃下氮气吹干。残渣加1 mL乙腈-水(1∶1),涡混30 s溶解,过0.22 μm滤膜后,上机待测。
1.3 色谱及质谱条件
色谱条件:色谱柱:Agilen C18柱(150×2.1 mm,3.5 μm);流动相:A:水(0.1%甲酸+5 mmol/L乙酸铵),B:甲醇(0.1%甲酸);梯度洗脱程序为:0~0.5 min,10%B;0.5~3.0 min,10%~40%B;3.0~6.0 min,40%~45%B;6.0~12.0 min,45%~95%B;12.0~14.0 min,95%B;14.0~14.1 min,95%~10%B;14.1~20.0 min,10%B。柱温:40 ℃;流速:0.3 mL/min;进样量:10 μL。
质谱条件:离子源:ESI;扫描方式:采用正负离子同时扫描,黄曲霉毒素类、T-2毒素和HT-2毒素为正离子监测模式,玉米赤霉烯酮及其代谢物为负离子监测模式;雾化气:氮气;离子喷雾电压:3 500 V(+)/3 500 V(-);雾化气温度及流量:350 ℃、9 L/min;喷雾器压力:35 psi;鞘流气温度及流量:350 ℃、11 L/min。
2 结果与讨论
2.1 提取溶剂及溶剂比例的选择
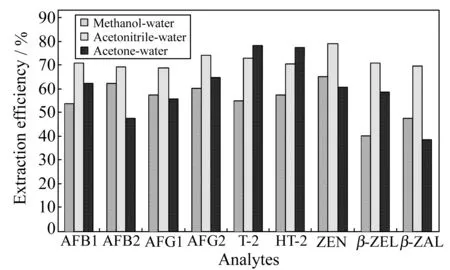
图1 三种提取溶剂对待测物的提取率(添加20 μg/kg)Fig.1 Extraction efficiency of the analytes in three extraction solvents(add 20 μg/kg)
现行我国国家标准[7,8]均采用高效液相色谱法对单一种类的霉菌毒素进行检测,前处理用乙腈-水进行提取。有一些研究者曾对不同溶剂提取进行比较[9 - 12]。本实验分别采用乙腈-水、甲醇-水和丙酮-水作为提取溶剂对样品进行提取。由图1可知,乙腈-水的提取率最高,因此采用乙腈-水作为提取溶剂。
分别用体积比95∶5、90∶10、85∶15、80∶20、75∶25、70∶30的乙腈-水溶液进行提取,结果表明水的比例过大可能导致水溶性杂质增多且氮吹时间过长,而乙腈比例过大则会影响部分目标物的提取效果,当乙腈-水为85∶15时对各组分的提取效果最好。
2.2 净化柱的选择
黄曲霉毒素类、玉米赤霉烯酮及其代谢物、T-2毒素和HT-2毒素的性质结构差异大,但极性较弱,因此本实验选取了Pribolab的PriboFast®M226多功能净化柱、Waters的Oasis HLB固相萃取小柱和R-Biopharm的TC-M160多功能净化柱进行比较。结果表明,HLB柱的净化效果不是很理想,净化时吸附在柱上的部分非极性杂质也会被洗脱下来,影响测定结果。多功能净化柱的净化原理是采取多重复合填料吸附脂肪、蛋白质、色素及碳水化合物等干扰物质,可同时净化多种目标组分,经实验得出经M226柱净化后HT-2毒素、β-玉米赤霉烯醇和β-玉米赤霉醇的回收率较低,而TC-M160柱则均能使9种目标化合物得到良好的净化,因此采用TC-M160柱作为净化柱进行后续实验。
2.3 流动相的选择
大多数霉菌毒素易溶于甲醇或乙腈,所以本实验选择甲醇和乙腈作为流动相进行比较,为了利于正负离子模式下各组分的离子化,在流动相中加入0.1%甲酸和5 mmol/L乙酸铵。结果表明,反相色谱中乙腈极性小更易洗脱固定相上吸附的化合物,但是在正负离子同时扫描的模式下,出峰过快使得保留时间相近的组分不易分开,而且采用乙腈作为流动相时离子化程度比甲醇低,使其离子丰度下降,灵敏度也降低(图2),因此本实验采用甲醇作为流动相。进一步优化流动相的比例及梯度洗脱条件后,9种待测组分的色谱分离效果良好,而且分析时间在20 min以内(图3),可满足快速检测的目的。
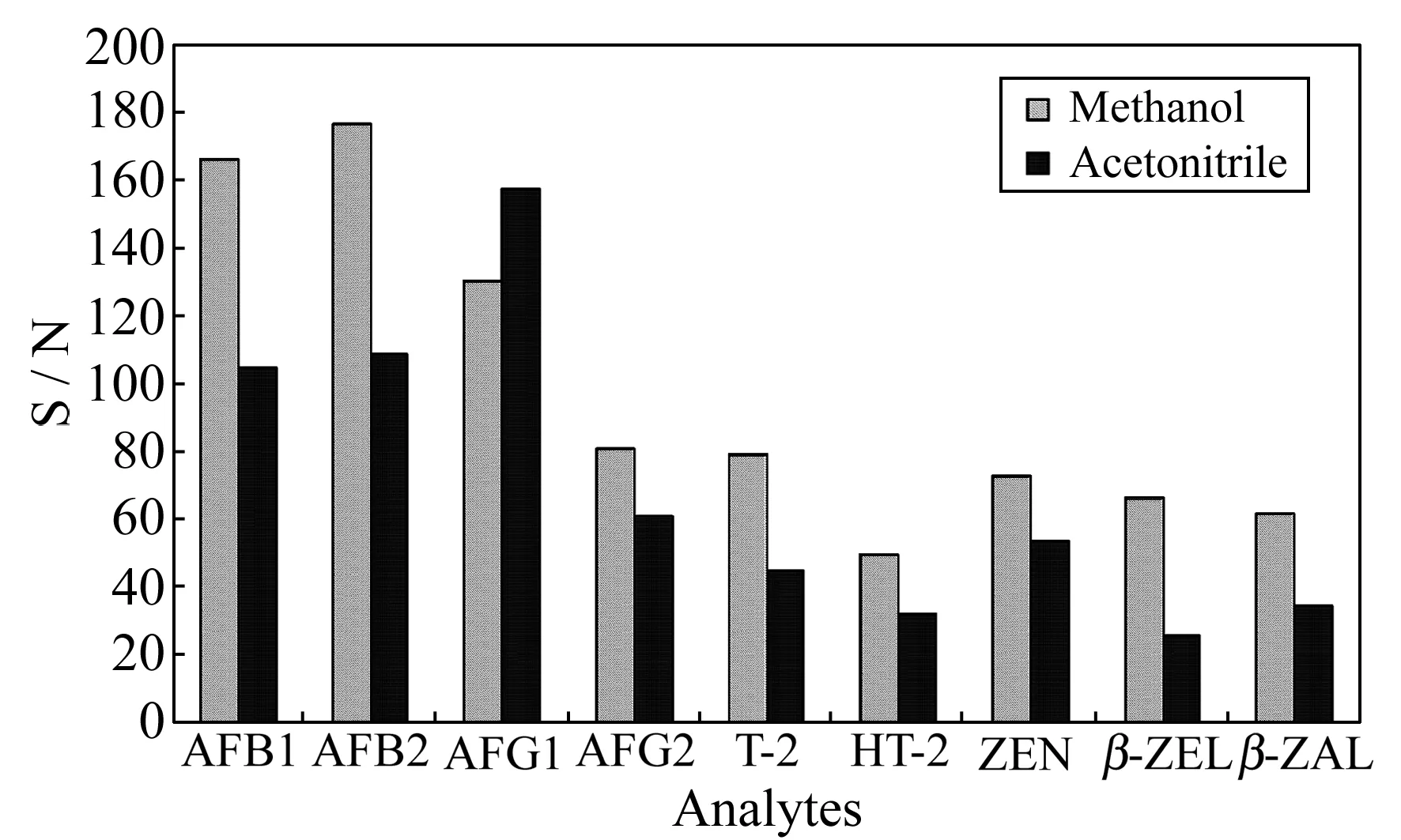
图2 不同流动相下待测物的信噪比(S/N)(添加10 μg/kg)Fig.2 Signal to noise ratio(S/N) by using different mobile phases(add 10 μg/kg)
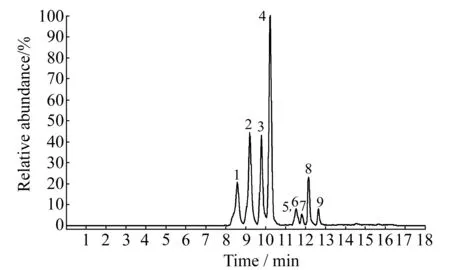
图3 霉菌毒素及其代谢物的总离子流(TIC)色谱图Fig.3 TIC chromatograms of mycotoxins and metabolins1.Aflatoxin G2;2.Aflatoxin G1;3.Aflatoxin B2;4.Aflatoxin B1;5,6.HT-2 toxin,β -Zearalanol;7.β -Zearalenol;8.T-2 toxin;9.Zearalenone.
2.4 质谱条件的优化
黄曲霉毒素类、T-2毒素及HT-2毒素这几种目标化合物在正离子扫描过程中形成加氢准分子离子峰进而在碰撞时碎裂生成子离子;而玉米赤霉烯酮类由于结构中的羟基会使其在质谱检测时容易失去质子,产生[M-H]-的分子离子,因此本实验采用正负离子同时扫描的多反应检测模式进行检测。质谱检测时,通过碎裂电压(Fragmentor)来控制碰撞诱导解离(CID),碎裂电压过低会影响母离子传输效率,过高则使母离子在传输时发生解离降低其灵敏度。另一参数碰撞能量(CE)则影响碎片离子峰,过低时离子难以分解;过高又会使离子碎裂过多,干扰检测。因此,本实验经全扫描确定母离子的质荷比,在单离子检测模式下优化碎裂电压,确保母离子尽可能多的到达碰撞池,再由子离子扫描确定最丰富及最稳定的子离子,最终在多离子检测(MRM)模式下找到最大响应值时的碰撞能量。优化的各项质谱参数见表3。9种霉菌毒素及其代谢物均能得到较好的分离,其结果符合欧盟2002/657/EC号决议《质谱分析方法鉴定点数》[13]中对待测物定性及定量的要求。
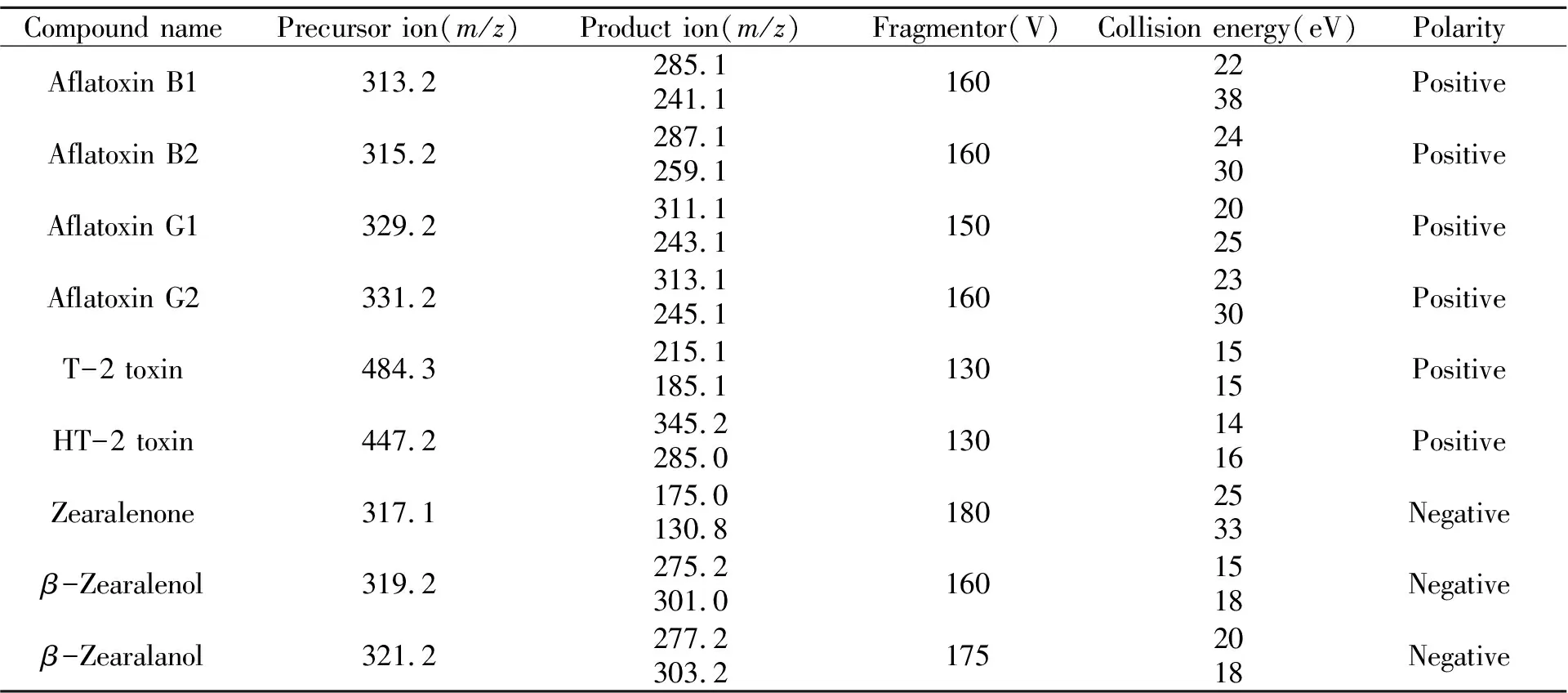
表3 9种霉菌毒素及其代谢物的质谱优化条件
2.5 标准曲线、检出限和定量限
饲料中的基质成分复杂,会对霉菌毒素的分析过程有显著干扰,并影响分析结果的准确性,因此本研究在绘制标准曲线时配制与检测样品相同基质的混合标准系列工作液,其浓度为2、5、10、20、50、100 μg/L。然后以9种霉菌毒素定量离子的峰面积(y)对浓度(x,μg/L)梯度绘制标准曲线,结果表明被测霉菌毒素及其代谢物在2.0~100 μg/L范围内线性关系良好。按照1.2节的方法对样品处理后上机检测,以3倍信噪比(S/N=3)为检出限(LOD),10倍信噪比(S/N=10)为定量限(LOQ)的结果见表4。

表4 霉菌毒素及其代谢物的线性方程、相关系数、检出限和定量限(n=6)
2.6 方法回收率和精密度
饲料的种类多种多样,其中的成分也有所不同,因此本实验分别对饲喂时常用的玉米粉、猪用配合饲料和肉鸡肉鸭自配料添加了5、20、50 μg/L 3个浓度水平混标溶液做加标回收率实验,根据相应基质外标曲线定量,再就其精密度(RSD)进行考察。通过表5的计算结果可知,其回收率在67.5%~103.5%之间,日内和日间的相对标准偏差(RSD)均不大于15%,表明方法精密度良好。
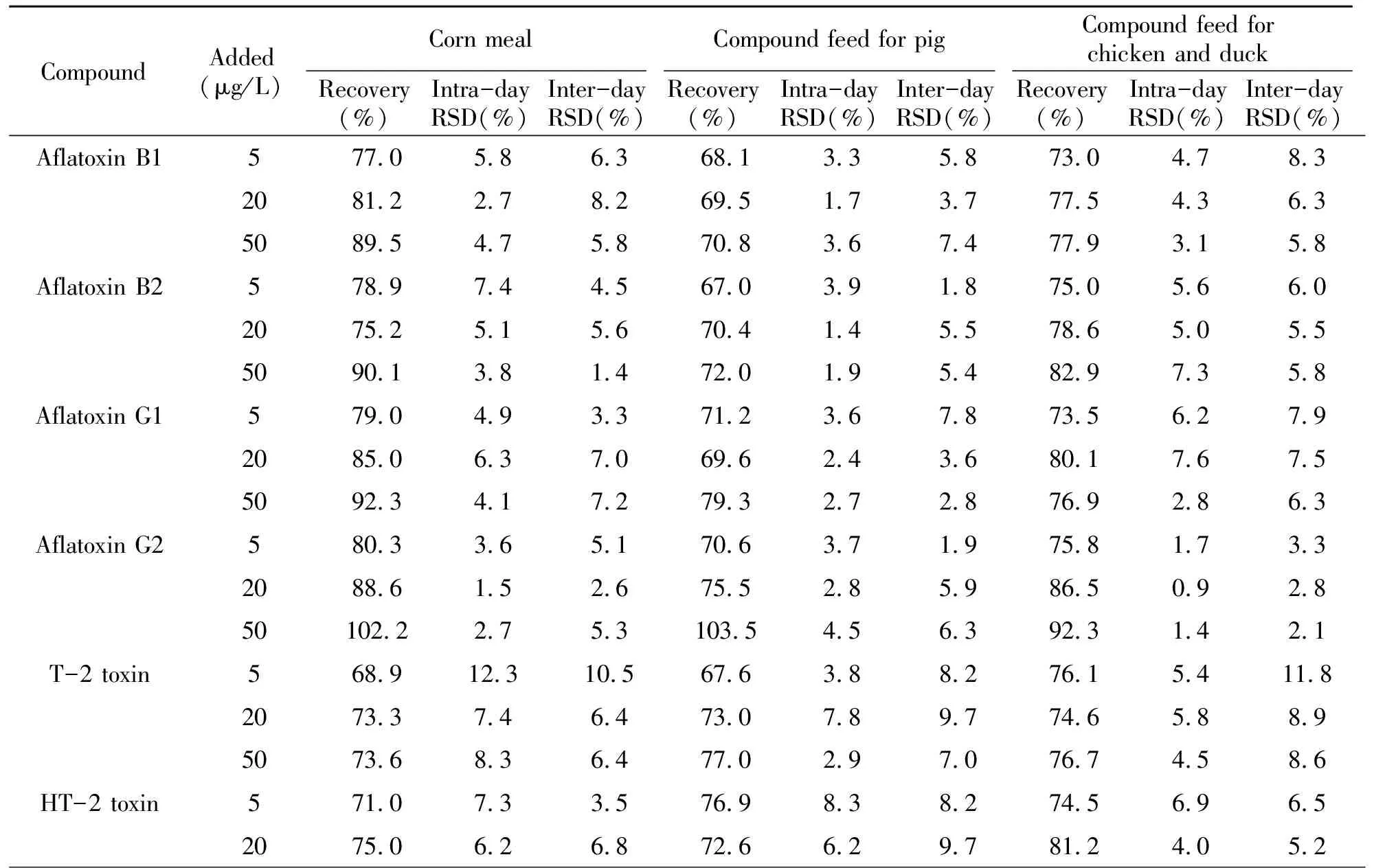
表5 不同种类饲料的加标回收率及精密度(n=3)
(续表5)

CompoundAdded(μg/L)Corn mealCompound feed for pigCompound feed for chicken and duckRecovery(%)Intra-dayRSD(%)Inter-dayRSD(%)Recovery(%)Intra-dayRSD(%)Inter-dayRSD(%)Recovery(%)Intra-dayRSD(%)Inter-dayRSD(%)5074.77.73.785.07.611.277.93.94.6Zearalenone575.34.31.784.03.95.375.35.35.020101.65.52.978.72.38.078.15.94.85083.82.80.895.96.87.482.44.45.7β-Zearalenol567.53.25.370.88.010.969.35.511.42075.62.36.272.02.810.380.07.15.35078.09.32.774.87.97.879.17.18.4β-Zearalanol568.811.98.970.28.914.871.66.710.12069.27.55.867.91.410.877.95.613.95075.16.86.375.22.37.781.75.610.7
2.7 稳定性和重复性实验
取空白猪用配合饲料作为基质按1.2节方法配制10 ng/mL混合标准溶液,在0、5、10、15、20、25、30 h内分别进样测定,9种霉菌毒素的RSD在3.2%~8.7%之间,说明饲料基质对标准品溶液基本没有干扰,基质标准溶液的稳定性好。
再称取空白饲料样品5.0 g,平行取样6份,精密加入中间浓度的9种霉菌毒素混标溶液适量,按1.2节方法处理后进样分析,根据峰面积计算得出9种霉菌毒素的RSD为3.9%~10.4%,说明该方法的重复性良好。
2.8 样品检测
经本实验建立的方法对实验室存储的83份饲料样本进行检测,每份平行两次实验,其中7份样本测出含有黄曲霉毒素B1 2.6~13.8 μg/L,19份样本中含有T-2毒素6.9~24.5 μg/L,16份样本中含有玉米赤霉烯酮5.1~42.7 μg/L。
3 结论
研究结果表明,采用多功能净化柱净化可同时净化多种霉菌毒素,前处理步骤简便快速,再结合液质联用法采用正负离子同时扫描,缩短了分析检测时间,而且方法稳定性好,回收率高。该法还可应用于豆粕、浓缩料、鱼粉等多种饲料,其检出限满足国内外标准的限量要求,为霉菌毒素的检测分析提供了技术支持。

