晚期骨关节炎患者膝关节软骨下松质骨祖细胞的特性研究
蒋超 王以朋 邱贵兴 吴志宏 翁习生
(中国医学科学院北京协和医学院北京协和医院骨科,北京100730)
·基础研究·
晚期骨关节炎患者膝关节软骨下松质骨祖细胞的特性研究
蒋超王以朋邱贵兴吴志宏翁习生*
(中国医学科学院北京协和医学院北京协和医院骨科,北京100730)
背景:骨关节炎(osteoarthritis,OA)又名退行性骨关节病,对其治疗目前局限于早期的保守治疗和晚期的关节置换。晚期OA患者软骨下是否具有间充质干细胞(mesenchymalstem cells,MSCs)决定了骨髓刺激技术可否用于晚期软骨缺损为主要表现的OA患者。但晚期OA患者软骨下松质骨是否具有MSCs仍不明确。目的:探讨晚期OA患者膝关节软骨下是否具有成软骨分化能力的松质骨祖细胞,为晚期膝OA患者软骨自身修复的研究奠定基础。方法:5例因晚期膝OA行全膝关节置换术患者的术中标本,取其软骨下松质骨,经分离培养后得到贴壁细胞,传代培养后行流式细胞仪分析细胞表面抗原;成骨、成脂、成软骨分化后分别行碱性磷酸酶活性检测、茜素红染色、油红O染色、阿利新蓝、Ⅱ型胶原和聚蛋白聚糖组织化学染色,Ⅰ型胶原、Ⅱ型胶原、聚蛋白聚糖及SOX-9基因表达水平实时聚合酶连反应(Real-Time PCR,RT-PCR)测定。结果:从晚期膝OA患者膝关节软骨下松质骨内获得的贴壁细胞的细胞表面抗原基本符合MSCs标准,且具有成骨、成脂、成软骨分化能力。结论:晚期OA患者软骨下存在具有干细胞性质、可进行体外成软骨分化的松质骨祖细胞。该发现可为“一步式——微骨折处理-成软骨诱导材料填充-软骨修复”治疗理念提供一定依据。
骨关节炎;间质干细胞;软骨细胞
【Abstract】Background:Bonemarrow stimulation can be used in end-stage osteoarthritis patients in w hom cartilage defects mainly presents only when there weremesenchymal stem cells(MSCs)in the subchondral zone of the knee.But the existence of MSCs in the end-stage osteoarthritis patients is still unknown.Objective:To analyzemulti-differentiation capacity of cells derived from human subchondral bone in patientsw ith end-stage knee osteoarthritis.Methods:Human progenitor cellsw ere isolated and derived from subchondral cortico-spongious bone chips from 5 patientsundergoing total knee arthroplasty due to end-stage osteoarthritis.Mesenchymalstem cell related cell surface antigenswere analyzed by flow cytometry. A fter in vitro osteogenic,adipogenic and chondrogenic differentiation,alkaline phosphatase activity,Alizarin red staining,Oil Red O staining,A lcian blue staining and immunohistochem ical staining for collagenⅡand Aggrecan w ere conducted. Real-time PCRwasperformed to confirm related geneexpression of chondrogenic differentiation,such ascollagenⅠ,collagenⅡ,Aggrecan and SOX-9.Results:Surface antigens of successfully-cultured cells from subchondral cortico-spongious bone chipsw ere almost in accord w ith those of MSCs.And the cells had the ability of osteogenic,adipogenic and chondrogenic differentiation.Conclusions:Multi-potential progenitor cells do exist in subchondralbone in the kneeof patientswith end-stageosteoarthritis.
【Keywords】Osteoarthritis;Mesenchymal Stem Cells;Chondrocytes
骨关节炎(osteoarthritis,OA)又名退行性骨关节病,是世界范围内的慢性致残性疾病之一[1]。其具体发病机制目前尚不清楚,但关节面软骨破坏是其主要病理改变。目前对于晚期OA患者,行关节置换术是缓解疼痛、改善关节功能的唯一有效治疗方案,但存在严重不良反应等风险。对于早期OA及其他病因导致的软骨缺损,临床上多采用骨髓刺激技术比如微创微骨折处理[2,3],该技术通过打通骨髓和软骨缺损表面,帮助间充质干细胞(mesenchymalstem cells, MSCs)从骨髓迁移到软骨缺损区进行成软骨分化,从而修复缺损区。尽管既往的临床经验和研究不建议该技术用于晚期OA患者的治疗[4,5],但随着近些年国内外对MSCs的研究越来越深入,各种促软骨分化诱导因子和材料被发现,使通过细胞组织工程技术修复晚期OA患者软骨缺损成为可能[6-13]。如能证实晚期OA患者关节软骨下存在具有成软骨分化能力的松质骨祖细胞,将为该治疗方法提供进一步的基础和理论依据,从而提供可能的“一步式——微骨折处理-成软骨诱导材料填充-软骨修复”治疗方法。所谓“一步式”,即一次关节镜操作下完成软骨缺损区的材料填充,而不需要通过骨髓获取间充质干细胞,体外培养后再植入关节腔内的多次操作。
1 材料与方法
1.1实验研究对象
选取2013年10月至2013年12月行全膝关节置换术的晚期OA患者5例,其中男2例,女3例;年龄54~79岁,平均67岁;OA诊断均符合美国风湿病学会膝骨关节炎临床诊断标准[14],所有患者除外肿瘤、全身感染、类风湿关节炎、血友病性关节炎等,术前12个月未进行过有创的关节腔内治疗,未长期使用包括激素、免疫抑制剂等药物,无长期抽烟、酗酒等。本实验使用手术废弃组织,已通过北京协和医院临床试验伦理委员会同意。入组患者信息见表1。
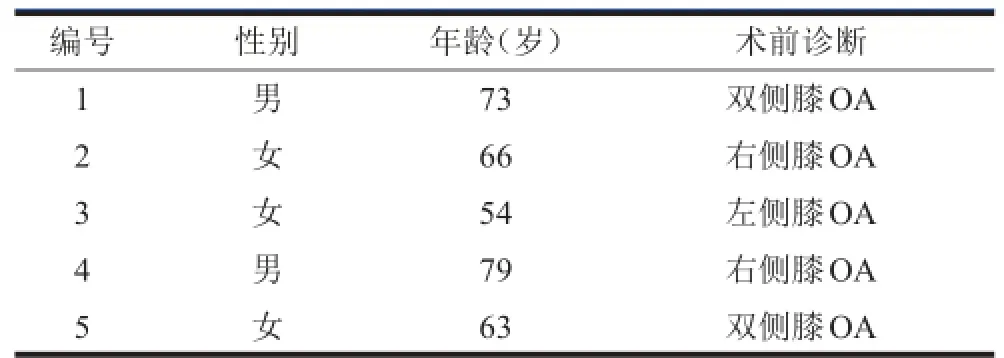
表1 入组患者基本资料
1.2主要实验试剂、仪器
人成脂肪、成骨、成软骨诱导培养基(R&D公司,美国);人MSCs专用培养基(Science Cell公司,美国);小鼠抗人CD146、CD45、CD90等荧光标记的流式检测抗体(BD公司,美国);小鼠抗人聚蛋白聚糖(Aggrecan)抗体、Ⅱ型胶原抗体、Ⅰ型胶原抗体(Abcam公司,美国);茜素红、阿利新蓝、油红O染色试剂盒(Sigma公司,美国);碱性磷酸酶检测试剂盒(南京建成生物工程研究所);实时聚合酶连反应(Real-Time PCR,RT-PCR)相关产品(Takara公司,日本);流式细胞仪(BD公司,美国)。
1.3软骨下松质骨祖细胞分离及培养
在无菌条件下用咬骨钳将膝关节表面置换术中所截取胫骨平台及股骨髁软骨下松质骨处理成2~3mm大小的骨颗粒,经PBS反复清洗除去表面所附脂肪、血液等异物。将松质骨颗粒置于25 cm2培养瓶,加入7m l含10%胎牛血清、100U/m l青霉素、100mg/m l链霉素、2mmol/L L-谷氨酰胺的DMEM-高糖培养基,轻轻晃动使松质骨颗粒均匀平铺。37℃、5%CO2培养箱中培养4~6 d,期间不换液,直至显微镜下可见骨组织周围出现一定数量的梭状贴壁细胞时进行第1次换液,并且用PBS清洗除去松质骨颗粒,改用MSCs增殖培养基,每3 d换一次液。7~9 d后原代细胞铺满瓶底90%左右,以0.25%胰蛋白酶消化,进行细胞传代或冻存。取第1代细胞进行细胞表面抗原流式检测,第3代细胞行成骨、成脂、成软骨诱导分化。
1.4细胞表面抗原流式细胞仪检测
取第1代细胞经PBS清洗2次,PBS重悬浓度1×105个/μL,冰上操作,加适量小鼠抗人CD14-FITC、CD19-APC、CD34-FITC、CD44-PE、CD45-PE、CD73-PE、CD90-APC、CD105-FITC、CD146-PE、CD166-PE、HLA-DR-APC等抗体,4℃孵育30m in,用同种同型非相关IgG抗体孵育作为阴性对照。孵育完成后用含1%牛血清白蛋白的PBS清洗细胞2次,再将细胞重悬于200μL PBS上机检测。
1.5成骨、成脂、成软骨诱导分化
1.5.1成骨、成脂诱导分化:取第3代细胞(n=5例),胰酶消化后重悬计数,参考成骨、成脂肪分化培养基说明书,以5×104个/孔的密度接种于含有细胞爬片的24孔板中,MSCs增殖培养基培养细胞贴壁汇合至70%~80%后改为添加成骨诱导因子的成骨诱导培养基培养,每3 d换液一次,同时设以干细胞增殖培养基培养的细胞为阴性对照,所加培养基量和操作均保持一致。诱导21 d后4%多聚甲醛固定,行茜素红染色及碱性磷酸酶活性测定。同样方法消化、计数、接种细胞与24孔板,MSCs增殖培养基培养细胞贴壁汇合至90%~100%后改添加成脂诱导因子的成脂诱导分化培养基,同时设以干细胞增殖培养基培养的细胞为阴性对照,每3 d换液一次,直至诱导21 d,行油红O染色检测。
1.5.2成软骨诱导分化:参考微球培养法[15],同上方法将细胞以2.5×105个/孔浓度接种与含0.2m l干细胞增殖培养基的U-型底96孔板中,室温、200 g离心5m in,随即置于37℃、5%CO2培养箱过夜。24 h后通过200μL移液枪沿着孔壁轻轻吹打U-型底孔板内细胞薄膜层使其悬浮(注意勿破坏细胞层完整性),随后实验组改用含有成软骨诱导因子的成软骨诱导分化培养基,对照组为干细胞增殖培养基。37℃、5%CO2培养箱内培养,每3 d换液一次,在此过程中细胞微球逐渐形成。诱导培养28 d后行阿利新蓝染色,聚蛋白聚糖(aggrecan)、人Ⅱ型胶原免疫组织化学染色。同时将同组细胞微球收集后提取总RNA,RT-PCR测定成软骨相关基因Ⅱ型胶原、aggrecan、SOX-9和Ⅰ型胶原的表达量。
2 结果
2.1松质骨祖细胞形态及细胞表面抗原检测
原代松质骨祖细胞在培养4~6 d后逐渐从骨组织迁移至培养瓶,并贴壁生长,细胞呈梭状、成纤维细胞样形态(图1)。对第1代细胞行流式细胞仪检测,显示增殖后的松质骨祖细胞基本符合MSCs细胞表面抗原的相关特征[16],即细胞基本不表达CD14(0.24%)、CD19(0.96%)、CD34(0.47%)、CD45(0.95%)、HLD-DR(0.21%),高表达CD44(98.69%)、CD73(97.94%)、CD90(99.88%)、CD166(91.46%),且CD105(6.13%)、CD146(10.41%)亦呈阳性。
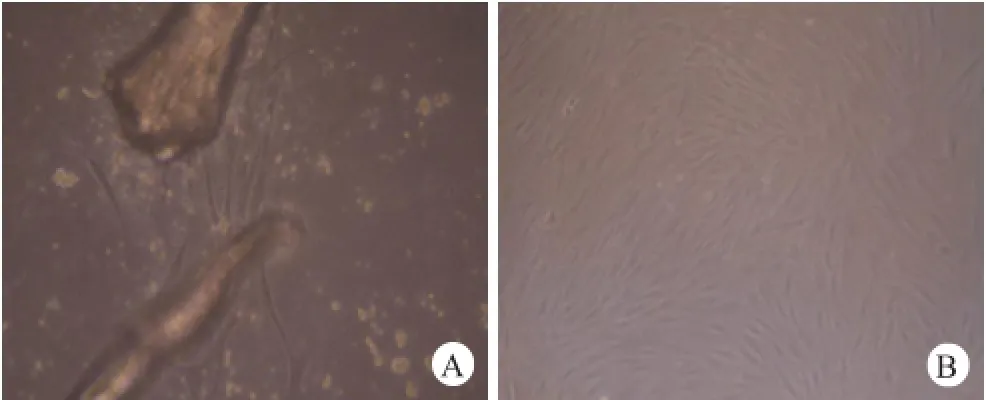
图1 A.原代松质骨祖细胞从骨组织迁出,贴壁生长(×400);B.第1次传代之前细胞状态为梭形,呈成纤维细胞样(×100)
2.2松质骨祖细胞成骨、成脂分化研究
将成骨、成脂肪诱导21 d的细胞及非诱导对照组细胞均分别进行茜素红染色和碱性磷酸酶活性监测以验证其成骨分化;通过油红O染色验证其成脂分化(图2)。对比分化诱导组和未诱导组,诱导分化组茜素红染色(图2A)和碱性磷酸酶活性染色均显示阳性(图2B),未分化组染色基本为阴性(图2D和2E);油红O染色也仅在诱导分化组为阳性(图2C)。显示该松质骨祖细胞具有明显的成骨、成脂分化潜能。
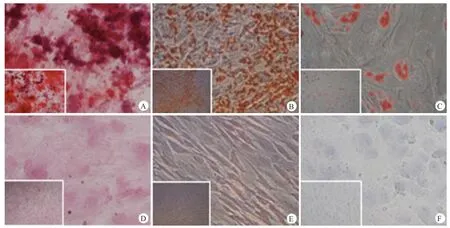
图2 松质骨祖细胞行成骨、成脂分化诱导组和未诱导组予分别行茜素红染色(A、D)、碱性磷酸酶活性染色(B、E)和油红O染色(C、F),显示诱导组染色均呈阳性,而未诱导组为阴性(×100)
2.3松质骨祖细胞成软骨分化研究
成软骨分化诱导组和未诱导组均通过微球培养法培养28 d,随后收集细胞微球包埋切片,行相关免疫组化染色和组织染色(图3)。分化诱导组阿利新蓝染色呈阳性(图3A),未诱导组为阴性(图3E),提示胞内有酸性黏蛋白的出现,是干细胞成软骨分化的可靠指标之一。同时,将组织切片行蛋白聚糖、Ⅰ型胶原和Ⅱ型胶原免疫组化染色,诱导组三者均成阳性(图3B、C、D);而未诱导组蛋白聚糖和Ⅱ型胶原免疫组化染色为阴性(图3F、H),Ⅰ型胶原免疫组化染色阳性(图3G)。
诱导28 d后将诱导组和未诱导组细胞微球分别予以提总RNA,RT-PCR检测Ⅰ型胶原、Ⅱ型胶原、Aggrencan、SOX-9基因的mRNA表达水平(图4),发现诱导组Ⅰ型胶原mRNA的表达较未诱导组下降,前者仅为后者的0.57倍;而Ⅱ型胶原、Aggrecan、SOX-9mRNA的表达较未诱导组显著升高,其中Ⅱ型胶原表达量前者为后者的88.11倍,Aggrecan表达量前者为后者54.04倍,SOX-9表达量前者是后者41.29倍。上述差异均有统计学意义(P<0.01)。相关基因RTPCR引物见表2。
3 讨论
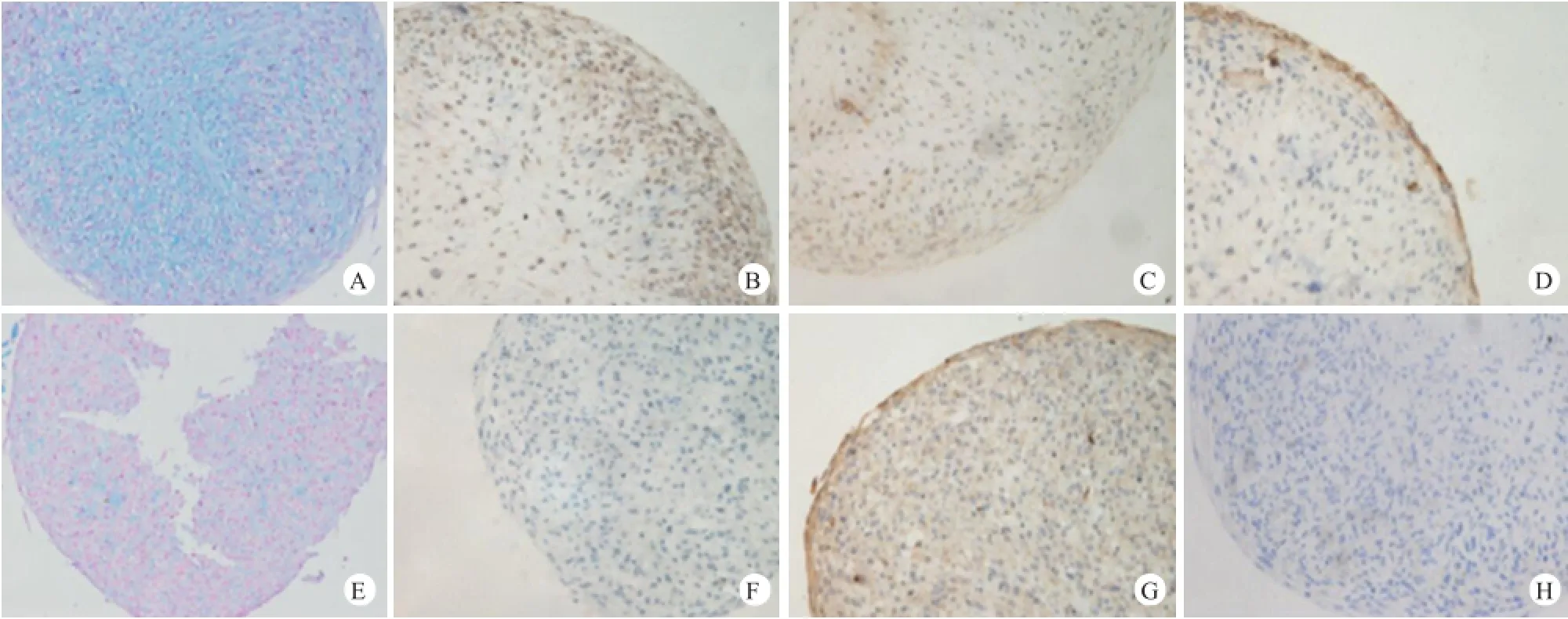
图3 松质骨祖细胞予成软骨分化诱导和未诱导培养28 d,行免疫组化染色和组织染色
MSCs的发现和深入研究[17-19]极大扩展了人们对干细胞的认识,也为临床上的组织/细胞工程学开拓了巨大的想象力。目前,在包括骨髓、软骨、滑膜、脂肪等各个人体组织内均已发现此类细胞的存在。诱导MSCs定向成软骨分化是目前国内外对其研究的热点之一[10-13]。软骨缺损亦是OA的主要病理改变,因此诱导MSCs成软骨分化来修复缺损区可能成为OA治疗的新方法。而相比于其他部位获取MSCs,通过关节镜下微骨折处理,使软骨下松质骨内此类细胞迁移至软骨缺损区,通过适当方法诱导其高效定向成软骨分化具有避免二次手术、简化治疗过程等优点。既往研究认为老年和晚期OA患者微骨折处理等方法治疗软骨缺损的效果不理想,不建议在此类人群中使用微骨折治疗方法[4,5]。但Scharstuhl等[20]通过对比研究不同人群来源骨髓MSCs分离所得,认为骨髓MSCs的数量和成软骨分化能力与年龄、OA严重程度无关,进而认为通过MSCs治疗OA软骨缺损是可能的。Neumann等[21]首次报道从健康人腓骨头松质骨内分离出具有成软骨分化能力的间充质祖细胞(mesenchymal progenitor cells,MPC),但鲜有文献报道关于从老年晚期OA患者软骨下松质骨内分离获得此类细胞。假设老年晚期OA患者关节软骨下松质骨内存在具有成软骨分化能力的祖细胞,可以在临床上通过微骨折处理,利用此类细胞进行“一步式”软骨修复,本研究对此进行了验证。
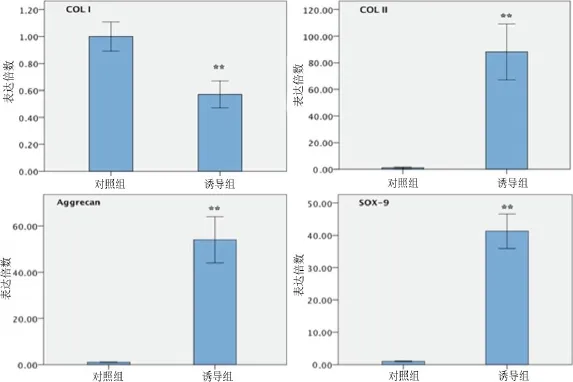
图4 松质骨祖细胞经28 d成软骨诱导分化培养后,RT-PCR提示Ⅰ型胶原基因表达水平下降;成软骨相关基因Ⅱ型胶原、aggrecan、SOX-9的表达水平上升,**P<0.01

表2 RT-PCR引物
流式细胞检测提示该松质骨祖细胞表面抗原表达CD73、CD90、CD105,不表达CD14、CD19、CD34、CD45、HLD-DR,符合目前关于MSCs细胞表面抗原的相关特性,但此类细胞的CD105表达较低,分析原因如下:①从松质骨中迁出的细胞并非单纯一个集落群;②可能与细胞培养状态和细胞传代等有关系。已有文献表明不同的培养基或者传代数的不同可以改变细胞表面抗原表达。本研究为模拟“一步式”微骨折-软骨修复治疗过程,未将细胞进行表面抗原分选后再诱导分化。此外,有文献报道CD105、CD166双阳性的滑膜来源细胞较阴性者具有更加明显的成软骨分化能力[22],是否也适用于松质骨祖细胞有待后续研究的进一步验证。
本研究将第3代细胞进行成骨、成脂、成软骨分化研究,通过相应的细胞染色、组织染色及免疫组化染色分析其分化结果。茜素红染色和碱性磷酸酶活性染色的阳性验证晚期OA患者软骨下松质骨祖细胞具有成骨分化能力;油红O染色阳性则证实其成脂分化能力。由于本实验重点关注晚期OA患者软骨下松质骨祖细胞成软骨分化能力,故对多个软骨分化相关标记物进行免疫组化染色,结果表明作为成软骨分化最主要的标志物Ⅱ型胶原、聚蛋白聚糖均出现在诱导后的细胞微球组织中,而成骨相关指标Ⅰ型胶原的染色较未分化组弱,提示细胞被成功向软骨细胞分化诱导。进而通过RT-PCR进一步验证Ⅱ型胶原、蛋白聚糖和SOX-9基因mRNA表达水平较未诱导组显著升高,SOX-9基因被认为与软骨形成密切相关,是证实细胞成软骨分化的可靠指标,而Ⅰ型胶原的基因表达量明显下降,该结果与免疫组化染色基本一致。由此确认未经细胞表面抗原分选的由胫骨平台下松质骨迁移出的祖细胞具有良好的成软骨分化能力。
综上,结合松质骨祖细胞的贴壁生长特性、细胞形态,细胞表面抗原分析,成骨、脂、软骨分化的多分化潜能,本研究认为晚期OA患者膝关节软骨下松质骨内仍有具成软骨分化能力的祖细胞,可为“一步式——微骨折处理-成软骨诱导材料填充-软骨修复”治疗理念提供一定依据。
[1]Centers for Disease Control and Prevention(CDC).Prevalence of disabilities and associated health conditions among adults--United States,1999.MMWR Morb Mortal Wkly Rep,2001,50(7):120-125.
[2]Pridie KH.A method of resurfacing osteoarthritic knee joints.JBone Joint Surg Br,1959,41:618-619.
[3]Steadman JR,RodkeyWG,Briggs KK,etal.Themicrofracture technic in the management of complete cartilage defects in the knee joint.Orthopade,1999,28(1):26-32.
[4]Williams RJ 3rd,HarnlyHW.Microfracture:indications,technique,and results.Instr Course Lect,2007,56:419-428.
[5]Bae DK,Yoon KH,Song SJ.Cartilage healing afterm icrofracture in osteoarthritic knees.Arthroscopy,2006,22(4): 367-374.
[6]Kulaw ig R,Krüger JP,K lein O,etal.Identification of fibronectin as amajor factor in human serum to recruit subchondral mesenchymal progenitor cells.IntJBiochemCellBiol, 2013,45(7):1410-1418.
[7]Endres M,Andreas K,Kalw itz G,et al.Chemokine profile of synovial fluid from normal,osteoarthritis and rheumatoid arthritis patients:CCL25,CXCL10 and XCL1 recruit human subchondralmesenchymal progenitor cells.Osteoarthritisand Cartilage,2010,18(11):1458-1466.
[8]Zhen G,Wen C,Jia X,etal.Inhibition of TGF-βsignaling in mesenchymal stem cells of subchondral bone attenuates osteoarthritis.NatM ed,2013,19(6):704-712.
[9]Singh P,Schwarzbauer JE.Fibronectin and stem cell differentiation-lessons from chondrogenesis.JCell Sci,2012,125(16):3703-3712.
[10]Majumdar MK,Wang E,Morris EA.BMP-2 and BMP-9 promoteschondrogenic differentiation of humanmultipotentialmesenchymal cells and overcomes the inhibitory effect of IL-1.JCell Physiol,2001,189(3):275-284.
[11]Carlberg AL,PucciB,RallapalliR,etal.Efficientchondro-genic differentiation of mesenchymal cells in micromass culture by retroviral gene transfer of BMP-2.Differentiation,2001,67(4-5):128-138.
[12]van der Kraan PM.TGF-βinduced chrondrogenicdifferentiation of bonemarrow-derived mesenchymal stem cells:role of smadsignalingpathways.//Stem Cells and Cancer Stem Cells.Springer Netherlands,2013:85-91.
[13]Brady K,Dickinson SC,Guillot PV,etal.Human fetal and adultbonemarrow-derivedmesenchymal stem cells use different signaling pathways for the initiation of chondrogenesis.Stem CellsDev,2013,23(5):541-554.
[14]Arnett FC,Edworthy SM,Bloch DA,et al.The American Rheumatism Association1987 revised criteria for the classification of rheumatoid arthritis.Arthritis Rheum,1988,31(3):315-324.
[15]SolchagaLA,Kitsie JP,WelterJF.Chondrogenic differentiation of bonemarrow-derived mesenchymal stem cells:tips and tricks.MethodsMol Biol,2011,698:253-278.
[16]Dom inici M,Le Blanc K,Mueller I,et al.M inimal criteria for definingmultipotentmesenchymalstromal cells.The International Society for Cellular Therapy position statement. Cytotherapy,2006,8(4):315-317.
[17]Colter DC,Class R,Digirolamo CM,etal.Rapid expansion of recycling stem cells in cultures of p lastic-adherent cells from human bonemarrow.Proc Natl Acad Sci USA,2000,97(9):3213-3218.
[18]Jiang Y,Jahagirdar BN,Reinhardt RL et al.Pluripotency of mesenchymal stem cells derived from adultmarrow.Nature,2002,418(6893):41-49.
[19]Owen M,Friedenstein AJ.Stromal stem cells:marrow-derived osteogenic precursors.Ciba Found Sym p,1988,136: 42-60.
[20]Scharstuhl A,Schewe B,Benz K,et al.Chondrogenic potential of human adultmesenchymal stem cells is independent of age or osteoarthritis etiology.Stem Cells,2007,25(12):3244-3251.
[21]Neumann K,Dehne T,EndresM,etal.Chondrogenic differentiation capacity of human mesenchymal progenitor cells derived from subchondral cortico-spongious bone.JOrthopRes,2008,26(11):1449-1456.
[22]Chang CB,Han SA,K im EM,et al.Chondrogenic potentials of human synovium-derived cells sorted by specific surfacemarkers.OsteoarthritisCartilage,2013,21(1):190-199.
Characteristicsof progenitor cells derived from subchondralcortico-spongiousbone in end-stageosteoarthritis patients
JIANG Chao,WANGYipeng,QIU Guixing,WU Zhihong,WENG Xisheng*
(Departmentof Orthopedics,Peking Union M edical College Hospital,CAMS&PUMC,Beijing 100037,China)
2095-9958(2016)02-0069-06
10.3969/j.issn.2095-9958.2016.01-14
翁习生,E-mail:xshweng@medmail.com.cn

