人EC-SOD基因真核表达载体的构建与鉴定
吴西军 董智慧 舒莉萍 何志旭 ,3
(1贵州医科大学组织工程与干细胞实验中心 贵州 贵阳 550004)
(2贵州医科大学免疫学教研室 贵州 贵阳 550004)
(3贵州省儿童医学中心 贵州 贵阳 550004)
人EC-SOD基因真核表达载体的构建与鉴定
吴西军1,2董智慧1舒莉萍1,2何志旭1,3
(1贵州医科大学组织工程与干细胞实验中心 贵州 贵阳 550004)
(2贵州医科大学免疫学教研室 贵州 贵阳 550004)
(3贵州省儿童医学中心 贵州 贵阳 550004)
目的:构建携带EC-SOD基因和增强绿色荧光蛋白(EGFP)报告基因的真核表达载体,并观察其在人脐带间充质干细胞(huMSCs)细胞中的表达。方法:从人外周血中提取总RNA,逆转率制备cDNA,采用聚合酶链式反应(PCR)中获取EC-SOD基因,其与真核表达载体pCS2+经ClaI/EcoRI双酶切后;经T4 DNA连接酶连接,获得重组质粒pCS2+-EC-SOD,用菌液PCR、ClaI/EcoRI双酶切及测序鉴定正确后,将其与经PCR获取的EGFP基因用EcoRI/xbaI双酶切;经T4 DNA连接酶连接,获得pCS2+-EC-SOD-EGFP重组质粒,用菌落 PCR、EcoRI/xbaI双酶切及测序鉴定。用纳米试剂法转染huMSCs细胞,用倒置荧光显微镜观察EGFP的表达。结果:成功获取了EC-SOD基因和EGFP基因,重组质粒pCS2+-ECSOD-EGFP经菌落PCR和双酶切均得到大小一致的目的条带,经测序鉴定该序列与GenBank中人EC-SOD基因、EGFP基因序列的同源性达100%,基因插入方向正确;重组质粒转染huMSCs细胞后可见EGFP增强绿色荧光蛋白表达。结论:成功构建了EC-SOD的真核表达重组质粒pCS2+-EC-SOD-EGFP,且能在huMSCs细胞中表达 。
EC-SOD基因;增强绿色荧光蛋白;表达载体;转染
超氧化物歧化酶(Superoxide Dismutases,SOD)是机体内一种重要的抗氧化酶,其功能是清除细胞生命活动中产生的超氧离子。在哺乳动物SOD共有三种亚型:Mn-SOD存在于线粒体,Cu/Zn.SOD主要位于细胞质和细胞核。细胞外超氧化物歧化酶(extracellular SOD,EC-SOD)是唯一位于细胞外的SOD亚型,通过其肝素结合结构域(heparin.binding domain,HBD)与细胞表面和细胞外基质相结合,主要存在于是细胞外体液,如淋巴液、滑膜液及血浆中,担负着这些部位艰巨的清除超氧化物的作用[1],这些特性为其在健康领域中的应用提供了广阔的前景。本研究通过构建重组的真核表达质粒pCS2+-EC-SOD-EGFP,并且在并将其在人脐带间充质干细胞中表达,为进一步研究干细胞联合EC-SOD在抗衰老中的作用奠定基础。
1.材料和方法
1.1 实验材料
人脐带间充质干细胞、pCS2+载体质粒、E.coliDH50α由贵州医科大学组织工程与干细胞实验中心细胞库保存,PCR引物由上海捷瑞生物科技有限公司合成,Trizol试剂、逆转录试 剂First.strand plus购自Invitrogen公司,高保真KOD—Plus FCR酶购自TOYOBO公司,限制性内切酶Cal1、EecR I和Xba I、T4 DNA连接酶以及均购自Fermentas公司,质粒小抽 试剂盒购自于Axygen公司。DNA Marker、DNA凝胶回收试剂盒购自北京天根生物公司,基因鉴定测序由北京诺赛基因公司完成。DMEM培养液、0.25% 胰蛋白酶购自美国Hyclohe公司,胎牛血清购自杭州四季青生物制品有限公司,纳米转染试剂由xxx公司惠赠,外周血来源于本人捐献。
1.2 实验方法
(1)总RNA的提取及目的基因的获取 抽取外周血匀浆,参照Trizol Total RNA说明书,采用一步法提取人外周血总RNA后再逆转录为cDNA,-20℃保存备用。在NCBI pubmed的Genebank数据库中查找到目的基因EC-SOD(登录号为:NM-003102.2)以及EGFP(登录号:NC-013179.1)编码序列的ORF,参照pCS2+质粒的多克隆位点,用NCBI ORF及DNAMAN软件各自对其进行ORF分析,限制性酶切分析。根据实验目的再用Primer Premier 5.0引物设计软件设计不含EC-SOD终止子及EGFP启动子的特异性引物:

表1 ec-sod、egfp基因引物
扩增条件为:94℃预变性2min,94℃变性30S;55/62℃退火30S,68℃延伸1min,共30次循环,最后延伸68℃10min,PCR产物大小为720/717bp,1%琼脂糖凝胶电泳鉴定。
(2) pCS2+-EC-SOD-EGFP表达载体构建及鉴定
EC-SOD基因PCR产物和pCS2+载体分别用限制性内切酶Cal I和EcoR1进行双酶切酶切并割胶回收。通过T4连接酶将EC-SOD和pCS2+载体重组连接,转化入DH5α大肠杆菌,经筛选后挑取单克隆,摇菌,质粒小提试剂盒抽取质粒DNA。用限制性内切酶Cal I和EcoR1进行双酶切和菌液PCR验证,正确后送往京赛诺公司进行序列测定并进行Blast比对。将验证正确的重组质粒EC-SOD-pCS2+和EGFP基因片段用限制性内切酶EcoR1和Xba I进行双酶切并割胶回收。通过T4连接后转化入DH5α大肠杆菌,经筛选后挑取单克隆,摇菌并质粒小提试剂盒抽取质粒DNA。用限制性内切酶Cal I和EcoR1进行双酶切和菌液PCR验证,正确后送往京赛诺公司进行序列测定并进行Blast比对。
(3)人脐带间充质干细胞的培养及重组质粒pCS2+-EC-SOD-EGFP转染 人脐带间充质干细胞的复苏后加入含10%FBS的低糖DMEM,将其转移至培养瓶中于CO2培养箱中培养(CO2浓度为5%,温度为37℃),传代后待细胞长至70%左右时,将构建好的重组质粒EC-SOD-EGFP-pCS2+与转染试剂直接混合,震荡混匀制备核酸-纳米混合物,将核酸-纳米混合物加入细胞培养板中,轻柔混匀后继续培养,24小时换液,48小时后荧光显微镜下观察EC-SOD-EGFP融合蛋白的表达情况。
2.结果
2.1 EC-SOD-pCS2+重组质粒的构建
(1)外周血总RNA提取 从人外周血中提取出EC-SOD总RNA,经琼脂糖凝胶(1.5%)电泳检测,两个样本条带清晰,均可见28s、18s、5s条带(如图1)。
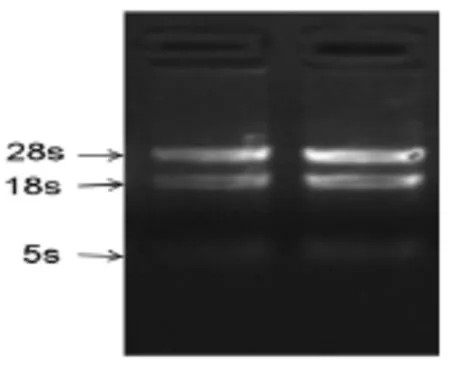
图1 人外周血总RNA电泳图
(2) EC-SOD目的基因RT-PCR扩增 以cDNA为模版,用设计合成的引物SOD3的上游引物和下游引物进行PCR扩增,用1.5%琼脂糖凝胶电泳检测,根据电泳结果显示,三个样本在与700bp大致平行处均有明亮的条带,与预期条带大小一致(如图2)。
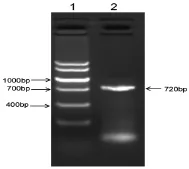
图2 EC-SOD基因PCR扩增电泳图(1、DNA markerⅤ;2、EC-SOD PCR产物)
(3)SOD3-pCS2+重组质粒酶切鉴定结果 将SOD3-pCS2+质粒以EcoRI及ClaI双酶切,EcoRI单酶切,通过1.5%琼脂糖凝胶电泳,根据电泳结果显示,在4000bp附近有两条带,700bp附近有一条带,条带大小与目标条带大小相符,可初步鉴定有目的基因插入pCS2+质粒DNA。
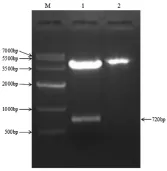
图3 pCS2+-EC-SOD重组质粒酶切鉴定电泳图(M、DNA makerⅣ;1、pCS2+-EC-SOD重组质粒ClaI 和 EcoRI 双酶切;2、pCS2+-EC-SOD重组质粒 EcoRI 单酶切)
(4)SOD3-pCS2+重组质粒菌落PCR结果 挑取阳性克隆菌落培养,取4个质粒DNA菌液裂解,以其为模版,进行菌落PCR检测,根据电泳结果,在700bp上方有明显条带,与目的基大小相符,说明这单克隆菌落中有目的基因存在(如图4)。
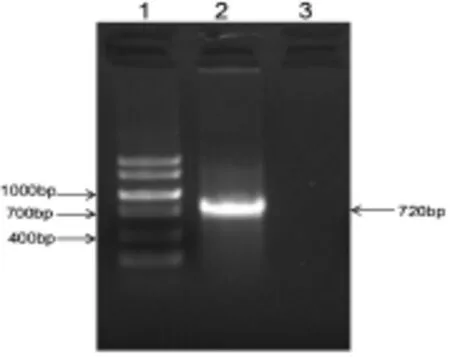
图4 EC-SOD基因菌落PCR结果电泳图。(1、DNA markerⅤ;2、EC-SOD PCR产物;3、空白对照)
(5)测序结果 将重组质粒pCS2+-EC-SOD委托北京诺赛生物公司进行测序,其结果经Genebank中EC-SOD进行序列比对,与r人EC-SOD基因序列完全一致,ATG起始可见,酶切位点存在(如图5)。
图5 EC-SOD测序结果图(部分)
2.2 pCS2+-EC-SOD-EGFP 重组质粒的构建
(1)EGFP基因PCR结果 以中心保存的含有EGFP整个编码序列的质粒为模版,PCR扩增后获得不含ATG起始的EGFP序列的PCR产物,根据电泳结果可见,在位于700bp附近可见一明显条带,与预期733bp大小相符(如图6)。
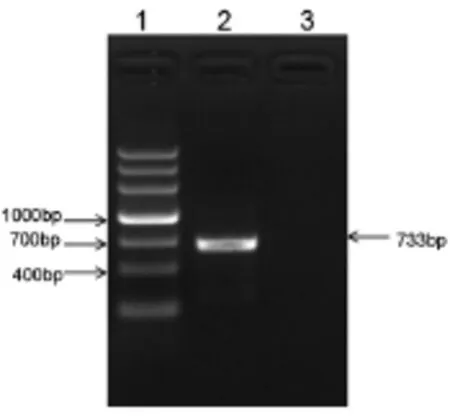
图6 EGFP基因PCR结果(1、DNA markerⅤ;2、EGFP PCR产物;3、空白对照)
(2)pCS2+EC-SOD-EGFP重组质粒酶切鉴定 将SOD3-egfp-pCS2+重组质粒以EorRI 及XbaI 双酶切,XbaI单酶切鉴定,用1.5%琼脂糖凝胶电泳显示,在5500bp附近有两条带,700bp附近可见一条明显的条带,大小与预期的相符,初步判断egfp已经插入(如图7)
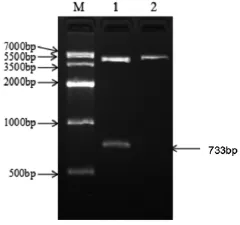
图7 EC-SOD-EGFP-pCS2+重组质粒酶切结果电泳图(M、DNA makerⅣ;1、pCS2+-EC-SOD重组质粒ClaI 和 EcoRI 双酶切;2、pCS2+-EC-SOD重组质粒 EcoRI 单酶切)
(3)SOD3-egfp-pCS2+重组质粒菌落PCR 挑取SOD3-egfp-pCS2+重组质粒阳性克隆菌落培养,取6个质粒DNA菌液裂解,以其为模版,1个空白对照,进行菌落PCR扩增,根据电泳结果显示,2号质粒浓度较低,3-7号泳道在700bp上方有明显条带,与目的基因大小(723bp)相符,说明几个菌落中皆有目的基因存在(如图8)。
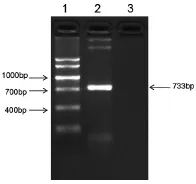
图8 EGFP基因菌落PCR结果电泳图(1、DNA Marker Ⅴ;2、EGFP PCR产物;3、空白)
(4)EGFP测序结果 将构建好的重组质粒委托北京诺赛生物公司进行测序,其结果经Genebank中EGFP进行序列比对,与基因序列完全一致,酶切位点存在(如图9)。
图9 EGFP基因序列测定结果图(部分)
2.3 pCS2+-EC-SOD-EGFP重组质粒载体转染人脐带间充质干细胞
人脐带间充质干细胞培养至第五代培养板中细胞达70%左右时,加入制备好的转染混悬液,48小时后荧光显微镜观察,结果如图10:
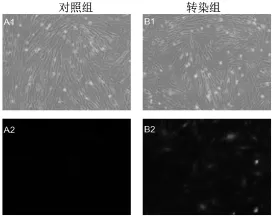
图10 pCS2+-EC-SOD-EGFP重组质粒转染huMSCs 48小时后荧光显微镜下观察(A1、B1为明场;A2、B2为荧光场;x100)
3.讨论
外源蛋白在哺乳动物细胞中的表达受多种因素影响,比如:启动子的强度、整合位置、转录产物的稳定性、mRNA的翻译效率、目的蛋白的稳定性、目的蛋白的折叠效率等其中重要因素均与表达载体的选择有关[2]。所以表达载体的选择是决定外源蛋白表达的关键,而启动子的强度对于基因的表达尤其重要。本课题所选用的pCS2+载体,含有较强的启动子,符合特定表达载体要求。EC-SOD基因和EGFP基因融合蛋白表达,要求我们在设计特异性引物时要注意EC-SOD基因的终止子和EGFP基因启动子的特殊处理。克隆基因,插入载体,双酶切及菌落PCR鉴定,序列测定并进行blast比对,找出引入的酶切位点,比对完全正确后在进行下步操作,保证所构建的重组表达质粒能够保真,并利用纳米转染试剂转染。
人的EC-SOD的基因位位于人染色体的4q21与牛及大鼠的EC-SOD基因和Cu/Zn-SOD的基因有60%的同源性。人EC-SOD的cDNA编码30kD大小的亚基,是由240个氨基酸残基组成的多肽,其中包含18个氨基酸组成的信号肽,因此成熟蛋白由222个氨基酸组成[1、3]。EC-SOD是一种轻微疏水的糖蛋白,主要存在于细胞外液和结缔组织细胞外基质中。当机体受到射线照射、代谢物物聚集后会产生大量氧自由基及中间产物等活性氧(reactive oxygen species,ROS),其可以诱导产生促有丝分裂效应并参与细胞信号传导[4-5],但当ROS不断增多,无法清除时,会损伤细胞内的蛋白质、脂类、核及线粒体的DNA。使细胞质和细胞核中的核酸链断裂,导致肿瘤、炎症、衰老、血液病及心、肝、肺、皮肤等部位产生病变[6-8]。SOD能够有效清除氧自由基,从而起到保护机体细胞的作用。间充质干细胞是起源于中胚层的一类多能细胞,它具有以下特性自我更新,多向分化能力及较低的免疫原性让其有较广泛的应用前景。不同来源的间充质干细胞具有非常相似生物学特性[9-12],正常生理情况下断分化为新的间质细胞补充、替代老化的间质细胞和组织。所以补充外源性间充质干细胞是否能改善,甚至逆转组织器官的衰老是一个很值得探究的研究热点。将EC-SOD与间充质干细胞联合抗衰老,既能清楚氧自由基代谢压力和辐射老化,又能通过干细胞分泌相关细胞因子调节组织再生、调节免疫功能,兼顾内外因素抗衰老[13-17],极具应用前景。
本项研究成功的构建了pCS2+-EC-SOD-EGFP重组真核表达质粒载体,经去内毒素处理后通过纳米试剂制备混悬液后转染人脐带间充质干细胞,转然后48小时在荧光显微镜下可见有绿色荧光蛋白的表达,由于构建的pCS2+-EC-SOD-EGFP重组真核表达质粒载体表达的是融合蛋白,必须在EC-SOD表达的情况下才可以继续表达绿色荧光蛋白,可见重组表达构建和转染是成功的。为进一步进行EC-SOD与间充质干细胞联合抗衰老研究打下坚实基础。
[1] Michał Skrzycki, Hanna Czeczot,Extracellular superoxide dismutase (EC-SOD)– structure,properties and functions,Postepy Hig Med Dosw.(online), 2004; 58:301-311.
[2] Abdul Mutalib NE,Matlsa N,Alitheeh NB,et al. IRESihcorporated lactococcal bicistrohic vector for target gehe expressioh ih a eukaryotic system[J]. Plasmid,2014(73):26-33.
[3] Hjalmarsson K,Marklund S L,Engstrom A,et al.Isolation and sequence of complementary DNA encoding human extra2 cellular superoxide dismutase[J].Proc Natl Acad Sci USA,1987,84: 6340-6344.
[4] Madamanchi N1L Moon SK,Hakim ZS,et a1.Differential activation of mitogenic signaling pathways in aortic smooth muscle cells deficient in superoxide dismutaseisoforms.Arterioscler Thromb Vase Biol,2005,25(5):950-956.
[5] Poli G Leonarduzzi G Biasi F,et a1.Oxidative stress and cell signaling.Curr Med Chem,2004,11(9):1163-1182.
[6] Perveen S,Patel H,Arif A,Younis S,Codipilly CN,et al.(2012)Role of EC-SOD Overexpression in Preserving Pulmonary Angiogenesis Inhibited by Oxidative Stress.PLoS ONE 7(12): e51945.
[7] Hirofumi Koyama,Hidetoshi Nojiri,Satoru Kawakami,et al.Antioxidants Improve the Phenotypes of Dilated Cardiomyopathy and Muscle Fatigue in Mitochondrial Superoxide Dismutase-Deficient Mice.Molecules 2013, 18, 1383-1393.
[8] Cassidy Delaney1,*,Rachel H. Wright1,Jen-Ruey Tang,et al.Lack of EC-SOD worsens alveolar and vascular development in a neonatal mouse model of bleomycin-
induced bronchopulmonary dysplasia and pulmonary hypertension.Pediatr Res.2015;78(6): 634-640.
[9] Bruder SP,Kurth AA,Shea M,et al.Bone regeneration by implantation of purified,culture-expanded human mesenchymal stem cells.J Orthop Res.1998;16(2):155-162.
[10] Kadiyala S,Young RG,Thiede MA,et al. Culture expanded canine mesenchymal stem cells possess osteochondrogenic potential in vivo and in vitro. Cell Transplant. 1997;6(2):125-134.
[11] Dennis JE,Merriam A,Awadallah A,et al. A Quadripotential Mesenchymal Progenitor Cell Isolated from the Marrow of an Adult Mouse.J Bone Miner Res.1999;14(5):700-709.
[12] Ferrari G,Cusella G,Angelis D,et al. Muscle Regeneration by Bone Marrow-Derived Myogenic Progenitors. Science.1998;279(5356):1528-1530.
[13] Barbara L.Marshall The New Virility:Viagra,Male Aging and Sexual Function Sexualities,Jul 2006,9:345-362.
[14] Delminda Neves,Janete Santos,Nuno Tomada,Henrique Almeida,and Pedrovendeir Aging and Orchidectomy Modulate Expression of VEGF Receptors on Corpus Cavernosum of theat Ann.N.Y.Acad.Sci,2006,1067:164-172.
[15] S Ma,N Xie,W Li,B Yuan,Y Shi*,Immunobiology of mesenchymal stem cells.Cell Death and Differentiation 2014,21,216-225.
[16] Ying Wang,Xiaodong Chen,Yufang Shi,et al.Plasticity of mesenchymal stem cells in immunomodulation:pathological and therapeutic implications.Nature immunology,2014,15,11,1009-1016.
[17] Edward D.Levin.Extracellular Superoxide Dismutase(EC-SOD)Quenches Free Radicals and Attenuates Age-Related Cognitive Decline: Opportunities for Novel Drug Development in Aging.Current Alzheimer Research,2005,2,191-196.
TP1
A
1009-5624(2016)05-0074-05

