骨癌痛大鼠脊髓背根神经节主要组织相容复合物Ⅱ表达变化的研究
李明,耿卫国,刘文明
(1.山东省东营市人民医院护理部,山东东营257091;2.山东省东营市立儿童医院,山东东营257091;3.滨州医学院附属医院烧伤整形外科,山东滨州256603)
骨癌痛大鼠脊髓背根神经节主要组织相容复合物Ⅱ表达变化的研究
李明1,耿卫国2,刘文明3
(1.山东省东营市人民医院护理部,山东东营257091;2.山东省东营市立儿童医院,山东东营257091;3.滨州医学院附属医院烧伤整形外科,山东滨州256603)
目的建立大鼠胫骨的骨癌痛模型,观察骨癌痛发生时脊髓背根神经节内主要组织相容复合物Ⅱ(MHCⅡ)的表达变化情况。方法雌性SD大鼠33只,随机分为正常组(Naive组,n=9)、假手术组(Sham组,n=12)和骨癌痛组(骨癌痛组,n=12)。骨癌痛组右侧胫骨的骨髓腔内接种Walker 256乳腺癌细胞,Sham组注射相等体积的D-Hanks液。于手术前1天及手术后3、7、10和14 d使用von-Frey丝测定手术侧的机械缩爪阈值;于手术后14d采集各组(n=9)的L3~L5的右侧背根神经节,每3只大鼠的背根神经节标本作为一组提取总的蛋白质,采用蛋白免疫印迹法(Western blot)检测MHCⅡ的变化情况;于手术后14d多聚甲醛灌注Sham组(n=3)和骨癌痛组(n=3)大鼠,取L3~L5的右侧背根神经节制作冷冻切片,采用免疫荧光双标染色观察MHCⅡ的变化情况以及与神经元和卫星细胞的关系。结果手术前各组大鼠的机械缩爪阈值,差异无统计学意义;骨癌痛组在骨癌痛模型建立7 d后较基础值显著降低,差异有统计学意义(P<0.05),且显著低于Naive组,差异有统计学意义(P<0.05)。免疫荧光染色显示MHCⅡ表达于背根神经节的卫星细胞;同时Western blot定量结果发现骨癌痛组的MHCⅡ表达水平显著高于Naive组,而Sham组变化差异无统计学意义。结论骨癌痛大鼠背根神经节的MHCⅡ表达升高,可能参与骨癌痛的外周敏化。
骨癌痛;背根神经节;主要组织相容复合物Ⅱ;外周敏化
2015年我国预计新增癌症患者429.2万例,其中肺癌、结直肠癌、前列腺癌、乳腺癌等高转移性恶性肿瘤的发病率较高[1]。有资料指出,40%进展期及90%终末期的癌症患者需要接受针对癌症诱发性疼痛的治疗[2],其中骨癌痛(bone cancer pain,BCP)是治疗的重要部分[3]。BCP作为慢性疼痛之一,通常表现为持续痛和爆发痛,严重影响患者的生活质量,目前治疗手段有限。主要组织相容复合物Ⅱ(major histocompatibility complex classⅡ,MHCⅡ)是介导适应性免疫调节的重要分子,研究表明该分子也参与基础痛觉感知以及慢性疼痛的发生[4-6]。脊髓背根神经节(dorsal root ganglias,DRGs)作为外周感觉传入的关键部位[7],其在骨癌痛发生时MHCⅡ分子的表达变化情况目前尚不清楚。因此,本研究拟观察BCP大鼠DRGs的MHCⅡ表达变化情况,为进一步探讨骨癌痛的发病机制提供科学依据。
1 材料与方法
1.1实验动物及分组
无特定病原(specific pathogen free,SPF)级健康成年雌性SD大鼠33只,体重200~220 g,由滨州医学院附属医院代谢与神经精神疾病研究所提供。饲养环境:温度(22±1)℃,相对湿度维持于60%,自由进水进食。随机分为正常组(Naive组,n=9)、假手术组(Sham组,n=12)和骨癌痛组(BCP组,n=12)。
1.2骨癌痛大鼠模型制备
将Walker 256大鼠乳腺癌细胞种植于成年雌雄SD大鼠腹腔,7 d后在无菌条件下提取腹水,使用D-Hanks液反复洗涤至清亮,调整细胞浓度为4× 107个/ml,置于冰上备用。盐酸戊巴比妥钠40mg/kg腹腔注射,麻醉后固定大鼠于小动物手术台上,右后肢剃毛、消毒,沿胫骨上端前正中线纵向切开皮肤,钝性分离肌肉筋膜等皮下软组织,暴露胫骨粗隆,于胫骨平台下方约0.5cm处用23G注射器针头钻孔至骨髓腔,针尖指向胫骨远端,两者间夹角约为30°。再使用20μl微量注射器沿此孔道进针,向胫骨的髓腔内注射备用的Walker 256大鼠乳腺癌细胞10μl(约4×105个),注射完毕停留2 min,退出注射器并迅速使用骨蜡封闭针孔,冲洗手术部位,消毒皮肤,依次缝合肌肉、皮肤。Sham组大鼠胫骨髓腔内注射相等体积的D-Hanks液。
1.3机械痛阈测定
于手术前1天以及手术后3、7、10和14 d的上午9∶00测定大鼠的机械痛阈,即机械缩爪阈值(mechanical pawwithdrawal threshold,MPWT)。MPWT测定参考文献的方法[8]。大鼠置于独立的玻璃箱内(10 cm×10 cm×15 cm)适应环境20 min后,使用校正后的系列von-Frey丝(0.4、1.0、2.0、4.0、6.0、8.0、10.0和15.0g)垂直刺激大鼠右后足底中心无毛区域,起始测定值为2.0 g,持续时间大约6~8 s,每级力度重复5次,每次间隔30 s,若3次均为阳性反应(快速缩爪、舔足)则降低一级力度测定,若为阴性则增加一级力度,如此反复进行,截断值为15.0g。
1.4MHCⅡ免疫荧光染色
骨癌痛模型建立后14 d,Sham组(n=3)和BCP组(n=3)大鼠在盐酸戊巴比妥钠麻醉下解剖胸腔,行升主动脉插管,使用4℃生理盐水300 ml和4%多聚甲醛500ml依次灌注。取L3~L5的右侧DRGs,4%多聚甲醛后固定24h,再30%蔗糖脱水48h,行冷冻切片,厚度为10μm。磷酸缓冲盐溶液(phosphate buffer saline,PBS)缓冲液漂洗5次,每次5 min,PBS稀释的浓度为5%的牛血清白蛋白(bovine serumalbumin,BSA)封闭45 min,随后加入小鼠抗大鼠MHCIIRT1B抗体(1∶100)与兔抗大鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(美国Merck Millipore公司,商品编号:04-1062,1∶200),或者与兔抗大鼠NeuN抗体(美国Merck Millipore公司,商品编号:MABN140,1∶200),4℃孵育24h。PBS缓冲液漂洗5次,每次5min,加入Cy3-和Alexa 488-标记的相应山羊抗小鼠和山羊抗兔的二抗(美国Jackson Immuno Research公司,商品编号:115-165-003和111-545-003,1∶200和1∶100)室温下孵育1h,PBS漂洗5 min×3次,50%甘油封片,荧光显微镜(德国Leica公司,DM2500)下观察并获取图像。
1.5蛋白免疫印迹法(Western blot)检测
在骨癌痛模型建立14 d后安乐死大鼠(n=9),取右侧L3~L5的DRGs置于冰上,每3只大鼠的标本随机组合为一组,使用蛋白裂解液(radio immunoprecipitation assay,RIPA)裂解液提取组织总蛋白,分光光度法测定蛋白浓度,将50μg蛋白用10%的聚丙烯酰胺凝胶电泳后转移到聚偏氟乙烯膜上,5%的BSA室温下封闭1 h,4℃孵育小鼠抗大鼠MH CclasⅡRT1B一抗(英国Ab DSerotec公司,商品编号:MCA46R,1∶1 000)和兔抗大鼠α-tubulin一抗(英国Abcam公司,商品编号:ab15246,1∶1 500)过夜,洗膜缓冲液(trisbufferedsalinewith tween-20,TBST)洗涤10min×3次,辣根过氧化物酶(horse radish peroxidase,HRP)标记的相应二抗(武汉博士德生物工程有限公司,1∶5 000)室温下孵育1 h,再次TBST洗涤10 min×3次后使用化学发光法与HRP发生反应,利用BIO-RAD Gel Doc 2000凝胶成像系统获取条带图像数据并分析。
1.6统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料采用均数±标准差(±s)表示,不同时间点MPWT的变化用重复测量设计方差分析,14 d后MHCⅡ蛋白表达水平的比较用随机设计方差分析,P<0.05为差异有统计学意义。
2 结果
2.1MPWT变化
骨癌痛模型建立前,Naive组、Sham组和BCP组大鼠肢体功能活动及感觉正常,MPWT基础值在正常范围,各组间比较差异无统计学意义。在骨癌痛模型建立7 d后,BCP组大鼠MPWT较基础值明显下降(P<0.05),手术后10 d和14 d时更为显著,差异有统计学意义(P<0.01);与Naive组比较,BCP组在骨癌痛模型建立7、10和14d后MPWT均显著降低,差异有统计学意义(P<0.05);Sham组大鼠在骨癌痛模型建立前后各时间点MPWT较基础值无显著变化,与Naive组大鼠比较差异无统计学意义。以上结果提示胫骨髓腔内种植Walker 256乳腺癌细胞能够诱发异常疼痛,类似于骨癌痛患者的临床表现,说明骨癌痛大鼠模型制作成功。见表1。
表1 各组大鼠不同时间点MPWT的变化情况(g±s)
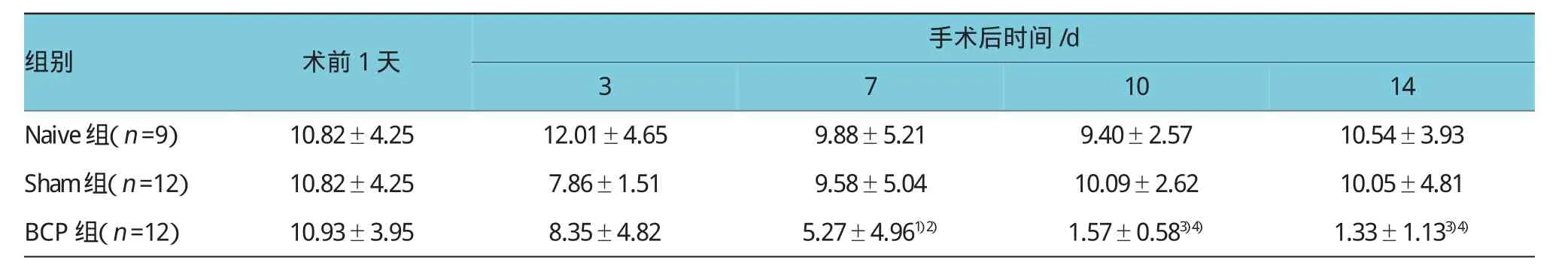
表1 各组大鼠不同时间点MPWT的变化情况(g±s)
注:1)组内与术前1天比较,P<0.05;2)相同时间点与Naive组比较,P<0.05;3)组内与术前1天比较,P<0.01;4)相同时间点与Naive组比较,P<0.01
1014 Naive组(n=9)10.82±4.2512.01±4.659.88±5.219.40±2.5710.54±3.93 Sham组(n=12)10.82±4.257.86±1.519.58±5.0410.09±2.6210.05±4.81 BCP组(n=12)10.93±3.958.35±4.825.27±4.961)2)1.57±0.583)4)1.33±1.133)4)组别术前1天手术后时间/d 3 7
2.2MHCⅡ在DRGs表达的细胞类型
收集骨癌痛模型建立14d后的BCP组大鼠右侧L3~L5的DRGs制作冷冻切片,通过免疫荧光双标观察MCHⅡ在DRGs表达的细胞类型,发现MHCⅡ与GFAP共定位,而不与NeuN共定位,提示骨癌痛病理情况下DRGs的MHCⅡ由卫星细胞表达。见图1。
2.3MHCⅡ蛋白表达水平在DRGs的变化情况
在骨癌痛大鼠模型建立14 d后,收集大鼠右侧L3~L5的DRGs,利用Western blot方法检测MHCⅡ的蛋白表达水平,发现BCP组大鼠在手术后14d时MHCⅡ蛋白表达水平在该侧L3~L5的DRGs表达较Naive组显著升高(P<0.05),而Sham组无显著变化。该结果提示MHCⅡ可能参与骨癌痛的病理过程。见图2和表2。
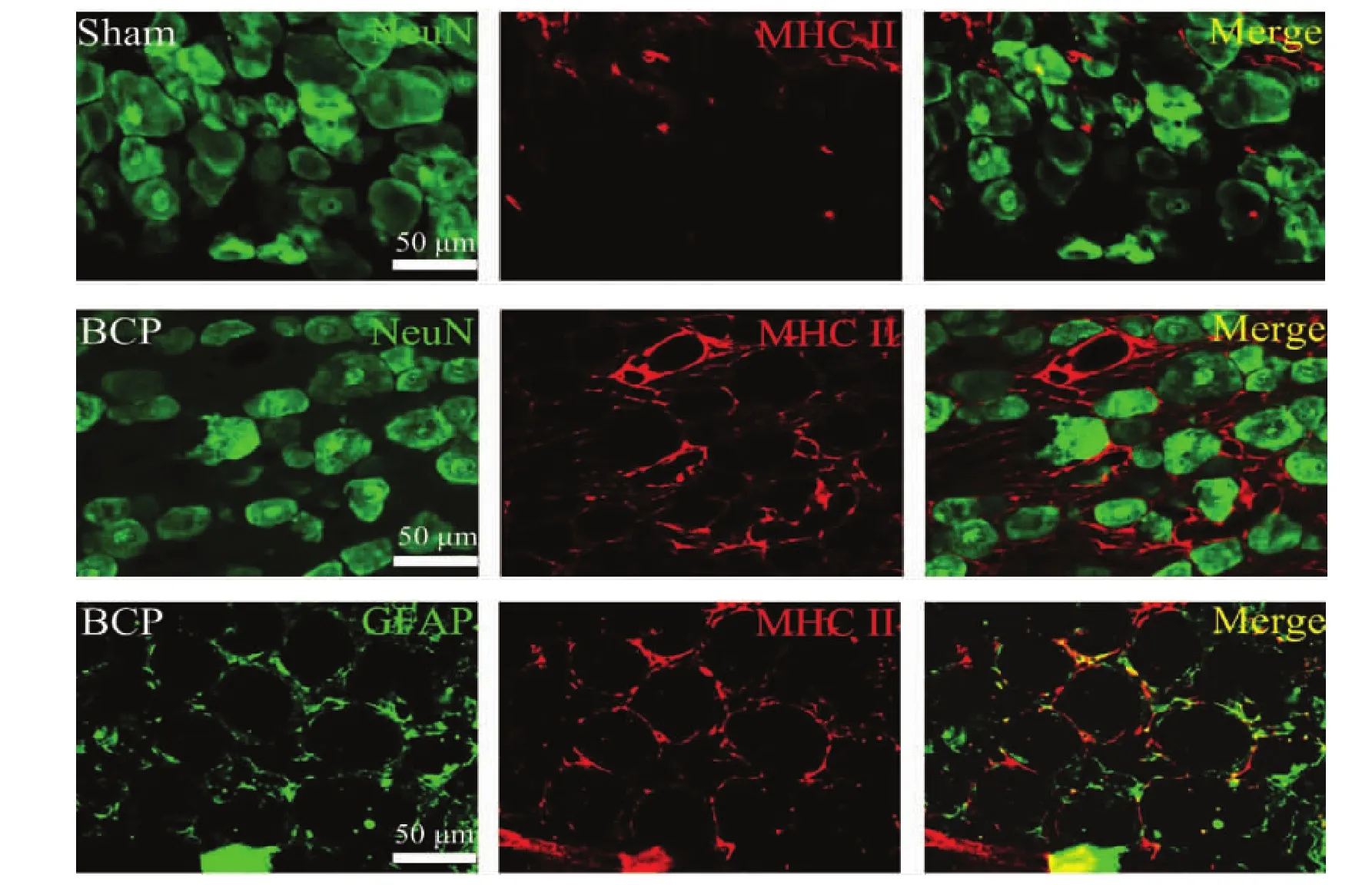
图1 MHCⅡ表达于BCP大鼠DGRs的卫星细胞
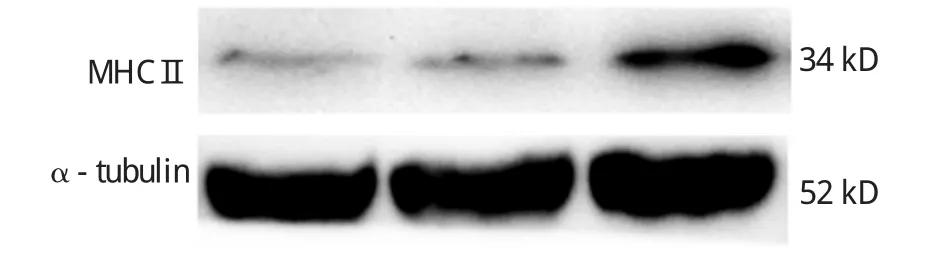
图2 各组大鼠MHCⅡ在L3~L5节段DRGs的表达情况
表2 各组大鼠MHCⅡ蛋白在L3~L5节段DRGs的相对表达量比较(g±s)

表2 各组大鼠MHCⅡ蛋白在L3~L5节段DRGs的相对表达量比较(g±s)
注:†与Naive组比较,P<0.05
组别MHCⅡ/α-tubulin蛋白的表达量F值P值Naive组1.000±0.000 Sham组1.336±0.352 BCP组3.168±0.449†37.6610.000
3 讨论
近年来,多种肿瘤细胞系和动物品系被用来制备BCP动物模型[9],以模拟BCP患者的临床症状及病理生理机制,进而对BCP的发病机制进行研究,同时探索该疾病行而有效的治疗方案。本研究采用成熟的BCP模型制备方法,向大鼠右侧胫骨的髓腔内注射Walker 256大鼠乳腺癌细胞,在种植7 d后该侧肢体对15 g以下的系列von-Frey丝刺激(通常为无害性触觉)表现异常疼痛,MPWT呈时间依赖的显著性下降,表明骨癌痛大鼠模型制备成功。
骨癌痛发生于原发性骨骼肿瘤或其他部位恶性肿瘤(例如乳腺癌、前列腺癌、肺癌等)中晚期转移至骨骼,表现为进行性加重的持续痛,并伴有自发痛及活动诱发痛,严重影响患者的生活质量,发病机制复杂[10]。当恶性肿瘤发生于骨骼时,一方面肿瘤及其基质细胞产生并释放致痛物质,如缓激肽、内皮素、神经生长因子、IL-6、TNF-α等,它们参与敏化或直接兴奋初级传入纤维[11];另一方面,肿瘤生长导致骨骼微环境的变化能够诱发骨骼重塑,该病理性改变兴奋支配骨骼的机械性压力感受器,表现为爆发痛(活动诱发痛)[12];此外,当肿瘤细胞突破骨骼侵蚀至周围组织时,破坏感觉纤维的远端末梢,引起神经病理性疼痛[13]。以上论述说明外周感觉传入纤维的敏化在BCP的发生及维持中具有重要的作用。DRGs是外周初级感觉传入纤维的细胞体所在,是外周敏化的关键部位,所以有理由认为DRGs的系列改变能够反映BCP发生时外周敏化的进展程度。利用逆行示踪技术发现,支配胫骨的感觉纤维主要来自于L3的DRG,还有少部分来自于L1、L2、L4和L5[7]。因此,本研究中采集右侧L3~L5的DRGs进行研究。
主要组织相容复合物在大鼠命名为RT1系统,其中MHCⅡ称为RT1-B/D,包含有α链和β链,基因定位于大鼠的20号染色体上[14]。通常认为MHCⅡ参与适应性免疫反应的抗原递呈,然而新近研究发现编码该分子的基因与基础痛觉的感知有关[6],甚至参与慢性疼痛发生的调控[4],更有证据表明该蛋白分子直接与神经病理性疼痛的发生存在一定关系[5]。有学者报道,脊髓小胶质细胞表达MHCⅡ与由外周血液趋化迁移而来的CD4+T淋巴细胞相互作用并释放促炎症细胞因子和趋化因子,介导神经病理性疼痛的中枢敏化[15],而抑制该分子的表达能够逆转神经损伤导致的相关疼痛行为[16]。在本研究中,笔者观察到骨癌痛发生时大鼠DRGs的MHCⅡ表达水平上调,且定位于卫星细胞上,据此推测MHCⅡ参与骨癌痛外周敏化的发生过程。
在此项研究中,笔者发现BCP大鼠的痛阈显著降低,DRGs的MHCⅡ表达显著升高,提示MHCⅡ可能参与BCP的外周敏化的病理过程,在未来的工作中笔者将对该分子在转录及翻译水平进行有效干预,进一步证实其在BCP病理过程中的作用,为BCP治疗提供新的靶点。
[1]CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]PALEY C A,JOHNSON MI,TASHANI OA,et al.Acupuncture for cancer pain in adults[J].Cochrane Database Syst Rev,2015, 10:DOI:10.1002/14651858.CD007753.pub3.
[3]CLOHISYD R,MANTYH P W.Bone cancer pain[J].Cancer, 2003,97(3 Suppl):866-873.
[4]MOGIL J S.Pain genetics:past,present and future[J].Trends Genet,2012,28(6):258-266.
[5]GUO Y,YAO F R,CAO D Y,et al.The major histocompatibility complex genes impact pain response in DA and DA.1U rats[J]. Physiol Behav,2015,147:30-37.
[6]GUO Y,YAO F,LU S,et al.The major histocompatibility complex genes are associated with basal pain sensitivity differences between Dark-Agouti and novel congenic DA.1U rats[J].Life Sci, 2010,86(25-26):972-978.
[7]KAAN T K,YIP P K,PATEL S,et al.Systemic blockade of P2X3 and P2X2/3 receptors attenuates bone cancer pain behaviour in rats[J].Brain,2010,133(9):2549-2564.
[8]GUAN X H,FU Q C,SHI D,et al.Activation of spinal chemokine receptor CXCR3 mediates bone cancer pain through an Akt-ERK crosstalk pathway in rats[J].Exp Neurol,2015,263: 39-49.
[9]CURRIE G L,DELANEY A,BENNETT MI,et al.Animal models of bone cancer pain:systematic review and meta-analyses[J]. Pain,2013,154(6):917-926.
[10]LUGER N M,MACH D B,SEVCIK M A,et al.Bone cancer pain:from model to mechanism to therapy[J].J Pain Symptom Manage,2005,29(5 Suppl):S32-46.
[11]JULIUS D,BASBAUM A I.Molecular mechanisms of nociception[J].Nature,2001,413(6852):203-210.
[12]MANTYH P W.Bone cancer pain:from mechanism to therapy[J]. Curr Opin Support Palliat Care,2014,8(2):83-90.
[13]OHTORI S,INOUE G,KOSHI T,et al.Characteristics of sensory dorsal root ganglia neurons innervating the lumbar vertebral body in rats[J].J Pain,2007,8(6):483-488.
[14]HURT P,WALTER L,SUDBRAK R,et al.The genomic sequence and comparative analysis of the rat major histocompatibility complex[J].Genome Res,2004,14(4):631-639.
[15]GRACE P M,ROLAN P E,HUTCHINSON MR.Peripheral immune contributions to the maintenance of central glial activation underlying neuropathic pain[J].Brain Behav Immun,2011,25(7): 1322-1332.
[16]SWEITZER S M,WHITE K A,DUTTA C,et al.The differential role of spinal MHC classⅡand cellular adhesion molecules in peripheral inflammatory versus neuropathic pain in rodents[J]. J Neuroimmunol,2002,125(1/2):82-93.
(张蕾编辑)
Expression of major histocompatibility classⅡin spinal dorsal root ganglions of rats with cancerous bone pain
Ming Li1,Wei-guo Gen2,Wen-ming Liu3
(1.Department of Nursing,Dongying People's Hospital,Dongying,Shandong 257091,China;2.Children Hospital of Dongying,Dongying,Shandong 257091,China;3.Department of Burn and Aesthetic Plastic,the Affiliated Hospital,Binzhou Medical University,Binzhou,Shandong 256603,China)
Objective To investigate the changes in the expression level of major histocompatibility classⅡ(MHCⅡ)in spinal dorsal root ganglions of rats with cancerous bone pain(CBP).Methods Thirty-three adult virgin female Sprague-Dawley rats weighing 200-220 g,were randomly divided into three groups:naive group(n =9),sham group(n=12),and CBP group(n =12).Walker 256 rat mammary carcinoma cells were inoculated into the right tibial medullary canal to establish a CBP model,whereas the same volume of D-Hanks solution was injected in the sham group.Mechanical paw withdrawal threshold(MPWT)was examined 1 day before and 3,7,10 and 14 daysafter surgery using calibrated von-Frey filaments applied to the center of ipsilateral hind paw.The L3-L5 ipsilateral dorsal root ganglions(DRGs)were collected 14 days after surgery to test the expression level of MHCⅡby Western blot and immunofluorescent staining.Results The MPWT was not significantly different among the three groups before operation.In the CBP group the MPWT significantly decreased on the 7th day after surgery(P<0.05),and was significantly lower than that of the naive group(P <0.05).The immunofluorescent staining identified that MHCⅡwas dominantly expressed by satellite cells in the DRGs of the CBP rats.Furthermore,Western blot results showed that expression level of MHCⅡwas significantly increased in the CBP group,but not in the sham group,as compared with the naive group.Conclusions The changes in the expression level of MHCⅡin satellite cells of DRGs may be involved in the development of peripheral sensitivity under CBP.
cancerous bone pain;dorsal root ganglion;major histocompatibility classⅡ;peripheral sensitivity
R-332
A
10.3969/j.issn.1005-8982.2016.18.002
1005-8982(2016)18-0006-05
2016-01-25
刘文明,E-mail:GWG1506@sina.com

