EZH2抑制剂DZNeP对人乳腺癌细胞增殖、凋亡及相关信号通路的影响
迪力夏提·金斯汗 吐鲁洪·沙列尔 赵 倩
(新疆医科大学附属肿瘤医院乳腺外科,新疆 乌鲁木齐 830011)
EZH2抑制剂DZNeP对人乳腺癌细胞增殖、凋亡及相关信号通路的影响
迪力夏提·金斯汗吐鲁洪·沙列尔赵倩
(新疆医科大学附属肿瘤医院乳腺外科,新疆乌鲁木齐830011)
目的探讨EZH2抑制剂DZNeP对人乳腺癌细胞增殖、凋亡及相关信号通路的影响。方法取对数生长期乳腺癌细胞MCF-7、MDA-MB-231,经2.5、5、10、20 μmol/L DZNeP处理后(设不加DZNeP仅添加完全培养基组为对照组),采用四甲基偶氮唑盐比色法检测各组24、48、72 h的增殖抑制率,Annexin V-FITC/PI流式细胞术检测各组24、48 h的凋亡率,收集20 μmol/L DZNeP处理72 h的MCF-7、MDA-MB-231细胞,采用Western印迹检测磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)通路和Wnt/β-连接素(β-catenin)通路中的蛋白变化。结果DZNeP在2.5~20 μmol/L范围内可抑制MCF-7和MDA-MB-231细胞增殖,且与对照组相比增殖抑制率升高(P<0.05),该抑制效应呈浓度和时间依赖性;与对照组相比,DZNeP处理组的凋亡率均升高(P<0.05),DZNeP各浓度处理48 h的凋亡率均高于24 h(P<0.05);PI3K/Akt通路中,与对照组相比,20 μmol/L DZNeP处理72 h后MCF-7、MDA-MB-231细胞的PTEN水平均升高,Akt水平均降低(P<0.05);而在Wnt/β-catenin通路上,20 μmol/L DZNeP处理72 h后两细胞株中的β-catenin、Cyclin D1和C-myc水平均降低(P<0.05)。结论DZNeP可抑制人乳腺癌细胞增殖并诱导其凋亡,可能与抑制肿瘤恶性行为相关的PI3K/Akt、Wnt/β-catenin通路有关,在乳腺癌治疗上有一定应用前景。
EZH2抑制剂;乳腺癌;增殖;凋亡;信号通路
乳腺癌已成为影响女性生命健康的恶性肿瘤之一,目前发病率逐年上升,严重影响女性身心健康〔1〕。目前研究认为,表观遗传调控紊乱是包括乳腺癌在内恶性肿瘤的重要特征,组蛋白是重要的表观遗传调控位点〔2〕。组蛋白上的多个氨基酸可被共价键修饰,如甲基化、乙酰化和泛素化等,其中乙酰化与甲基化相互关联〔3〕。EZH2为一种调节组蛋白修饰的酶,具有甲基转移酶和组蛋白去乙酰化酶的调控作用,可通过参与靶基因的转录抑制来促进细胞增殖,在肿瘤的发生发展中起重要作用〔4,5〕。在乳腺癌中针对EZH2靶向治疗的研究尚属空白,本研究选取EZH2抑制剂DZNeP处理乳腺癌MCF-7、MDA-MB-231细胞,观察其对细胞增殖、凋亡及相关信号通路的影响。
1 材料与方法
1.1细胞株与试剂乳腺癌细胞株MCF-7、MDA-MB-231购自中国科学院上海生命科学院细胞库,DZNeP购自美国Selleck公司,Annexin-FITC/PI凋亡检测试剂盒购自北京宝赛生物技术有限公司,噻唑蓝(MTT)、二甲基亚砜(DMSO)及双抗(青霉素、链霉素)购自美国 Amresco公司,胎牛血清(FCS)、胰蛋白酶及RPMI 1640培养基均购自美国Gibco公司,兔抗人β-catenin多克隆抗体购自武汉博士德生物工程有限公司,鼠抗人Akt、C-myc多克隆抗体均购自Transduction Laboratories公司,兔抗人PTEN、Cyclin D1及内参GAPDH多克隆抗体均购自美国Santa Cruz公司。
1.2细胞培养将MCF-7、MDA-MB-231复苏后,采用含10% FCS、100 U/ml青霉素及100 μg/ml链霉素的RPMI 1640培养基于温度为37℃,CO2体积分数为5%的培养箱内培养,48 h后首次换液,其后每2~3 d换液1次,待细胞达80%~90%融合经胰酶消化后,传代培养。
1.3细胞增殖检测取对数生长期MCF-7、MDA-MB-231细胞,采用胰蛋白酶消化制备单细胞悬液,调节浓度至1×105/ml,接种于96孔培养板,向每孔加入20 μl DZNeP溶液,使终浓度依次为2.5、5、10、20 μmol/L(以不加药物的作对照),每个浓度设3个平行孔,常规培养24、48、72 h后,向每孔加入10 μl MTT工作液,继续培养4 h后,加入DMSO溶液终止培养,采用酶标仪检测492 nm下的吸光值(A),根据公式计算DZNeP处理组相对于对照组的增殖抑制率:抑制率(%)=(A对照组-ADZNeP处理组)/A对照组×100%。
1.4细胞凋亡率检测收集不同浓度DZNeP处理24、48 h的MCF-7、MDA-MB-231细胞1×106个,经PBS缓冲液冲洗后,加入200 μl凋亡结合液后轻轻吹散细胞,加入5 μl Annexin-FITC和10 μl PI,避光反应15 min后,采用FACS Calibur 流式细胞仪检测细胞凋亡情况。
1.5Western印迹收集20 μmol/L DZNeP处理72 h后的MCF-7、MDA-MB-231细胞,冰上裂解后室温放置10 min,12 000 r/m离心10 min,采用BCA法检测上清液的蛋白含量,每孔取20 μg蛋白样品至10% SDS-PAGE凝胶,电泳完毕后采用半干转法将蛋白转移至22 μm孔径硝酸纤维素膜,加适量的Akt、PTEN、β-catenin、C-myc和Cyclin D1一抗(除β-catenin的稀释度为1∶200外,其余均为1∶300),4℃孵育过夜后加入二抗,SuperECL Plus超敏发光液进行化学发光显色,将显影后的X线片用Gel-Pro Analyzer 3.1分析光密度,蛋白的相对表达量为与内参GAPDH的比值。
1.6统计学处理采用SPSS18.0软件,多组比较采用单因素方差分析(one way ANOVA),两两比较采用SNK法。
2 结 果
2.1DZNeP对MCF-7细胞增殖的影响DZNeP在2.5~20 μmol/L范围内可抑制MCF-7细胞增殖,且与对照组相比,DZNeP处理组的增殖抑制率均升高(P<0.05);高浓度DZNeP(20 μmol/L)处理72 h后的增殖抑制率达70%以上。见表1。
2.2DZNeP对MDA-MB-231细胞增殖的影响DZNeP在2.5~20 μmol/L范围内可抑制MDA-MB-231细胞增殖,且与对照组相比,DZNeP处理组的增殖抑制率均升高(P<0.05);高浓度DZNeP(20 μmol/L)处理72 h后的细胞基本死亡。见表2。
2.3DZNeP对MCF-7细胞、MDA-MB-231细胞凋亡的影响DZNeP在2.5~20 μmol/L范围内可诱导MCF-7、MDA-MB-231细胞凋亡,且与对照组相比,DZNeP处理组的凋亡率均升高(P<0.05);DZNeP各浓度处理48 h的凋亡率均高于24 h(P<0.05)。见表3,表4。
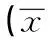
表1 不同浓度DZNeP作用于MCF-7细胞的增殖抑制率±s,%)
与0 μmol/L组比较:1)P<0.05;与2.5 μmol/L组比较:2)P<0.05;与5 μmol/L组比较:3)P<0.05;与10 μmol/L组比较:4)P<0.05;表2~表4同
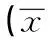
表2 不同浓度DZNeP作用于MDA-MB-231细胞的增殖抑制率±s,%)

表3 DZNeP对MCF-7细胞凋亡的影响

表4 DZNeP对MDA-MB-231细胞凋亡的影响(%)
2.4DZNeP对乳腺癌细胞相关信号通路的影响
2.4.1PI3K/Akt通路与对照组相比,20 μmol/L DZNeP处理72 h后MCF-7细胞和MDA-MB-231细胞的PTEN水平均升高,Akt水平均降低(P<0.05)。见图1、表5。
2.4.2Wnt/β-catenin通路与对照组相比,20 μmol/L DZNeP处理72 h后MCF-7细胞和MDA-MB-231细胞的β-catenin、Cyclin D1和C-myc水平均降低(P<0.05)。见图1、表5。
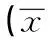
表5 DZNeP对乳腺癌细胞相关通路的影响±s)
与对照组比较:1)P<0.05

图1 DZNeP对乳腺癌细胞相关信号通路蛋白表达的影响
3 讨 论
研究发现,EZH2在多种肿瘤组织中异常高表达〔6,7〕,其可通过转录后修饰来沉默抑癌基因的表达,其中包括促凋亡基因及抑制癌细胞恶性转化的基因,继而促进肿瘤组织的生长和浸润〔8〕。EZH2在消化道肿瘤中表达的研究较为广泛,如邓飞等〔6〕的研究指出EZH2高表达与结肠癌患者的淋巴结转移及Duke分期有关,高德全等〔7〕发现EZH2与胃癌的浸润深度、TNM分期、分化程度及淋巴结转移均有关。此外,EZH2还参与了癌细胞的上皮间质转化和干细胞干性调节〔9〕。然而,EZH2与乳腺癌细胞增殖、凋亡的关系目前尚不明确。
DZNeP为S-腺苷同型半胱氨酸水解酶抑制剂,在多种恶性肿瘤细胞均发现,其可通过抑制EZH2表达来发挥抗肿瘤作用,有望成为靶向治疗的候选药物〔8〕。异常增殖是恶性肿瘤的基本特征,DZNeP已被证实可抑制食管鳞状细胞癌 Eca109细胞、头颈部鳞癌Tb3.1细胞及结肠癌HCT116细胞的增殖〔9~11〕。本研究采用MTT法检测发现,DZNeP处理后两种乳腺癌细胞的增殖能力均受抑制,且增殖抑制率受作用时间和浓度的影响,表明DZNeP可抑制乳腺癌细胞的增殖过程。此外,诱导细胞凋亡是DZNeP抑制肿瘤恶性转化的基本方式之一,本研究也证实DZNeP可诱导两种乳腺癌细胞的凋亡,与相关的报道一致〔9~11〕。以上指出DZNeP在乳腺癌的治疗上有较好的前景,但仍需临床前期研究的结果支持。
EZH2表达可影响抑癌基因的表达,导致与癌细胞恶性高度相关的信号通路激活,如PI3K/Akt通路和Wnt/β-catenin通路〔12,13〕。本研究结果显示,DZEeP对PI3K/Akt通路起负性调节作用的抑癌基因PTEN水平升高,而处于PI3K/Akt通路中心环节的Akt水平降低,提示DZNeP可抑制乳腺癌细胞中PI3K/Akt通路的活化。同时,Wnt/β- catenin通路的关键分子β-catenin、C-myc和Cyclin D1水平均降低,提示DZNeP对Wnt/β-catenin通路活化也有较好抑制效果。鉴于DZNeP处理后抑癌基因PTEN的水平升高,而癌基因C-myc水平降低,进一步提示EZH2可通过抑制抑癌基因的表达来促进癌细胞的增殖,EZH2有望成为癌症靶向治疗的新靶点。
1Siegel RL,Miller KD,Jemal A.Cancer statistics,2016〔J〕.CA Cancer J Clin,2016;66(1):7-30.
2刘曦宇,裴长艳,崔有斌,等.基因芯片检测甲基化在中老年食管鳞状细胞癌(ESCC)中的应用前景〔J〕.中国老年学杂志,2014;34(15):4408-12.
3Liu TP,Hong YH,Tung KY,etal.In silico and experimental analyses predict the therapeutic value of an EZH2 inhibitor GSK343 against hepatocellular carcinoma through the induction of metallothionein genes〔J〕.Oncoscience,2016;3(1):9-20.
4Liu S,Chen D,Shen W,etal.EZH2 mediates the regulation of S100A4 on E-cadherin expression and the proliferation,migration of gastric cancer cells〔J〕.Hepatogastroenterology,2015;62(139):737-41.
5Sun S,Yu F,Zhang L,etal.EZH2,an on-off valve in signal network of tumor cells〔J〕.Cell Signal,2016;28(5):481-7.
6邓飞,李拥军,蔡正斌,等.结肠癌组织中EZH2和PTEN基因表达与临床病理特征的相关性分析〔J〕.现代肿瘤医学,2015;23(17):2466-9.
7高德全,赵彦婷,刘云云,等.EZH2在胃癌组织血管生成中的作用及意义〔J〕.河北医药,2013;35(22):3391-2.
8Wei FZ,Cao Z,Wang X,etal.Epigenetic regulation of autophagy by the methyltransferase EZH2 through an MTOR-dependent pathway〔J〕.Autophagy,2015;11(12):2309-22.
9王晶,刘新秀,刘涛,等.EZH2基因在结直肠癌肿瘤干细胞化疗中的临床意义及耐药作用〔J〕.中国老年学杂志,2015;35(22):6436-8.
10王瑞莉,李庆华,张彦婷,等.DZNep对 Eca109细胞增殖、凋亡及迁移能力的影响〔J〕.郑州大学学报(医学版),2014;49(4):449-52.
11孔令平,周旋,孙姗姗,等.EZH2抑制剂DZNEP影响人头颈部鳞癌增殖与凋亡的体内外研究〔J〕.天津医科大学学报,2015;21(6):461-5.
12Riquelme E,Behrens C,Lin HY,etal.Modulation of EZH2 expression by MEK-ERK or PI3K-AKT signaling in lung cancer is dictated by different KRAS oncogene mutations〔J〕.Cancer Res,2016;76(3):675-85.
13Jung HY,Jun S,Lee M,etal.PAF and EZH2 induce Wnt/β-catenin signaling hyperactivation〔J〕.Mol Cell,2013;52(2):193-205.
〔2015-11-17修回〕
(编辑徐杰)
吐鲁洪·沙列尔(1963-),男,主任医师,硕士生导师,主要从事乳腺疾病研究。
迪力夏提·金斯汗(1982-),男,主治医师,硕士,主要从事乳腺疾病研究。
R739
A
1005-9202(2016)16-3877-03;doi:10.3969/j.issn.1005-9202.2016.16.004

