腺病毒adv-hmepe质粒构建与转染表达优化
张慧明 魏 巍 刘 爽
(佳木斯大学,黑龙江 佳木斯 154002)
腺病毒adv-hmepe质粒构建与转染表达优化
张慧明魏巍刘爽
(佳木斯大学,黑龙江佳木斯154002)
目的构建人细胞外基质磷酸糖蛋白(hmepe)基因的重组腺病毒pYr-ads-4-hMEPE真核表达载体,并优化其转染条件。方法构建腺病毒包装质粒pYr-ads-4-hMEPE,在HEK293细胞中包装形成腺病毒颗粒,转染前列腺上皮细胞株RWPE1,同时转染空质粒作为对照细胞株。设置腺病毒重组质粒梯度检测最佳转染浓度,免疫印迹检测转染细胞株中MEPE蛋白表达水平,确定转染效果。共聚焦显微镜检测不同条件下的转化率。结果经酶切与测序验证,pYr-ads-4-hMEPE重组质粒构建成功,免疫印迹分析验证转染rAd-4-hMEPE的RWPE1细胞株中MEPE蛋白表达水平上调,而转染相应空载体的细胞株中MEPE蛋白的表达水平与野生型细胞株一致,说明腺病毒质粒构建成功可在真核细胞表达,共聚焦检测分析质粒浓度对转染效率可信度较好。结论成功构建hmepe真核表达载体,重组腺病毒转染RWPE1细胞最佳融合比例1.25∶1 000,即质粒量为1.25 μl加入1 ml培养液中转染效率最佳。
腺病毒;转染;优化
病毒载体作为基因治疗技术的手段被广泛应用〔1〕,通过对病毒基因组的改造,使之能够携带外源目的基因和相关的病毒元件,并被包装成病毒颗粒。病毒转染宿主细胞,使携带的外源基因在宿主体内表达〔2〕,其中腺病毒质粒是常用的真核表达载体。腺病毒不会将外源基因插入目的基因组,虽不能长期稳定表达,只能瞬时转染,但操作安全性优于慢病毒,因此广泛应用于实验研究。通常腺病毒转染效率较高并可以转染任何细胞株,但实际应用中需要优化条件,以达到最佳转染结果且减少病毒使用量,增加安全性〔3〕。本实验构建了腺病毒人细胞外基质磷酸糖蛋白(hmepe)真核表达质粒,并研究其最佳转染条件,为研究MEPE在前列腺癌细胞中的功能奠定实验基础。
1 材料与方法
1.1材料前列腺上皮细胞RWPE1、人胚肾细胞NHK293购自中国科学院上海细胞所;大肠杆菌DH5α感受态细胞实验室保存;表达克隆载体pYr-adshuttle-4以及Adenovirus Expression System重组腺病毒构建体系均购自长沙赢润生物技术有限公司;PCR酶、限制性内切酶购自Takara公司;T4 DNA Ligase购自NEB公司;Marker Ⅳ购自长沙赢润生物技术有限公司;质粒小提试剂盒、胶回收试剂盒,普瑞麦格生物技术有限公司自产;其他常规试剂均为国产;引物合成、测序均在上海英骏生物技术有限公司完成;细胞培养常用材料与耗材等。
1.2方法
1.2.1构建pYr-ads-4-hMEPE质粒本实验室保存人MEPE蛋白的cDNA序列质粒,PCR扩增。上游引物PRIMER1:GTG AAT AAA GAA TAT AGT ATC AGT;下游引物PRIMER2:CTA GTC ACC ATC GCT CTC ACT。PCR反应条件:94℃ 5 min,94℃ 20 s,55℃ 20 s,72℃ 1 min 40 s,72℃ 7 min,30个循环。胶回收试剂盒回收PCR产物。质粒pYr-adshuttle-4载体和插入片段hmepe分别用NheⅠ、HindⅢ双酶切。酶切产物连接后转化DH5α感受态细胞,选1~2阳性克隆酶切测序鉴定。
1.2.2构建腺病毒质粒并转染细胞取pYr-ads-4-mMEPE 3 μl、pAd/PL-DEST(0.25 μg/μl)0.5 μl、LR Clonase Ⅱ 2 μl,25℃,1 h。加入蛋白酶K 1 μl,37℃,15 min得重组腺病毒质粒。用PacⅠ酶切重组腺病毒质粒,37℃水浴反应3 h。酶切后产物中加70 μl TE缓冲液(pH 8.0)及100 μl酚、氯仿、异戊醇的混合物,混匀。15 000 r/min离心5 min,取上清至干净的1.5 ml EP管中。加入3 mol/L乙酸钠(NaOAc) 10 μl,混匀,加入350 μl 无水乙醇,混匀。-80℃冷冻15 min,15 000 r/min离心15 min。70%酒精洗涤2遍,用10 μl H2O充分溶解。使用 METAFECTENETM(Biontex公司) lipid,将DNA与lipid融合,对指数生长期HEK 293细胞进行转染。24 h后,换培养基为10%胎牛血清(FBS)的完全培养基。转染3 d,每天观察细胞病态反应(CPE),>50%细胞脱壁时即收细胞进行裂解收病毒。测定病毒滴度为TCID50=10-4.2/100 μl 病毒。
1.2.3病毒质粒转染细胞鉴定取指数生长期细胞RWPE1接种于6孔培养板中,分别铺3个复孔,37℃培养过夜后转染腺病毒质粒,磷酸盐缓冲液(PBS)洗涤,加入无血清培养基病毒颗粒混合液,1 ml无血清培养基中分别加入0.5、1.25、2.5、3.75、5 μl病毒质粒,转染6 h后换为正常培养基,24 h后得到转染的细胞,4%多聚甲醛固定,4,6-二脒基-2-苯基吲哚(DAPI)染核,激光共聚焦显微镜观察。随机选取10个视野,每个视野下确定DAPI染色的细胞总数,然后确定MEPE高表达的激发绿色荧光的细胞数。计算转染效率。转染率=绿色荧光细胞(个)/蓝色细胞核(个)×100%。
1.2.4免疫印迹检测MEPE蛋白在转染细胞株中表达情况取指数生长期RWPE1细胞,按1.2.3步骤操作,种板、转染,离心收集细胞,裂解细胞抽提蛋白。然后加入等体积的2×上样缓冲液,煮沸10 min,进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE),电泳转膜后用5%脱脂奶封闭1 h,一抗室温结合1 h,洗膜后,加入辣根过氧化物酶(HRP)标记的二抗,室温结合1 h,洗膜后加增强化学发光法(ECL)显色液作用3 min,压片显影。
2 结 果
2.1经酶切与测序验证pYr-ads-4-mMEPE重组质粒构建成功,载体7 015 bp,目的片段1 575 bp。见图1。
2.2腺病毒重组质粒与细胞液的比例对转染率的影响不同质粒的量分别加入1 ml细胞培养液中,随着加入质粒量的升高,转染率逐渐增大,1.25 μl时转染效率最佳,增加病毒量转染率无明显变化;但达到5 μl时细胞大量死亡。见图2,表1。

图1 酶切验证质粒构建pYr-ads-4-mMEPE琼脂糖电泳图

图2 共聚焦检测腺病毒重组质粒转染效率
2.3免疫印迹检测转染rAd-4-hMEPE的RWPE1细胞株蛋白表达水平转染相应空载体的细胞株中MEPE蛋白表达水平与野生型细胞株一致,说明腺病毒质粒构建成功并可在真核细胞表达。随着质粒量的不同,转染效率不同;质粒0.5 μl时转染率较低,1.25 μl时较高,随后增加质粒的量转染效率无显著性差异。成功构建hmepe真核表达载体,重组质粒的量为1.25 μl时转化率最佳。见图3。

图3 Western印迹检测各个细胞株中MEPE蛋白表达趋势
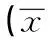
表1 不同腺病毒重组质粒量对细胞转染效率的影响±s)
3 讨 论
前列腺癌是老年男性常见的恶性肿瘤,是男性发病率较高的癌症之一〔4〕。前列腺癌发病隐匿,早期易发生骨转移,给诊断与根治带来困难,患者常以骨转移症状为首次就诊原因。MEPE蛋白作为分泌蛋白分布在细胞外基质中,含有多个磷酸化位点,具有类胰岛素因子的活性〔5〕,与成骨性骨转移有关,但因转染表达效率低影响对MEPE蛋白功能的研究。
腺病毒载体的特点是宿主范围广,对人致病性低,在增殖和非增殖细胞中感染和表达基因,能有效进行增殖,滴度高,可以通过不同的途径感染所有细胞类型,不整合到染色体中,无插入致突变性,不会影响目的基因的长期表达,能在悬浮培养液中扩增,相对稳定易于浓缩与纯化,能同时表达多个基因,这些优势使腺病毒成为外源基因转染机体细胞的表达载体,广泛应用于各种基因治疗。但是,作为载体腺病毒还有许多不足之处,细胞会产生免疫性反应,使重复感染失效〔6〕;另外,其毒性较大,用作转染细胞实验时需要对其毒性进行检测〔7〕。
本实验在RWPE1细胞株用rAD-4-hMEPE重组质粒瞬时转染,随着重组质粒的提高,转染率逐渐增大,当量为1.25 μl时转染率最佳,随后细胞出现CPE现象,转染率下降,细胞形态发生变化。可见转染质粒量不可以过大,细胞会因毒性太大而脱落。免疫印迹结果表明,转染rAd-4-hMEPE的RWPE1细胞株上调MEPE蛋白表达,生长形态良好。重组质粒构建成功,可在真核细胞内表达,当质粒量达到1.25 μl时转染效率明显增高,继续增加质粒量转染效率没有太大变化。成功构建hmepe真核表达质粒是研究前列腺癌骨转移的前期试验,MEPE 表达可对恶性肿瘤的发生、转移做出预测,为恶性肿瘤基因治疗奠定基础。而且,检测MEPE的表达水平还可监测肿瘤治疗的预后,为肿瘤基因治疗提供新的靶点。
1Wu TL,Zhou DM.Viral delivery for gene therapy against cell movement in cancer〔J〕.Adv Drug Deliv Rev,2011;63(8):671-7.
2Miller AD.Cationic liposome systems in gene therapy〔J〕.Drugs,1998;1(5):574-83.
3Barouch DH,Alter G,Broge T,etal.Protective efficacy of adenovirus-protein vaccines against SⅣ challenges in rhesus monkeys〔J〕.Science,2015;349(6245):320-4.
4Arterburn D,Wellman R,Westorook ED,etal.Decision aids for benign prostatic hyperplasia and prostate cancer〔J〕.Am J Manag Care,2015;21(2):e130-40.
5Wilmott RW,Amin RS,Perez CR,etal.Safety of adenovirus-mediated transfer of the human cystic fibrosis transmembrane conductance regulator cDNA to the lungs of nonhuman primates〔J〕.Hum Gene Ther,1996;7(3):301-18.
6Landin AM,Kim JW,Chaudhari N.Liposome-mediated transfection of mature taste cells(J).J Neurobiol,2005;65(1):12-21.
7Drezner MK,Quarles LD,Mundy GR.MEPE has the properties of an osteoblastic phosphatonin and minhibin〔J〕.Bone,2004;34(2):303-19.
〔2016-05-09修回〕
(编辑袁左鸣)
国家自然科学基金资助项目(No.31471213);黑龙江省自然科学基金资助项目(No.D201208);佳木斯大学科学技术重点项目(No.Sz2013-003);佳木斯大学研究生科技创新项目理科面上 (No.LM2014_002)
刘爽 (1975-),女,博士,硕士生导师,主要从事肿瘤转移机制研究。
张慧明(1981-),女,硕士,主要从事肿瘤转移机制研究。
R735.7
A
1005-9202(2016)16-3901-03;doi:10.3969/j.issn.1005-9202.2016.16.014

